RESEARCH PROGRESS ON THE GENETIC BASIS OF NATURAL SEX REVERSAL AND VARIETIES BREEDING IN MONOPTERUS ALBUS
-
摘要:
黄鳝(Monopterus albus)是第一个被发现的具有雌雄同体自然性逆转特性的脊椎动物。先雌后雄性别转变过程中性腺内细胞的重构及分子调控机制研究对于阐明鱼类生殖发育的机理具有重要科学价值。黄鳝是我国重要淡水名特优养殖鱼类, 年养殖产量超30万吨, 苗种繁育困难、缺少优良养殖品种一直是制约产业发展的瓶颈。文章综述了国内外学者在黄鳝性逆转过程和调控机理基础研究的现状, 以及近年在黄鳝优良种质创制技术和品种培育取得的突破性进展, 以期为揭示黄鳝性逆转遗传基础这一经典而又极富挑战性的科学问题提供有益启示, 促进黄鳝养殖产业高质量发展。
Abstract:Monopterus albus is the first vertebrate species to be identified as exhibiting the natural phenomenon of hermaphroditism and sex reversal. The transition from ovary to spermatheca in Monopterus albus is characterised by significant changes in cell types and gene expression. Elucidation of these mechanisms is of considerable value in our understanding of reproductive development in fish. Monopterus albus is a commercially significant aquaculture species in China. The difficulty of artificial fry breeding and the lack of high-quality varieties represent the bottlenecks limiting Monopterus albus farming development. This review presents the current status of basic research on the sex reversal process and regulation mechanism of Monopterus albus, as well as recent advancements in breeding technique, the creation of excellent germplasm, and the cultivation of diverse varieties. The objective is to provide valuable insights into the regulatory mechanism of sex reversal in Monopterus albus, a classic yet challenging scientific issue, with the aim of promoting the high-quality development of the aquaculture industry.
-
Keywords:
- Hermaphrodite /
- Sex reversal /
- Genetic regulation /
- Varieties breeding /
- Monopterus albus
-
黄鳝(Monopterus albus), 俗称鳝鱼、田鳝、长鱼等, 分类学上隶属辐鳍鱼纲、合鳃鱼目、合鳃鱼科、黄鳝属, 主要分布于东亚、东南亚和南亚地区, 澳大利亚北部和美国东南部也发现其存在[1]。黄鳝肉质细嫩、味道鲜美、营养丰富, 是我国重要的淡水名特优养殖鱼类。在湖北、江西、安徽、湖南、四川等地广泛养殖, 2023年养殖产量达35.52万吨(2024渔业统计年鉴), 产值约230亿元。黄鳝具有雌雄同体、先雌后雄自然性逆转的特性, 自刘建康先生80年前在世界上首次发现黄鳝这一独特生殖特性以来, 现已确定约有6%的硬骨鱼类(约1500种)存在雌雄同体自然性逆转的现象[2, 3]。包括黄鳝在内的雌雄同体鱼性逆转的遗传基础不仅一直是经典且极富挑战性的科学问题, 而且自然性逆转特性还导致黄鳝的规模化人工繁育和遗传育种非常困难, 迄今没有人工选育的优良品种, 养殖苗种极度短缺。近年来, 我国学者在黄鳝性别转变的调控机理、种质创制关键技术、优良品种培育等方面取得了重要发现和突破性进展。为此, 本文综述了黄鳝自然性逆转的遗传基础与优良种质创制相关研究的进展, 以期为揭示黄鳝性逆转的遗传机理和培育优良养殖新品种提供有益的启示。
1. 黄鳝雌雄同体自然性逆转现象的发现
我国鱼类生物学家刘建康先生最早发现黄鳝具有雌雄同体自然性逆转特性, 开创脊椎动物性逆转研究新领域。20世纪30年代, 刘建康在研究黄鳝繁殖习性过程中, 观察到黄鳝的性别明显与体重和年龄相关, 分析野外采集的659尾黄鳝性腺组织结构, 发现稚鱼全部为雌性, 小型及中型成鱼(体长小于35.9 cm) 90%为雌性, 而大型成鱼(体长超过36 cm) 80.3%为雄性。1944年, 基于上述发现, 刘健康先生发表了黄鳝具有“原始雌雄同体”现象的研究论文 [4], 这是关于黄鳝是一种雌雄同体自然性逆转鱼类的最早报道, 也是首次在脊椎动物中发现性逆转现象[5]。1947年, 英国皇家学会会员布洛(W.S. Bullough)[6]在《自然》杂志上发表题为“低等脊椎动物的雌雄同体性”的文章, 指出刘建康关于黄鳝性逆转特性的报道为低等脊椎动物的性别决定机制提供了新的有趣证据, 并为脊椎动物性别研究开辟了新的领域。随后, 国内外学者相继对黄鳝性腺发育进行了观察。Liem[7]分析了印度尼西亚野外捕捞和实验室饲养的黄鳝性腺组织结构和性别比例, Chan和Phillips[8]分析了中国香港和广东地区野外捕捞的黄鳝性腺组织和性别比例, 均证实黄鳝具有自然性逆转特性。Chan等[9]通过活体跟踪同一条黄鳝性腺组织变化过程, 进一步证实雄性是雌性经由间性阶段转变而来, 并未发现雄性转变为间性或雌性的现象。自黄鳝自然性逆转现象发现至今, 已有约6%的硬骨鱼确定为雌雄同体, 根据雌雄同体鱼性腺转变的特征大致可分为3种类型: 雌性先熟(如黄鳝、石斑鱼Epinephelus merra等)、雄性先熟(如黑鲷Acanthopagrus schlegelii、黑双锯鱼Amphiprion melanopus等)、雌雄同步成熟(如红点叶虾虎鱼Gobiodon erythrospilus等)[10]。包括黄鳝在内的雌雄同体鱼自然性逆转的遗传基础一直是国内外学者研究的重要科学问题。
2. 黄鳝自然性逆转过程及其性腺形态变化
早期关于黄鳝自然性逆转研究主要针对自然环境中黄鳝性转变的诱因展开, 提示可能是年龄、体长、体重、产卵及环境条件等多重因素作用的结果。通过分析黄鳝年龄、体长、体重等与性转变的相关性, 发现性别与年龄和体长关系较密切。不同生存环境、地理位置的黄鳝发生性转变时体长存在明显差异, 印度尼西亚万隆地区黄鳝开始性转变时体长约为16 cm[7], 中国香港和广东地区的黄鳝在体长为20 cm左右时开始性转变[8], 中国天津地区的黄鳝雌鱼体长达到40 cm左右或生长到2年龄时开始发生性转变[11, 12]。关于雌性黄鳝性逆转的起始时间, Chan和Phillips[8]于1967年最早提出“黄鳝产卵后性逆转”的观点, 认为雌性产卵后导致体内雌激素水平迅速下降, 这可能是促发卵巢向精巢转变的诱因。但是, 近年的研究发现雌鳝产卵之后不必然发生性逆转, 而未经历产卵的黄鳝也可以转变为雄性。周秋白等[13]观察到已产卵黄鳝在第2年雌性比例仍占50%以上, 怀卵未产的雌鳝经过1年的饲养后有约11%的个体转变为间性。范淼等[14]对实验室条件下饲养的黄鳝性别进行分析, 发现5月龄的幼鱼及1年龄的成鱼中均存在间性和雄性个体, 养殖期间黄鳝未出现产卵和繁殖行为。这表明产卵并非雌性黄鳝发生性转变的必经过程。
黄鳝性腺中雄性生殖细胞的来源一直是非常有趣而又令人困惑的科学问题, 黄鳝性逆转过程中性腺形态变化和细胞类型的研究结果为揭开其神秘面纱提供了重要线索。刘建康先生[15]1950年描述了黄鳝雌转雄过程中生殖腺组织的改变。雌性生殖腺壁连同两个负卵褶结缔组织增厚, 为性逆转开始的征兆。雄性原始生殖细胞随即散见于负卵褶的内侧, 并逐渐增殖。雄性生殖细胞由褶内侧向外缘扩展, 最后遍及全褶。雄性生殖细胞增殖过程中, 自行排列于基膜上形成曲折盤绕的造精小管。造精小管壁内雄性生殖细胞集成小巢, 逐渐发育为成熟的精子。组织学切片分析表明黄鳝孵化后7d性腺内开始出现卵巢腔, 生殖细胞分化为卵原细胞; 孵化后14d卵母细胞进入第一减数分裂的细线期; 孵化后30d卵母细胞发育到双线[16]。黄鳝雌性阶段卵原干细胞分散或成团分布于生殖褶, 性逆转时位于生殖褶的原始精原干细胞启动分裂并发育形成精小囊, 间性时期可观察到退化的卵细胞和精原细胞共存于生殖腔。间性及雄性阶段生殖褶内分化出具有精原干细胞特征的A、B两种类型的生殖干细胞[17, 18]。黄鳝性逆转时生殖腺滤泡细胞变得肥大充满分泌物。卵母细胞的微绒毛、线粒体与放射带退化, 卵黄液化, 滤泡细胞吞噬卵黄颗粒并消化吸收[19]。中国科学院水生生物研究所发现黄鳝间性性腺培养得到的生殖干细胞具有两种形态特征, 分别类似于雌性生殖干细胞(fGSCs)和精原干细胞(SSCs)[20]。近期, 单细胞转录组测序分析发现间性性腺内具有13个细胞类群, 包括生殖干细胞、原始卵母细胞、精原细胞、精母细胞、精子细胞和性腺体细胞等。生殖干细胞系中又分为5个亚群: 早期生殖干细胞、晚期生殖干细胞、早期精原细胞A、晚期精原细胞A及雌性生殖干细胞。这些亚簇具有两种发育轨迹, 即晚期生殖干细胞到晚期精原细胞A的精子发生路径, 晚期生殖干细胞到雌性生殖干细胞的卵子生成路径。早期生殖干细胞中表达有原始生殖细胞(PGC)标记基因, 包括nanos2、nanos3和nanog, 表明这是一组原始生殖干细胞。因此, 早期生殖干细胞和晚期生殖干细胞可能是生殖干细胞的两种祖细胞状态。晚期生殖干细胞有可能分化为雄性或雌性生殖干细胞[21]。这提示黄鳝性腺可能一直存在原始生殖干细胞和晚期生殖干细胞, 具有双向分化为卵原细胞或精原细胞的能力, 雌性阶段分化为卵原细胞, 而雄性阶段分化精原细胞。
3. 黄鳝性腺发育和性逆转的分子调控机制研究
黄鳝性腺发育和性逆转的分子调控机制一直是研究的重点。黄鳝是已知染色体数目最少的鱼类之一, 不同地理种群染色体数目在18—24条[22, 23]。随着基因组测序技术的发展, 武汉大学首先开展了黄鳝基因组测序和染色体水平的组装[24]。中国水产科学研究院长江水产研究所对生长和繁殖性状优良的“深黄大斑黄鳝”基因组进行了测序和组装[25]。黄鳝基因组较小, 约为 0.8 Gb, 注释到22373个蛋白编码基因, 分布于12个染色体连锁群[24, 25]。基因组测序发现, 黄鳝进化过程中经历了3次全基因组复制和4次基因组裂变/融合事件, 导致染色体高度融合[26]。黄鳝的每条染色体均涉及到裂变/融合以及基因组区块的重排和丢失事件, 染色体融合带来的持续进化压力可能有助于物种的生存[26]。黄鳝基因组测序组装为解析性逆转的分子调控机制奠定了基础。
3.1 雌雄分化因子对黄鳝性腺分化和性逆转的调控作用
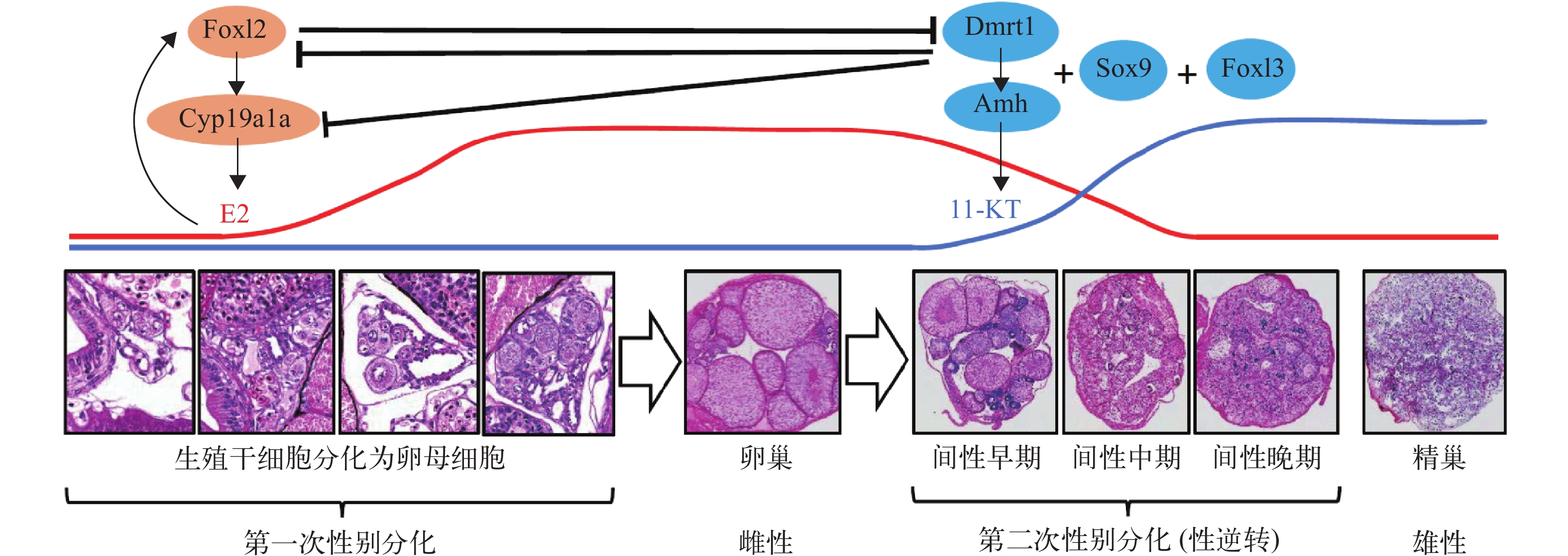
黄鳝性逆转的本质是两次性别分化的过程, 幼鱼期性腺首先分化发育为卵巢, 成鱼期卵巢退化, 性腺再分化为精巢。两次性别分化的路径是雌雄信号通路之间的平衡与调控(图 1)。转录组测序分析发现黄鳝幼鱼性腺分化过程中雌雄分化相关基因均表达, 而雌性分化因子(Foxl2、Cyp19a1a、Era、Wnt4等)的mRNA表达量显著高于雄性分化因子(Dmrt1a、Dmrt1b、Sox9a2、Cyp26b1等)[27]。黄鳝性腺分化起始阶段即可检测到芳香化酶(Aromtase)基因cyp19a1a和雌激素受体基因erb的表达, 孵化后8d性腺内foxl2和cyp19a1a表达量显著升高[16]。采用Morpholino技术敲降黄鳝胚胎期dnd基因表达, 获得特异消除原始生殖细胞(PGCs)的胚胎, 发现缺失原始生殖细胞的黄鳝幼鱼性腺发育成具有 Sertoli 细胞和 Leydig 细胞的精巢结构, 雌性分化相关基因foxl2和cyp19a1a表达量显著降低, 雄性分化相关基因dmrt1、sox9a、gsdf和amh表达量显著升高, 提示黄鳝性腺起始分化发育为卵巢与PGC有无或数目密切相关[28]。本文推测原始生殖细胞的数量及其调控因子可能在黄鳝性腺先发育为卵巢过程中扮演了重要角色, 可能存在某个尚不为人所知的PGC数量阈值, 当PGC的数量超过该阈值, 则黄鳝性腺分化发育为卵巢; 若低于该阈值, 则性腺分化发育为精巢。
叉头状转录因子(Forkhead transcription factor, Fox)超家族成员和雌激素是鱼类雌性分化的关键调控因子。Foxl2通常在雌性中作用于雌激素合成的关键信号分子cyp19a1表达, 上调雌激素的合成, 促进卵巢发育。黄鳝基因组鉴定到foxl2、foxl2l和foxl3三个同源基因。黄鳝foxl2基因在雌性性腺分化早期开始表达, 在性腺发育过程中表达量逐渐升高[27]。成熟期卵巢中foxl2表达于颗粒细胞, 雌性向雄性转变时foxl2表达量急剧下降, 间性性腺和精巢内仅少量的间质细胞检测到表达。foxl2可能对黄鳝卵巢发育和雌性状态维持具有重要作用[29]。但是, 采用多靶点基因编辑技术在黄鳝中敲除foxl2基因, 基因突变率高的P0代个体早期性腺仍然发育为卵巢[30], 黄鳝foxl2基因功能的解析有待进一步获得纯合突变的群体后开展深入研究。黄鳝foxl2l基因在卵巢、间性性腺和精巢中均有表达, 在间性性腺和精巢的表达量显著高于卵巢。在精巢中主要表达于Sertoli细胞和精原细胞, 可能发挥促进精子发生的作用[31]。黄鳝foxl3基因在卵巢中表达量非常低, 采用芳香化酶抑制剂处理人工诱导黄鳝卵巢向精巢转变时foxl3表达量急剧升高, 提示foxl3可能发挥促进精巢发育的功能[32]。芳香化酶是雌激素合成的关键限速酶, 与其他鱼类类似, 黄鳝有两个编码芳香化酶的基因, cyp19a1a主要表达于卵巢, cyp19a1b主要表达于下丘脑。性逆转过程中性腺内cyp19a1a mRNA表达量显著降低, 间性阶段cyp19a1b mRNA在下丘脑中表达量显著升高而垂体中的表达量显著降低[33, 34]。采用芳香化酶抑制剂处理幼龄期的黄鳝可诱导其提前性逆转为雄性, 这表明雌激素信号通路在调控黄鳝性逆转过程中扮演关键角色[32]。
转录因子Sox、Dmrt家族成员及激素Amh是脊椎动物雄性性别决定和分化的关键因子。黄鳝基因组中发现有sox1、sox4、sox9、sox14和sox17等多个Sox家族基因[35]。黄鳝卵巢、间性性腺和精巢均检测到sox9a1和sox9a2基因表达, 表达位置主要是分布有生殖干细胞的性腺上皮层[36]。原位杂交分析表明sox17也主要表达于精巢、卵巢和间性性腺的上皮层, 以及精巢内的生精细胞[37]。黄鳝性逆转过程中Sox家族成员对生殖细胞分化具有重要的调控作用。卵巢向精巢转化时Sox9a1和Sox9a2与性激素受体Ar相互作用, 调节其在细胞核中的转录激活[38]。Sox9a1和Sox9a2还可以与srag基因启动子结合, 并促使其在Sertoli细胞中表达[39]。Dmrt1通常在雄性中抑制cyp19a1的表达, 降低雌激素的合成, 促进性腺向精巢分化。黄鳝dmrt1基因有四种亚型: dmrt1a、dmrt1b、dmrt1c和dmrt1d, 其中dmrt1a和dmrt1b表达量在黄鳝性逆转过程中逐渐上升, 间性末期和精巢中表达量剧增。整体上, dmrt1b基因表达水平低于dmrt1a基因[40]。黄鳝基因组还存在dmrt2、dmrt2b、dmrt3、dmrt4和dmrt5基因, 它们在卵巢向精巢转变时表达量显著升高, 且主要表达于发育中的生殖细胞[41]。但是, Drmt家族成员在黄鳝性逆转中的功能还不清楚, 仍需深入研究。黄鳝卵巢中几乎检测不到amh的表达, 间性性腺和精巢中表达量较高。黄鳝性逆转过程中amh表达量升高, Amh对黄鳝精巢发育和维持具有重要作用[42]。结合前述采用芳香化酶抑制剂可有效诱导黄鳝精巢发育, 进一步提示雌激素和雄激素信号通路的相互作用调控黄鳝性腺分化和性逆转。
3.2 基因表观遗传修饰调控黄鳝性腺分化和性逆转的作用
黄鳝雌性和雄性的基因组完全相同, 提示基因的甲基化修饰等表观遗传调控对性逆转起着重要的作用。液相色谱串联质谱法分析黄鳝内源的5-甲基-2′-脱氧胞苷(m5dC)和5-羟甲基-2′-脱氧胞苷(hm5dC)水平, 表明卵巢向精巢转变时DNA甲基化水平整体上调[43]。黄鳝性腺组织全基因组甲基化分析显示精巢中的甲基化水平高于卵巢, 精巢内大量基因的表达量与甲基化水平负相关[44]。DNA甲基转移酶Dnmt3同源基因在精巢中高表达, 雌激素合成的关键基因foxl2和cyp19a1a编码区上游的启动子区域DNA甲基化水平显著上调[43, 45]。黄鳝间性性腺和精巢内cyp19a1a基因启动子cAMP反应元件(CRE)中CpG甲基化水平高于卵巢, CRE元件周围的远端区域及包含类固醇生成因子1/肾上腺4结合蛋白位点和TATA框的近端区域甲基化水平与性逆转过程中cyp19a1a基因的表达水平呈反向相关。精巢中cyp19a1a启动子远端区域和近端区域的组蛋白3 (Lys9)被去乙酰化和三甲基化, 从而不能被磷酸化的CRE结合蛋白激活[46]。此外, 采用液相色谱−串联质谱法测定黄鳝性腺分化过程中组蛋白H2a、H2b、H3和H4的乙酰化、甲基化和泛素化修饰水平, dmrt1基因中H2b K120处发生高度泛素化修饰, H2b K120处的单泛素化与精子发生密切相关[47]。尽管黄鳝性腺分化和性逆转过程中雌雄分化相关基因表达模式与表观遗传调控分析已取得较多进展, 但是性逆转的关键诱发基因和信号通路仍不清楚。为了全面比较分析脊椎动物性逆转过程的基因表达差异, 本团队整合了从海洋鱼类到哺乳动物的18个物种性别反转相关数据, 构建了包括黄鳝在内的动物性逆转信号通路数据库。分析了性别逆转相关基因在性别逆转或性别决定过程中的动态表达模式, 挖掘出动物性别逆转相关基因及其调控网络[48]。性逆转数据库可为发掘黄鳝性腺发育和性逆转关键基因或调控元件提供重要线索。
3.3 生殖内分泌激素调控黄鳝性逆转的功能
脑、垂体、性腺产生的内分泌激素在调控鱼类性腺分化发育和生殖活动具有重要作用。黄鳝脑部促性腺激素释放激素GnRH2转录本的选择性剪切与性逆转密切相关, 剪切产生的新型GAP2多肽可显著促进雄性分化因子amh、dmrt1a、sox9a1等基因的表达[49]。有研究表明雌鳝体内注射促性腺激素释放激素类似物(sGnRH-A)导致血液中雌二醇含量下降而睾酮水平升高, 并促使卵巢向精巢转变[50]。另外, 黄鳝脑部产生的褪黑素水平与生殖周期密切相关, 自然产卵时血液的褪黑素含量较低, 产卵后性逆转起始阶段褪黑素含量迅速升高[51]。黄鳝脑组织分泌激素可能在诱发其性逆转的起始阶段发挥重要作用。雌鳝体内注射鲤垂体提取物导致血液中雌二醇含量升高, 刺激卵巢的发育[50]。黄鳝体内注射哺乳动物的黄体生成素(LH)能够刺激卵巢中静止的雄性生殖干细胞发育, 促使性腺上皮层中Leydig细胞增殖, 卵巢向精巢转变[52]。垂体激素种类较多, 目前关于其调控黄鳝性逆转的研究还非常有限, 尚不能得出明确的结论。采用放射性氚标记的孕烯醇酮体外孵育黄鳝不同阶段的性腺组织, 发现雌性性腺产生更多的放射性雌二醇, 卵巢向精巢转变的间性性腺放射性雄激素含量显著升高[53]。繁殖前期雌性黄鳝血液中雄烯二酮含量升高, 繁殖期下降到非常低的水平。繁殖期雌性黄鳝体内雌二醇水平面显著高于间性和雄性。睾酮含量在整个繁殖周期内都保持低水平, 雄烯二酮含量在产卵后性逆转早期和中期性腺中最高[54]。2年龄的雌性黄鳝饲喂含戊酸雌二醇的饲料有效阻止卵巢向精巢转变, 激素浓度直接影响延迟性逆转的效果[55]。产卵后雌性黄鳝腹腔注射乙烯雌酚也可推迟性逆转期[56]。间性阶段或雄性黄鳝注射雌二醇可以抑制精子发生, 导致精巢小叶结构异常, 但不能诱导其转变为雌性[57]。然而, 采用甲基睾酮、睾酮、11-酮基睾酮等雄激素处理雌性黄鳝诱导性逆转为雄性的效果并不明显。采用甲基睾酮处理胚后期的黄鳝可诱导部分黄鳝性逆转为雄性[56]。采用甲基睾酮、睾酮、11-酮基睾酮等雄激素注射处理雌性黄鳝成鱼并不能促使卵巢发生性逆转[57]。采用芳香化酶抑制剂抑制幼鱼雌激素合成, 显著降低雌二醇水平, 1龄的黄鳝不经历卵巢成熟直接发育为雄性[32]。由此可见, 体内雌激素水平降低而非雄激素水平的升高是诱导黄鳝性逆转的重要因素。
4. 黄鳝种质创制与品种培育
黄鳝雌雄同体, 先雌后雄的性逆转特性, 既导致雌亲鳝因个体小而怀卵量少, 又造成雌亲鳝与雄亲鳝发育不同步, 难以同时培育稳定的雌雄亲鳝群体开展育种研发。黄鳝遗传育种的难度非常大, 迄今尚无人工培育的养殖新品种。黄鳝优良品种培育迫切需要建立优良种质精准创制技术。近年, 中国科学院水生生物研究所在黄鳝基因编辑、雄性定向发育、人工诱导雌核发育、人工诱导多倍体、生殖细胞异种移植、全基因组选育等关键育种技术方面取得了突破性进展。
基因编辑育种技术在水产遗传育种中发挥着越来越重要的作用。在建立黄鳝人工繁育技术的基础上, 中国科学院水生生物研究所首次报道了基于转录激活因子样效应物核酸酶(TALENs)的黄鳝基因编辑技术, 针对dmrt1、foxl2和cyp19a1a基因进行编辑获得了高突变率的育种材料[58, 59]。但是, 由于黄鳝雌雄亲鳝发育不同步, 无法采用经典的构建家系的方法, 通过两性杂交获得基因编辑纯合突变体。为此, 本团队进一步探索基于CRISPR/Cas9技术的多靶点黄鳝基因编辑方法, 可在原代获得靶基因近100%突变的个体, 为黄鳝基因功能研究和种质创制提供了有效手段[30]。黄鳝dmrt1基因突变体性腺内dmrt1和sox9a1基因表达量下调, foxl2和cyp19a1a基因编辑导致性腺内两者的表达量也均显著下降。cyp19a1a基因突变的黄鳝幼鱼性腺发育成类精巢的结构, foxl2基因编辑对性腺分化发育无明显影响[30, 58]。本团队已创制出foxl2、cyp19a1a、dmrt1等基因编辑新种质, 并开展纯合子家系培育工作。
黄鳝先雌后雄的生殖特性导致雌雄亲本发育不同步, 遗传育种研发缺少雄性亲本, 养殖生产中雄鱼培育周期长, 数量非常少。我们发现在黄鳝性腺分化发育关键时间窗口通过抑制雌激素合成, 可诱导黄鳝性腺第二次分化发育的时间提前, 可以将1年龄的黄鳝培育为雄性, 而且具备正常的繁殖力, 从而建立了人工诱导黄鳝雄性定向发育技术[32]。不仅解决了生产上雄性亲本培育周期长的难题, 而且克服了雌雄亲本发育不同步导致无法进行家系内自交选育的技术瓶颈, 同时, 还可以应用于基因编辑纯合突变体创制。
人工诱导雌核发育是采用灭活精子激活卵子发育, 通过静水压、温度休克, 或秋水仙素处理等物理、化学方法诱导染色体二倍化的生殖方式。运用雌核发育诱导技术可快速纯合遗传物质, 仅需两代便可获得完全纯合的克隆系, 因此雌核发育可快速稳定优良性状和建立纯系[60, 61]。其中卵子染色体组二倍化方法是人工诱导雌核发育的关键之一。本团队基于受精生物学分析, 探索了人工诱导黄鳝雌核发育的方法。组织切片分析了黄鳝受精卵第一次卵裂染色体分离的形态特征及其时间点, 发现受精后70—95min为卵裂中期。获得人工诱导雌核发育的关键参数, 建立了高效精准的黄鳝有丝分裂、减数分裂雌核发育技术[62, 63]。进一步选取具有优良养殖特性的野生“大黄斑”黄鳝进行雌核发育生殖, 获得的雌核发育群体染色体核型正常, 遗传纯合度显著提高。性腺的分化发育正常, 具备生殖能力[63]。黄鳝雌核发育为快速培育养殖新品种提供了高效的技术手段。
染色体组操作是鱼类细胞工程育种的有效方法, 在多种鱼类得到运用。黄鳝卵受精后5—6min采用40.5℃热激处理3.5min促使第二极体保留可诱导获得三倍体[64]。本团体在获得黄鳝受精卵第一次卵裂染色体分离时空参数的基础上, 开展了人工诱导黄鳝四倍化技术研究。在黄鳝卵受精后的65—100min采用静水压处理, 抑制第一次卵裂中期染色体分离, 诱导染色体组加倍, 建立了人工诱导黄鳝四倍化技术。人工诱导的四倍体黄鳝可存活并发育为成体, 流式细胞术检测体细胞DNA含量、染色体计数及血红细胞核面积分析等结果表明, 采用该技术可以创制出四倍体黄鳝新材料, 20月龄的四倍体黄鳝性腺发育为类精巢结构, 可能具备生殖能力[65], 对于培育四倍体黄鳝群体, 进而通过倍间杂交创制三倍体黄鳝具有重要意义。
本团队鉴定并分离出黄鳝胚胎期的原始生殖细胞和成性腺的生殖干细胞[20], 并将其移植到去除生殖细胞的鲤体内[66], 黄鳝原始生殖细胞和生殖干细胞能在鲤性腺中稳定定植, 从而初步建立了黄鳝“借腹生殖”技术流程[67]。通过分析黄鳝全同胞家系生长性状及全基因组关联作图发掘出黄鳝生长密切相关数量性状基因位点(QTL)[68], 黄鳝体色与全基因组关联分析发掘出黄鳝体色相关的基因和单核苷酸多态性位点(SNPs)[69]。
近年, 黄鳝优良品种选育方面也取得了重要进展。上海市农业科学院以黄河流域的优质野生黄鳝为基础群体, 采用群体选育法获得了选育至第五代的群体。中国水产科学研究院长江水产研究所以长江流域江汉平原的野生“大黄斑”黄鳝为基础群体, 采用家系选育法已获得了选育至第三代的群体。
5. 展望
黄鳝自然性逆转现象发现至今已80年, 国内外学者在性逆转的分子机理探索方面取得了重要进展。近年, 基因编辑技术与迅猛发展的多组学等分子遗传技术相结合, 为深入解析黄鳝性腺发育和性逆转的遗传机理和调控网络, 发掘具有重要育种价值的功能基因和关键调控元件提供了强有力技术支撑。雌雄信号通路调控因子直接的平衡与调控, 体内雌激素水平在黄鳝性腺分化和性逆转过程中发挥着关键作用。基于此发现已实现人工诱导黄鳝雄性定向发育。黄鳝基因编辑、雄性定向发育、雌核发育、多倍体诱导、生殖细胞异种移植和全基因组选育等技术的重要突破, 在此基础上多种技术结合建立黄鳝复合育种新技术, 将为进一步创建适用于黄鳝生殖特性的精准育种技术体系, 创制优良新种质, 进而培育养殖新品种奠定了基础。黄鳝自然性逆转性状遗传基础解析、复合育种技术创建、优良养殖品种培育对于促进我国黄鳝养殖产业高质量发展具有重要意义。
-
[1] Collins T M, Trexler J C, Nico L G, et al. Genetic diversity in a morphologically conservative invasive taxon: Multiple introductions of swamp eels to the Southeastern United States [J]. Conservation Biology, 2002, 16(4): 1024-1035. doi: 10.1046/j.1523-1739.2002.01182.x
[2] Wu G C, Dufour S, Chang C F. Molecular and cellular regulation on sex change in hermaphroditic fish, with a special focus on protandrous black progy, Acanthopagrus schlegelii [J]. Molecular and Cellular Endocrinology, 2021, 520: 111069.
[3] de Mitcheson Y S, Liu M. Functional hermaphroditism in teleosts [J]. Fish and Fisheries, 2008, 9: 1-43.
[4] Liu C K, Rudimentary hermaphroditism in the symbranchoid eel Monopterus javanensis [J]. Sinensia, 1944(15): 1-8.
[5] Zhou L, Gui J F, Jian-Kang Liu: A pioneer of sex determination studies in vertebrates [J]. Protein Cell, 2016, 7(1): 1-3.
[6] Bullough W S, Hermaphroditism in the lower vertebrates [J]. Nature, 1947, 160(4053): 9-11.
[7] Liem K F, Sex reversal as a natural process in the synbranchiform fish Monopterus albus [J]. Copeia, 1963, 1963(2): 303.
[8] Chan S T H, Phillips J G, Structure of gonad during natural sex reversal in Monopterus albus (Pisces: Teleostei) [J]. Journal of Zoology, 1967, 151(1): 129-141.
[9] Chan S T H, Wai-Sum O, Tang F, et al. Biopsy studies on the natural sex reversal in Monopterus albus (Pisces: Teleostei) [J]. Journal of Zoology, 1972, 167(4): 415-421. doi: 10.1111/j.1469-7998.1972.tb01733.x
[10] 赵会宏, 何琪, 张春丽, 等. 雌雄同体鱼类性别分化及性转变研究进展 [J]. 水产学报, 2022, 46(4): 644-656.] Zhao H H, He Q, Zhang C L, et al. A review of studies on sex differentiation and sex change in hermaphroditic fishes [J]. Journal of Fisheries of China, 2022, 46(4): 644-656. [
[11] 王良臣, 刘修业, 阎家本. 黄鳝生物学因素关系的研究 [G]. 鱼类学论文集, 1985(4): 147-153.] Wang L C, Liu X Y, Yan J B, et al. Study on the relationship between biological factors in Monopterus albus [G]. Transactions of the Chinese Ichthyological Society, 1985(4): 147-153. [
[12] 刘修业, 王良臣. 黄鳝性别与年龄、体长、体重等的关系及性腺的组织变化 [J]. 淡水渔业, 1987, 17 (6): 12-15.] Liu X Y, Wang L C. Relationship between sex and age, body length and weight of Monopterus albus and histological changes of gonad [J]. Freshwater Fisheries, 1987, 17 (6): 12-14. [
[13] 周秋白, 张燕萍, 李新华, 等. 鄱阳湖区黄鳝体长、体重与性比关系初步研究 [J]. 淡水渔业, 2004, 34(4): 24-26.] doi: 10.3969/j.issn.1000-6907.2004.04.008 Zhou Q B, Zhang Y P, Li X H, et al. A study on relationship between body length, body weight and sex ratio in Monopterus albus about the Poyang lake [J]. Freshwater Fisheries, 2004, 34(4): 24-26. [ doi: 10.3969/j.issn.1000-6907.2004.04.008
[14] 范淼, 杨威, 孙数, 等. 未产卵雌性黄鳝的性转变 [J]. 水生生物学报, 2021, 45(2): 387-396.] doi: 10.7541/2021.2020.142 Fan M, Yang W, Sun S, et al. Natural sex change of the “virgin” female ricefield eel Monopterus albus [J]. Acta Hydrobiologica Sinca, 2021, 45(2): 387-396. [ doi: 10.7541/2021.2020.142
[15] 刘建康, 顾国彦. 鳝鱼性别逆转时生殖腺组织改变 [J]. 科学, 1950, 2(3): 91.] Liu J K, Gu G Y. Morphological changes in the gonad of Monopterus during sex reversal [J]. Science, 1950, 2(3): 91. [
[16] He Z, Li Y, Wu Y, et al. Differentiation and morphogenesis of the ovary and expression of gonadal development-related genes in the protogynous hermaphroditic ricefield eel Monopterus albus [J]. Journal of Fish Biology, 2014, 85(5): 1381-1394. doi: 10.1111/jfb.12488
[17] 肖亚梅, 刘筠. 黄鳝由间性发育转变为雄性发育的细胞生物学研究 [J]. 水产学报, 1995, 19(4): 297-304.] Xiao Y M, Liu Y. Study on the histology in sex changing from intersex to male of Monopterus albus (Zuiew) [J]. Journal of Fisheries of China, 1995, 19(4): 297-304. [
[18] 肖亚梅, 陈丽莉, 陈松, 等. 黄鳝生殖干细胞在性逆转生殖发育过程中的变化 [J]. 分子细胞生物学报, 2007, 40(3): 196-204.] Xiao Y M, Chen L L, Chen S, et al. Transformation of the germ stem cells in the gonad development of sex reversal in Monopterus albus [J]. Journal of Molecular Cell Biology, 2007, 40(3): 196-204. [
[19] 刘修业, 崔同昌, 王良臣, 等. 黄鳝性逆转时生殖腺的组织学与超微结构的变化 [J]. 水生生物学报, 1990, 14(2): 166-169.] doi: 10.3321/j.issn:1000-3207.1990.02.007 Liu X Y, Cui T C, Wang L C, et al. Histological and ultrastructural changes in the gonad during sex reversal in Monopterus albus [J]. Acta Hydrobiologica Sinica, 1990, 14(2): 166-169. [ doi: 10.3321/j.issn:1000-3207.1990.02.007
[20] Sun X Y, Tao B B, Wang Y X, et al. Isolation and characterization of germline stem cells in protogynous hermaphroditic Monopterus albus [J]. International Journal of Molecular Sciences, 2022, 23(11): 5861. doi: 10.3390/ijms23115861
[21] Wang X, Lai F L, Shang D T, et al. Cellular fate of intersex differentiation [J]. Cell Death & Disease, 2021, 12(4): 388.
[22] Cheng H, Zhou R. Decoding genome recombination and sex reversal [J]. Trends in Endocrinology and Metabolism, 2022, 33(3): 175-185. doi: 10.1016/j.tem.2021.12.002
[23] Cheng H H, He Y, Zhou R J. Swamp eel (Monopterus albus) [J]. Trends in Genetics, 2021, 37(12): 1137-1138. doi: 10.1016/j.tig.2021.09.007
[24] Zhao X Y, Luo M J, Li Z G, et al. Chromosome-scale assembly of the Monopterus genome [J]. Gigascience, 2018, 7(5): giy046. doi: 10.1093/gigascience/giy046
[25] Tian H F, Hu Q M, Li Z, A high-quality de novo genome assembly of one swamp eel (Monopterus albus) strain with PacBio and Hi-C sequencing data [J]. G3-Genes Genomes Genetics, 2021, 11(1): jkaa032.
[26] Cheng Y, Shang D, Luo M, et al. Whole genome-wide chromosome fusion and new gene birth in the Monopterus albus genome [J]. Cell & Bioscience, 2020, 10(1): 67.
[27] Cai J, Yang W, Chen D, et al. Transcriptomic analysis of the differentiating ovary of the protogynous ricefield eel Monopterus albus [J]. BMC Genomics, 2017, 18(1): 573. doi: 10.1186/s12864-017-3953-6
[28] Hou M X, Feng K, Luo H R, et al. Complete depletion of primordial germ cells results in masculinization of Monopterus albus, a protogynous hermaphroditic rish [J]. Marine Biotechnology, 2022, 24(2): 320-334. doi: 10.1007/s10126-022-10106-2
[29] Hu Q, Guo W, Gao Y, et al. Molecular cloning and analysis of gonadal expression of Foxl2 in the rice-field eel Monopterus albus [J]. Scientific Reports, 2014(4): 6884.
[30] Hou M X, Feng K, Luo H R, et al. Multi-locus gene editing effectively knocked out cyp19a1a and foxl2 in Monopterus albus, a hermaphroditic fish [J]. Aquaculture, 2023(565): 739130.
[31] Gao Y, Jia D, Hu Q, et al. Foxl3, a target of miR-9, stimulates spermatogenesis in Spermatogonia during natural sex change in Monopterus albus [J]. Endocrinology, 2016, 157(11): 4388-4399. doi: 10.1210/en.2016-1256
[32] Jiang Y J, Luo H R, Hou M X, et al. Aromatase inhibitor induces sex reversal in the protogynous hermaphroditic rice field eel (Monopterus albus) [J]. Aquaculture, 2022(551): 737960.
[33] Zhang Y, Zhang W, Yang H, et al. Two cytochrome P450 aromatase genes in the hermaphrodite ricefield eel Monopterus albus: mRNA expression during ovarian development and sex change [J]. Journal of Endocrinology, 2008, 199(2): 317-331. doi: 10.1677/JOE-08-0303
[34] Liu J F, Guiguen Y, Liu S J. Aromatase (P450arom) and 11beta-hydroxylase (P45011beta) genes are differentially expressed during the sex change process of the protogynous rice field eel, Monopterus albus [J]. Fish Physiology and Biochemistry, 2009, 35(3): 511-518. doi: 10.1007/s10695-008-9255-9
[35] Zhou R, Cheng H, Zhang Q, et al. SRY-related genes in the genome of the rice field eel (Monopterus albus) [J]. Genetics Selection Evolution, 2002, 34(1): 129-137. doi: 10.1186/1297-9686-34-1-129
[36] Zhou R, Liu L, Guo Y, et al. Similar gene structure of two Sox9a genes and their expression patterns during gonadal differentiation in a teleost fish, rice field eel (Monopterus albus) [J]. Molecular Reproduction and Development, 2003, 66(3): 211-217. doi: 10.1002/mrd.10271
[37] Wang R, Cheng H, Xia L, et al. Molecular cloning and expression of Sox17 in gonads during sex reversal in the rice field eel, a teleost fish with a characteristic of natural sex transformation [J]. Biochemical and Biophysical Research Communications, 2003, 303(2): 452-457. doi: 10.1016/S0006-291X(03)00361-9
[38] Zhou F, Zhao W, Zuo Z, et al. Characterization of androgen receptor structure and nucleocytoplasmic shuttling of the rice field eel [J]. Journal of Biological Chemistry, 2010, 285(47): 37030-37040. doi: 10.1074/jbc.M110.161968
[39] Cheng Y, Lai F, Wang X, et al. Srag regulates autophagy via integrating into a preexisting autophagy pathway in testis [J]. Molecular Biology and Evolution, 2021, 38(1): 128-141. doi: 10.1093/molbev/msaa195
[40] Huang X, Guo Y, Shui Y, et al. Multiple alternative splicing and differential expression of dmrt1 during gonad transformation of the rice field eel [J]. Biology of Reproduction, 2005, 73(5): 1017-1024. doi: 10.1095/biolreprod.105.041871
[41] Sheng Y, Chen B, Zhang L, et al. Identification of Dmrt genes and their up-regulation during gonad transformation in the swamp eel (Monopterus albus) [J]. Molecular Biology Reports, 2014, 41(3): 1237-1245. doi: 10.1007/s11033-013-2968-6
[42] Hu Q, Guo W, Gao Y, et al. Molecular cloning and characterization of amh and dax1 genes and their expression during sex inversion in rice-field eel Monopterus albus [J]. Scientific Reports, 2015(5): 16667.
[43] Wang X, Lai F, Xiong J, et al. DNA methylation modification is associated with gonadal differentiation in Monopterus albus [J]. Cell and Bioscience, 2020, 10(1): 129. doi: 10.1186/s13578-020-00490-4
[44] Chen M, Ruan R, Zhong X Q, et al. Comprehensive analysis of genome-wide DNA methylation and transcriptomics between ovary and testis in Monopterus albus [J]. Aquaculture Research, 2021, 52(11): 5829-5839. doi: 10.1111/are.15457
[45] Zhang Y, Sun X, Zhang L, et al. Testicular Dnmt3 expression and global DNA methylation are down-regulated by gonadotropin releasing hormones in the ricefield eel Monopterus albus [J]. Scientific Reports, 2017(7): 43158.
[46] Zhang Y, Zhang S, Liu Z, et al. Epigenetic modifications during sex change repress gonadotropin stimulation of cyp19a1a in a teleost ricefield eel (Monopterus albus) [J]. Endocrinology, 2013, 154(8): 2881-2890. doi: 10.1210/en.2012-2220
[47] Lai F, Cheng Y, Zou J, et al. Identification of histone modifications reveals a role of H2b monoubiquitination in transcriptional regulation of dmrt1 in Monopterus albus [J]. International Journal of Biological Sciences, 2021, 17(8): 2009-2020. doi: 10.7150/ijbs.59347
[48] Li Y, Chen Z, Liu H, et al. ASER: animal sex reversal database [J]. Genomics Proteomics Bioinformatics, 2021, 19(6): 873-881. doi: 10.1016/j.gpb.2021.10.001
[49] Feng K, Luo H, Hou M, et al. Alternative splicing of GnRH2 and GnRH2-associated peptide plays roles in gonadal differentiation of the rice field eel, Monopterus albus [J]. General and Comparative Endocrinology, 2018(267): 9-17.
[50] Tao Y X, Lin H R, Vanderkraak G, et al. Hormonal induction of precocious sex reversal in the ricefield eel, Monopterus albus [J]. Aquaculture, 1993, 118(1-2): 131-140. doi: 10.1016/0044-8486(93)90286-8
[51] Shi Q. Melatonin is involved in sex change of the ricefield eel, zuiew [J]. Reviews in Fish Biology and Fisheries, 2005, 15(1-2): 23-36. doi: 10.1007/s11160-005-7848-2
[52] Tang F, Chan S T, Lofts B. Effect of mammalian luteinizing hormone on the natural sex reversal of the rice-field eel, Monopterus albus (Zuiew) [J]. General and Comparative Endocrinology, 1974, 24(3): 242-248. doi: 10.1016/0016-6480(74)90178-6
[53] Chan S T, Phillips J G. The biosynthesis of steroids by the gonads of the ricefield eel Monopterus albus at various phases during natural sex reversal [J]. General and Comparative Endocrinology, 1969, 12(3): 619-636. doi: 10.1016/0016-6480(69)90183-X
[54] Yeung W S, Chan S T. The plasma sex steroid profiles in the freshwater, sex-reversing teleost fish, Monopterus albus (Zuiew) [J]. General and Comparative Endocrinology, 1987, 65(2): 233-242. doi: 10.1016/0016-6480(87)90171-7
[55] Chu Z J, Wu Y X, Gong S Y, et al. Effects of estradiol valerate on steroid hormones and sex reversal of female rice field eel, Monopterus albus (Zuiew) [J]. Journal of the World Aquaculture Society, 2011, 42(1): 96-104. doi: 10.1111/j.1749-7345.2010.00448.x
[56] 赵云芳, 柯熏陶. 外源激素诱导黄鳝性转化的效果 [J]. 西南农业学报, 1992, 5(1): 74-78.] Zhao Y F, Ke X T. Effect of induction on sex reversal of Monopterus albus using herterogenous hormone [J]. Southwest China Journal of Agricultural Sciences, 1992, 5(1): 74-78. [
[57] Tang F, Chan S T, Lofts B. Effect of steroid hormones on the process of natural sex reversal in the rice-field eel, Monopterus albus (Zuiew) [J]. General and Comparative Endocrinology, 1974, 24(3): 227-241. doi: 10.1016/0016-6480(74)90177-4
[58] Feng K, Luo H, Li Y, et al. High efficient gene targeting in rice field eel Monopterus albus by transcription activator-like effector nucleases [J]. Science Bulletin, 2017, 62(3): 162-164. doi: 10.1016/j.scib.2017.01.018
[59] Luo D, Feng K, Zhu Z, et al. Generating gene knockout oryzias latipes and rice field eel using TALENs method [J]. Methods in Molecular Biology, 2019(1874): 489-506.
[60] 刘海金, 侯吉伦, 刘奕. 牙鲆雌核发育研究进展 [J]. 中国水产科学, 2017, 24(4): 902-912.] Liu H J, Hou J L, Liu Y. Gynogenesis in Japanese flounder: A review [J]. Journal of Fishery Sciences of China, 2017, 24(4): 902-912. [
[61] Arai K. Genetic improvement of aquaculture finfish species by chromosome manipulation techniques in Japan [J]. Aquaculture, 2001, 197(1-4): 205-228. doi: 10.1016/S0044-8486(01)00588-9
[62] Luo H R, Feng K, Chen J, et al. Telophase of the first cleavage is the key stage for optimally inducing mitotic gynogenesis in rice field eel (Monopterus albus) [J]. Aquaculture, 2020(523): 735241.
[63] 徐闻, 宋焱龙, 蒋银军, 等. 黄鳝减数分裂雌核发育及子代遗传纯合度分析[J]. 水生生物学报, 2023, 48(5): 820-828.] Xu W, Song Y L, Jiang Y J, et al. Induction of meiogynogenesis in Monopterus albus and genetic homozygosity analysis of the gynogenic offspring [J]. Acta Hydrobiologica Sinica, 2024, 48(5): 820-828. [
[64] 常重杰, 杜启艳, 卢龙斗, 等. 热休克诱导三倍体黄鳝的研究 [J]. 河南师范大学学报(自然科学版), 1997, 25(2): 60-63.] Chang Z J, Du Q Y, Lu L D, et al. Studies on the induction of triploidy ricefield fish (Monopterus albus) [J]. Journal of Henan Normal University (Natural Science), 1997, 25(2): 60-63. [
[65] Jiang Y J, Xu W, Luo H R, et al. Hydrostatic pressure shock induced tetraploids in rice field eel (Monopterus albus) [J]. Aquaculture, 2024(584): 740636.
[66] Tao B, Liao X, Chen L, et al. Germ cells are not essential for sexual dimorphism of gonads in common carp, C. carpio L. [J]. Aquaculture, 2022(547): 737501.
[67] 陶彬彬, 张西娅, 宋焱龙, 等. 一种黄鳝生殖细胞异种移植及移植后嵌合性腺的检查方法 P]. ZL202210411188.3, 发明专利, 中华人民共和国, 2023年9月15日.
[68] Shi M J, Luo H R, Zhang W T, et al. A genome-wide linkage map and QTL mapping for growth traits of Asian rice-field eel (Monopterus albus) [J]. Aquaculture, 2021(536): 736394.
[69] Xu W, Luo H R, Jiang Y J, et al. Identification of body coloration related genes in ricefield eel (Monopterus albus) using GWAS [J]. Aquaculture, 2025(595): 741489.



 下载:
下载: