TWO ANTIBIOTICS ON THE LIVER AND INTESTINAL TISSUE STRUCTURE, ANTIOXIDANT ACTIVITY, AND INTESTINAL MICROBIOTA OF YELLOW DRUM (NIBEA ALBIFLORA)
-
摘要:
为探究青霉素和氟苯尼考对黄姑鱼(Nibea albiflora)肝脏和肠道组织学结构、抗氧化能力及肠道菌群的影响, 实验以黄姑鱼为研究对象, 设置不同浓度的青霉素组(25、50和75 mg/kg)和氟苯尼考组(25、50和100 mg/kg), 以基础饲料为对照, 投喂期间, 分别于5d后和10d后进行样品采集, 检测肝脏和肠道组织学结构、抗氧化酶活性、相关免疫基因表达、肌肉中抗生素残余及肠道菌群组成变化。结果表明: (1)低浓度和中浓度的青霉素或氟苯尼考对黄姑鱼肠道和肝脏组织学结构没有明显影响, 而高浓度组的肝脏和肠道组织均出现明显损伤; (2)无论处理5d或10d, 与对照组相比, 高浓度组肝脏中SOD、CAT和GSH-PX的活性均显著降低, 而MDA含量显著升高; 在肠道中, 高浓度组的SOD活性均显著降低, 而GSH-PX活性和MDA含量均显著升高; (3)肝脏和肌肉中均检测到2种抗生素残余, 且高浓度的青霉素(54.48 μg/kg)或氟苯尼考(1039.47 μg/kg)处理10d后肌肉中抗生素残余均超出了最大残留限量; (4)无论处理5d或10d, 高浓度的青霉素或氟苯尼考均显著抑制肠道中Arp2/3、ZO-1、Claudin4基因的表达水平, 而促炎基因IL-6、TNF-α的表达水平显著上升, 抑炎基因IL-10、TGF-β的表达水平显著下降; (5)青霉素或氟苯尼考对黄姑鱼肠道菌群的α-多样性无显著影响; 变形菌门(Proteobacteria)的相对丰度均显著增加, 而厚壁菌门(Firmicutes)的相对丰度均显著降低。综上, 饲料中添加低浓度的青霉素或氟苯尼考对黄姑鱼肝脏和肠道形态结构、抗氧化酶活性及肠道相关结构基因、免疫基因和肠道菌群结构均无显著影响; 而高浓度会引起肝脏和肠道组织损伤、氧化应激反应、黏膜免疫应答及影响肠道菌群多样性和组成。
Abstract:This study investigated the effects of penicillin and florfenicol on the histological structure, antioxidant activity, and intestinal microbiota of yellow drum. Different concentration groups were set for penicillin (25, 50, and 75 mg/kg) and florfenicol (25, 50, and 100 mg/kg), with a basic feed group as the control. Samples were collected on the 5th and 10th days to assess changes in intestinal and liver histology, antioxidant enzyme activity, immune gene expression, antibiotic residues in muscle, and alterations in intestinal microbiota composition. The results showed that: (1) Low and medium concentrations of penicillin or florfenicol did not significantly affect the intestinal and liver histology, but high concentrations caused clear damage to both tissues. (2) High concentrations of both antibiotics, regardless of treatment duration, significantly reduced liver SOD, CAT, and GSH-PX activities, while increasing MDA content. In the intestine, SOD activity decreased, while GSH-PX activity and MDA content increased. (3) Antibiotic residues were detected in both liver and muscle tissues. After 10 days of high-concentration treatment, the residual levels of penicillin (54.48 μg/kg) and florfenicol (1039.47 μg/kg) in muscle tissue exceeded the maximum residue limits. (4) High concentrations of penicillin or florfenicol significantly inhibited the expression of Arp2/3, ZO-1, and Claudin4 in the intestine, while pro-inflammatory IL-6 and TNF-α increased, and anti-inflammatory IL-10 and TGF-β decreased. 5) Neither penicillin nor florfenicol significantly affected the alpha diversity of intestinal microbiota, but Proteobacteria increased significantly, while Firmicutes decreased. In conclusion, low concentrations of penicillin or florfenicol had no significant effects on liver and intestinal structure, antioxidant enzyme activity, or expression of intestinal structural and immune genes, or microbiota composition. However, high concentrations caused liver and intestinal damage, oxidative stress, mucosal immune responses, and altered microbiota diversity and composition.
-
Keywords:
- Florfenicol /
- Penicillin /
- Antioxidant activity /
- Intestinal microbiota /
- Nibea albiflora
-
绿色兴农已成为未来的发展方向, 2024年1月10号, 农业农村部印发《关于落实中共中央国务院关于学习运用“千村示范、万村整治”工程经验有力有效推进乡村全面振兴工作部署的实施意见》, 明确提出大力发展水产绿色健康养殖技术, 推进现代渔业发展。当前, 我国水产养殖主要以高密度、集约化的养殖方式为主, 然而水产养殖快速发展的同时, 养殖鱼类疾病暴发的频率也有所增加[1, 2], 其中, 细菌性疾病已成为致使养殖鱼类死亡的主要原因之一, 给鱼类养殖业带来了巨大的经济损失。抗生素类药物是治疗细菌性疾病的有效手段[3], 其中氟苯尼考和青霉素是常用的鱼类细菌性疾病的治疗药物。鱼类养殖中抗生素的使用无疑推动了该产业的快速发展, 但也引起了其耐药性威胁公共健康和养殖业可持续发展的担忧[4]。近年的研究发现抗生素的使用过程中会引起鱼类机体的应激反应, 如抗氧化应激, 机体内活性氧物质的产生和消除失衡, 细胞内过量的氧自由基会引起氧化应激[5], 严重时会导致鱼体出现氧化损伤、细胞凋亡、脂质过氧化等[6]。近年来, 随着抗生素与养殖动物研究的深入, 抗生素对宿主肠道菌群的影响也成为众多学者关注的焦点之一。已有的研究表明, 抗生素药物的使用影响宿主肠道菌群的多样性[7]和组成[8], 严重时可导致肠道菌群失衡。肠道菌群失衡会影响鱼类肠道动态平衡, 降低其对食物的消化和吸收能力, 严重时会导致腹泻甚至死亡等[9]。因此, 如何控制和减少抗生素在水产养殖中的使用, 是当前水产养殖业亟待解决的问题。
黄姑鱼(Nibea albiflora), 隶属石首鱼科、黄姑鱼属, 是我国重要的海水经济鱼类。作为近海网箱和池塘养殖的适宜品种, 其养殖规模在中国沿海迅速扩大[10]。黄姑鱼养殖业的迅速发展的同时, 其病害问题也不断出现, 其中由病原菌引起的疾病频繁暴发, 导致黄姑鱼大规模死亡, 给养殖户造成了巨大的经济损失[11]。因此, 开展黄姑鱼细菌性疾病防控研究对其养殖产业的健康发展极其重要。本研究以黄姑鱼为研究对象, 通过投喂实验研究氟苯尼考和青霉素对黄姑鱼组织学结构、肠道免疫和菌群的影响。研究结果可为黄姑鱼的健康养殖提供参考, 也可为抗生素在海水鱼类疾病防治中的合理应用提供科学指导。
1. 材料与方法
1.1 实验对象与饲料制备
黄姑鱼在浙江省海洋水产研究所下属的西轩渔业科技岛培育。选取同批次健康、规格相近的黄姑鱼幼鱼630尾(18.15±2.15) g, 先于水泥池(4 m×6 m×1.5 m; 水深1.2 m)中暂养7d, 每天9:00和15:00各饱食投喂1次, 每天投喂前吸出残饵和粪便, 并于早上投喂前换水50%。设置抗生素处理组和对照组, 饲料的制备参照王苓等[12]的报道, 并加以修改, 具体方法: 先将不同浓度的抗生素均匀的喷洒在基础饲料的表面, 然后包裹一层海藻酸钠(3.15 g/500 g饲料)和棕榈油(4.2 mL/500 g饲料); 对照组的基础饲料直接包裹一层海藻酸钠(3.15 g/500 g饲料)和棕榈油(4.2 mL/500 g饲料); 然后将制备好的饲料置于阴凉处阴干, 储存于4℃冰箱中以备后续使用。养殖实验中使用的饲料成分和配方详见表 1, 其中鱼粉(蒸气鱼粉, 秘鲁)、酪蛋白(赛默飞世尔科技, 美国)为主要蛋白源; 鱼油(荣成爱尔斯海洋生物, 中国)、豆油(中粮集团, 中国)、大豆卵磷脂(嘉吉公司, 德国)为主要脂肪源。实验饲料在混合前经粉碎处理, 过60目筛(孔径250 μm), 随后转移至搅拌机中进一步混匀, 在搅拌过程中, 缓慢加入油性原料混合物, 并添加适量水分(25%-30%); 然后使用F-26型双螺杆挤条机(华南理工大学科技实业总厂, 广州)将原料团挤出, 切成4.0 mm的颗粒, 置于90℃恒温烘箱中干燥, 之后于−20℃冰箱中保存备用。
表 1 饲料成分和配方Table 1. Feed ingredients and formulation原料Ingredients 组成
Composition (%)鱼粉Fish meal 50.34 酪蛋白Casein 15.50 面粉Wheat flour 7.00 鱼油Fish oil 3.87 豆油Soybean oil 1.00 大豆卵磷脂Soybean lecithin 0.92 海水鱼用预混料Premix for marine fish * 1.85 氯化胆碱Choline chloride 0.28 磷酸二氢钙Monocalcium phosphate 0.46 L-赖氨酸L-Lysine 1.50 羧甲基纤维素钠Sodium carboxymethyl cellulose 1.93 纤维素Cellulose 15.35 合计Total 100.00 营养水平(干物质基础)
Nutrient level (dry matter basis)粗蛋白Crude protein 46.45 粗脂肪Crude lipid 11.37 注: *海水鱼用预混料包括维生素预混物和无机盐预混物。维生素预混物(mg/kg)包括: VB1, 25; VB2, 36.7; VA, 32; VE, 120; VD, 35; VK3, 5.1; VC, 142; VB6, 20; VB12, 0.1; VH, 1.2; VB5, 60; VB9, 20; VB3, 200; 无机盐预混物(mg/kg)包括: 硫酸镁, 1826; 硫酸亚铁, 119; 硫酸锌, 76; 硫酸锰, 44; 氯化钴, 2; 碘化钾, 0.8; 硫酸铜, 1; 氯化钠, 100; 磷酸二氢钾, 233.2; 磷酸二氢钠, 137Note: * The premix for marine fish includes vitamin premix and mineral premix. Vitamin premix (mg/kg): VB1, 25; VB2, 36.7; VA, 32; VE, 120; VD, 35; VK3, 5.1; VC, 142; VB6, 20; VB12, 0.1; VH, 1.2; VB5, 60; VB9, 20; VB3, 200. Mineral premix (mg/kg): magnesium sulfate, 1826; ferrous sulfate, 119; zinc sulfate, 76; manganese sulfate, 44; cobalt chloride, 2; potassium iodide, 0.8; copper sulfate, 1; sodium chloride, 100; monopotassium phosphate, 233.2; monosodium phosphate, 137 1.2 实验分组和养殖实验
在暂养结束后, 将630尾鱼随机分布到21个400 L养殖桶(圆形桶, 直径0.97 m, 高度0.73 m, 水深0.60 m)中, 每桶30尾。氟苯尼考(浓度≥99%)和青霉素(浓度≥99%)购自北京索莱宝科技有限公司。依据已有参考文献[13—15]和商业产品使用说明书, 饲料中添加氟苯尼考的浓度分别为25、50和100 mg/kg; 添加青霉素的浓度为25、50和75 mg/kg; 对照组投喂基础饲料; 共计7个组, 每个组3个重复。依据氟苯尼考和青霉素在实际生产中的使用周期, 设置抗生素投喂5d后和10d后的两个取样点。CON-5和CON-10分别代表对照组5d后和10d后的取样命名; FL-5、FM-5和FH-5分别代表投喂25、50和100 mg/kg浓度的氟苯尼考5d后的取样命名; FL-10、FM-10和FH-10分别代表投喂25、50和100 mg/kg浓度的氟苯尼考10d后的取样命名; AL-5、AM-5和AH-5分别代表投喂25、50和75 mg/kg浓度的青霉素5d后的取样命名; AL-10、AM-10和AH-10分别代表投喂25、50和75 mg/kg浓度的青霉素10d后的取样命名。实验期间, 每天投喂前换水量为1/3, 每天9:00和15:00各饱食投喂1次, 投喂前吸出残饵和粪便。实验期间光照条件为自然光照, 水温为26—28℃, 盐度为27—29‰, 溶解氧>6.0mg/L。
1.3 样品采集
在采样点取样时, 分别从每个实验桶中随机选取12尾鱼进行样品采集。在取样前, 先使用MS-222进行麻醉处理, 然后无菌手术刀和剪刀对实验鱼进行解剖, 将肝脏和中肠取出, 其中, 部分肝脏用于抗氧化酶活性测定; 部分肝脏先于Bouin’s固定, 然后用于组织学结构观察; 部分肝脏先于液氮中冷冻, 然后用于抗生素残余的测定。中肠样品一部分用Bouin’s固定, 然后用于组织学结构观察; 一部分用RNA保护液保存, 用于相关结构和炎症基因表达的检测; 中肠内容物采集: 先将中肠转移至无菌培养皿中, 然后用无菌剪刀解剖, 再用无菌生理盐水冲洗中肠, 将全部内容物收集于2 mL无菌管中; 采集其中3尾鱼的中肠肠道内容物进行混合后作为1个样品, 先于液氮中冷冻, 然后保存于–80℃冰箱, 用于肠道菌群分析;
每个实验桶中随机采集9尾鱼的背部肌肉样品, 每3尾鱼混合在一起作为一个样品, 先于液氮中冷冻, 然后保存于–80℃冰箱, 用于抗生素残余的测定。
1.4 样品测定方法
肝脏和肠道组织学结构分析 肝脏样品和肠道样品在Bouin’s溶液中固定24h后, 先使用分级乙醇溶液进行脱水, 然后进行石蜡包埋及切片(厚度5 µm)。采用苏木精-伊红(HE)染色法进行染色, 使用中性树脂封片。利用光学显微镜对HE染色后的切片进行观察和拍照。
肝脏和肠道抗氧化酶活性测定 测定肝脏和肠道中超氧化歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)活性及丙二醛(MDA)含量, 所采用的试剂盒均购自南京建成生物工程研究所, 依据操作说明进行酶活性测定。
肝脏及肌肉中抗生素残余测定 取黄姑鱼肝脏样本及背部肌肉样本进行抗生素残余测定, 每组3个重复。称取2.5 g肝脏样本或2.5 g肌肉样品用氨化乙酸乙酯提取, 经涡旋振荡/超声、离心后取上清液, 再通过固相萃取柱净化, 氮吹至干后复溶、离心、过滤, 然后转入气相色谱仪或液相色谱-串联质谱仪进行抗生素残余测定。色谱条件、流动相洗脱梯度表及质谱条件见于GB31656.16-2022标准及GB31656.12-2021标准。经计算后得出样品中氟苯尼考和青霉素的残留量, 单位为微克每千克(μg/kg)。
肠道总RNA提取及荧光定量PCR 利用RNA提取试剂盒(Solarbio, 中国)进行中肠总RNA提取, 然后用NanoDrop2000 (Thermo Fisher Scientific, 美国)测定总RNA的浓度和质量。利用Prime Script® RT reagent Kit with gDNA Eraser (TaKaRa, 日本)试剂盒逆转录合成cDNA, 并储存于-20℃冰箱中备用。检测Arp2/3、Claudin4和ZO-1等基因在肠道组织中的表达; 检测肠道免疫相关基因NF-κB、TLR4、MyD88、IL-6、TNF-α、IL-10、TGF-β和β-actin的mRNA表达; 相关基因的荧光定量引物见表 2。利用Trans Start Tip Green qPCR Super Mix(TransGen Biotech, 中国)进行qPCR检测, 反应体系为20 μL; qPCR反应程序如下: 95℃、30s, 45个循环95℃、5s, 60℃、30s, 熔解曲线95℃、5s, 60℃、1min, 95℃、10s, 降温60℃、30s。β-actin作为内参基因, 通过2−ΔΔCt方法计算基因的相对表达量。
表 2 目标基因的qPCR引物序列Table 2. qPCR primer sequence of target genes目的基因
Target gene序列5'—3'
Rsquences来源
SourceArp2/3 TACCCGGTGCTGTTTGTGTA Ma et al[16] TGCACTGGTTTCTTCCTCCT Claudin4 GCCAACATTGTCACAGCTCA 曾延清[17] AGCCACTACACCAACGATGA ZO-1 TCACTCACCATGTTCCTCCC Ma et al[16] CAGAAACACAGTTGGCTCCC TLR4 ACTCCGTGGTTCTGGTCTTCCTG Xu et al[18] GCTTCTGACGAAAGGCCGGTATC MyD88 GGCAGTTGGAACAGACGGAGTA Xu et al[18] TGAAAGTCGCAGGCATCG NF-κB CAGCAGCTGTTTCAGATCGC Xu et al[18] CCAGGTGCAAAGGAGTGTCT IL-10 CACTTTGTGGGCTACATCCA Ma et al[16] GTTGAGGTATGCTGTGGTAGTC IL-6 TGAAGGCTCCGACGAAATG Ma et al[16] GTCCAGTAGGCTAAACTGCTATC TNF-α TGAAGAAGATGGTGCCCTTAC Ma et al[16] GCCTGGAATCGAGCTCTAAAT TGF-β CGTCGCAGAACGCATCTATAA Ma et al[16] CACGGCTATGATGTCCTGTATT β-actin CCAACTCATTGGCATGGCTT 曾延清[17] GATGCAACTGCAGAACCCTG 肠道菌群高通量测序及数据分析 将采集的肠道内容物样品用干冰保存送至上海欧易生物医学科技有限公司进行16S rDNA高通量测序。采用Mag Pure Soil DNA LQ Kit (Magen, 中国)试剂盒进行样品总DNA的提取, 利用NanoDrop2000和琼脂糖凝胶电泳检测总DNA的浓度和质量。基于Illumina NovaSeq 6000测序平台, 利用Barcode特异引物343F (5′-TACGGRAGGCAGCAG-3′)和798R (5′-AGGGTATCTAATCCT-3′)扩增16S rDNA基因的V3-V4区。
获得的原始数据先用Cutadapt软件去除数据中的引物序列, 然后利用DADA2软件进行质量过滤、拼接和去除嵌合体。基于Silva (v.138)数据库, 利用q2-feature-classifier软件进行序列比对和注释, 获得ASVs丰度表格。利用QIIME2软件进行α和β多样性分析; 基于Bray-Curtis距离, 利用R软件进行多元方差分析(Permutational Multivariate Analysis of Variance, PERMANOVA)和相似性分析(Analysis of Similarity, ANOSIM); 基于Weighted Unifrac距离, 利用QIIME2软件进行非度量多维尺度分析(Non-metric multidimensional scaling, NMDS)。
1.5 数据统计分析
所有实验数据均用平均值±标准误表示。采用SPSS25.0软件对抗氧化酶活性数据和相关基因表达数据进行单因素方差分析(One-way ANOVA), 随后使用Duncan分析进行多重比较, 设置P<0.05为显著差异。肠道菌群数据采用Kruskal Wallis检验进行比较分析, 所有数值均用平均值±标准误表示, 显著水平设为0.05。
2. 结果
2.1 青霉素和氟苯尼考对黄姑鱼肠道和肝脏组织结构的影响
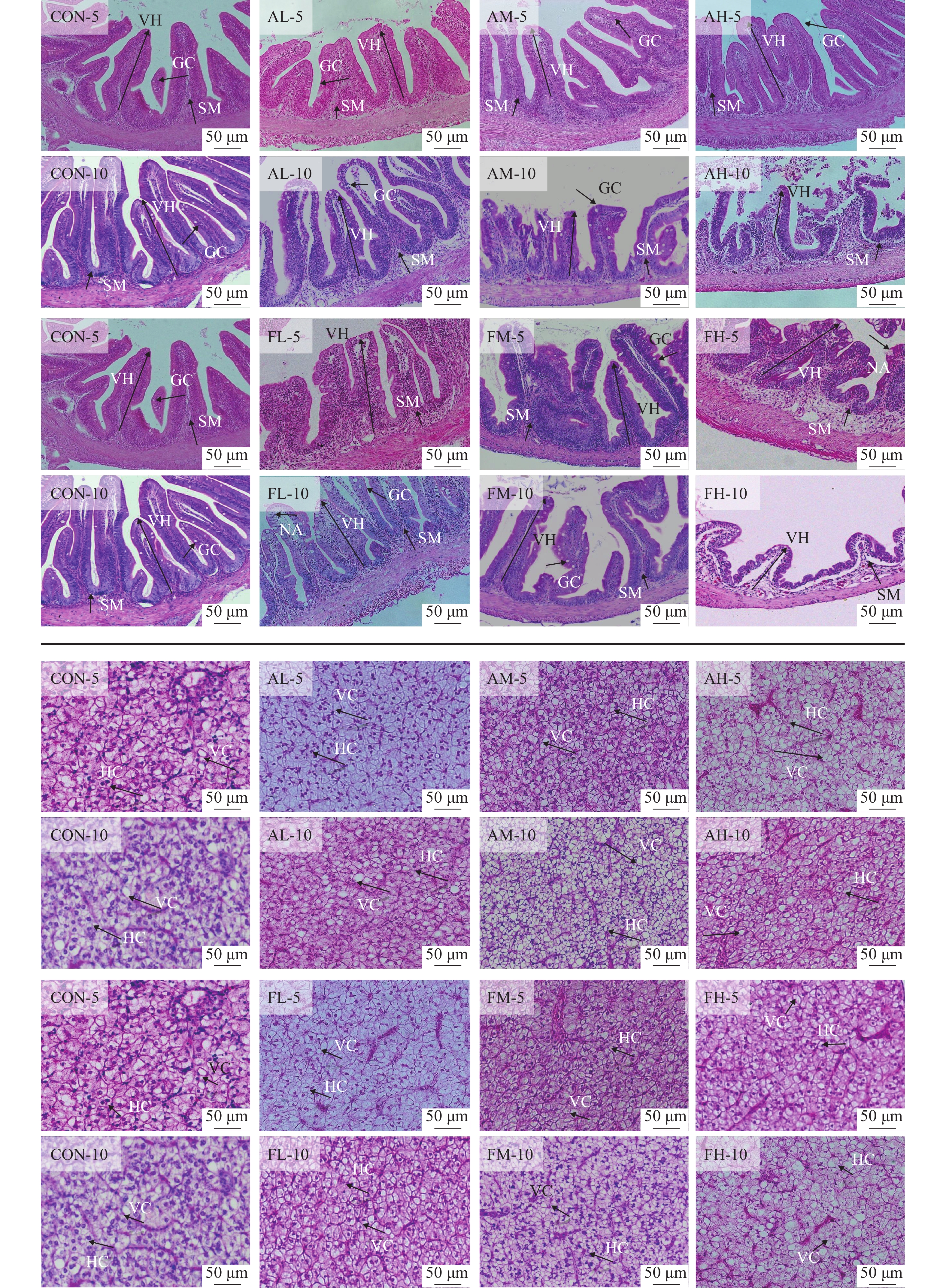
如图 1A所示, 对照组黄姑鱼的肠道黏膜结构完整, 绒毛形态规整, 排列有序, 且富含杯状细胞。低、中、高浓度的青霉素处理5d后, 黄姑鱼的肠道组织学结构未发现病理变化; 而处理10d后, 低浓度组肠道柱状上皮细胞与黏膜下层明显分离; 中浓度组肠道柱状上皮细胞出现损伤; 高浓度组肠道柱状上皮细胞和黏膜下层均出现严重损伤。低浓度和中浓度的氟苯尼考处理5d后, 黄姑鱼的肠道组织学结构未发现病理变化; 而高浓度组肠道柱状上皮出现坏死区; 处理10d后, 低浓度组肠道柱状上皮细胞出现坏死区; 中浓度组肠道绒毛数量明显减少; 高浓度组肠道绒毛数量和高度均明显降低, 而且柱状上皮细胞和黏膜下层明显分离。
![]() 图 1 饲料中添加不同浓度的青霉素和氟苯尼考对黄姑鱼肠道(A)和肝脏(B)组织学结构的影响SM. 黏膜下层; VH 绒毛高度; GC. 杯状细胞; NA. 坏死区; HC. 肝细胞; VC. 空泡Figure 1. The effects of dietary penicillin and florfenicol at different concentrations on the histological structure of intestinal (A) and liver (B) in yellow drumSM. submucosa; VH. villus height; GC. goblet cells; NA. necrotic area; HC. hepatocyte; VC. vacuolation
图 1 饲料中添加不同浓度的青霉素和氟苯尼考对黄姑鱼肠道(A)和肝脏(B)组织学结构的影响SM. 黏膜下层; VH 绒毛高度; GC. 杯状细胞; NA. 坏死区; HC. 肝细胞; VC. 空泡Figure 1. The effects of dietary penicillin and florfenicol at different concentrations on the histological structure of intestinal (A) and liver (B) in yellow drumSM. submucosa; VH. villus height; GC. goblet cells; NA. necrotic area; HC. hepatocyte; VC. vacuolation如图 1B所示, 对照组黄姑鱼的肝细胞排列紧密有序, 细胞核形状规则, 细胞界限清晰。与对照组相比, 低浓度和中浓度的青霉素处理5d后, 黄姑鱼肝脏部分区域出现空泡, 但没有明显损伤; 高浓度组肝脏出现细胞空泡化及肝血窦淤血现象; 而处理10d后, 低、中、高浓度的青霉素组肝脏均出现细胞空泡化及肝血窦淤血现象。低浓度和中浓度的氟苯尼考处理5d后, 黄姑鱼肝脏出现肝血窦轻度充血; 高浓度组肝脏出现细胞核偏离和细胞间隙增大的现象; 而处理10d后, 低浓度组和中浓度组肝脏结构出空泡化; 高浓度组肝细胞肿胀、空泡化, 且肝板结构模糊。
2.2 青霉素和氟苯尼考对黄姑鱼肝脏和肠道抗氧化酶活性的影响
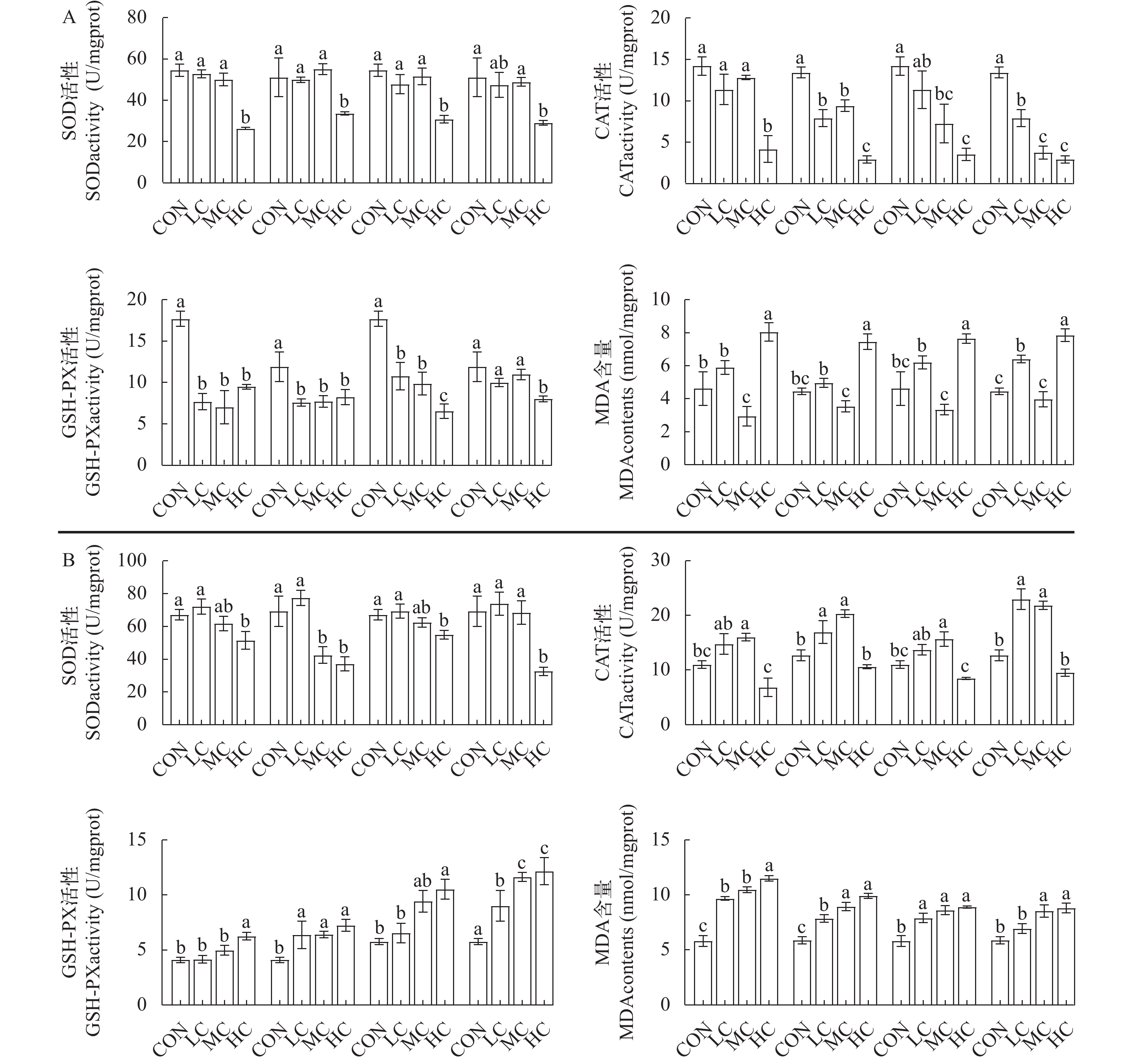
不同浓度的青霉素和氟苯尼考对黄姑鱼肝脏抗氧化酶活性的影响如图 2A所示。青霉素处理5d后, 低浓度组和中浓度组中黄姑鱼肝脏中SOD活性和CAT活性与对照组相比差异均不显著(P>0.05), 而高浓度组肝脏中SOD活性、CAT活性均显著低于对照组(P<0.05); 青霉素处理10d后, 低浓度组和中浓度组肝脏中SOD活性与对照组相比差异不显著(P>0.05), 而高浓度组肝脏中SOD活性和CAT活性均显著低于对照组(P<0.05)。无论青霉素处理5d还是10d, 低浓度组、中浓度组和高浓度组肝脏中GSH-PX活性均显著低于对照组(P<0.05); 而高浓度组肝脏中MDA含量显著高于对照组(P<0.05)。无论氟苯尼考处理5d还是10d, 高浓度组肝脏中SOD活性、CAT活性和GSH-PX活性均显著低于对照组(P<0.05), 而MDA含量显著高于对照组(P<0.05)。综上, 无论高浓度的青霉素和氟苯尼考处理5d还是10d均可显著抑制黄姑鱼肝脏中SOD活性、CAT活性和GSH-PX活性, 均显著增加MDA含量; 而低浓度和中浓度的青霉素和氟苯尼考对黄姑鱼肝脏中SOD活性没有显著影响, 但对CAT活性和GSH-PX活性的影响随处理时间的增加而加大。
![]() 图 2 饲料中添加不同浓度的青霉素和氟苯尼考对黄姑鱼肝脏(A)和肠道(B)抗氧化能力的影响同一时间点不同字母表示各组间差异显著(P<0.05); 下同Figure 2. Effects of penicillin and florfenicol at different concentrations on the antioxidant capacity of liver (A) and intestine (B) in yellow drumDifferent letters at the same time point indicate statistically significant differences in groups (P<0.05); the same applies below
图 2 饲料中添加不同浓度的青霉素和氟苯尼考对黄姑鱼肝脏(A)和肠道(B)抗氧化能力的影响同一时间点不同字母表示各组间差异显著(P<0.05); 下同Figure 2. Effects of penicillin and florfenicol at different concentrations on the antioxidant capacity of liver (A) and intestine (B) in yellow drumDifferent letters at the same time point indicate statistically significant differences in groups (P<0.05); the same applies below不同浓度的青霉素和氟苯尼考对黄姑鱼肠道抗氧化酶活性的影响如图 2B所示。青霉素处理5d后, 高浓度组肠道中SOD活性显著低于对照组(P<0.05), 而GSH-PX活性和MDA含量显著高于对照组(P<0.05); 处理10d后, 中浓度组和高浓度组肠道中SOD活性均显著低于对照组(P<0.05); 而高浓度肠道中CAT活性与对照组相比差异不显著(P>0.05); 低浓度组和中浓度组肠道中CAT活性显著高于对照组(P<0.05); 低浓度组、中浓度组和高浓度组肠道中GSH-PX活性和MDA含量均显著高于对照组(P<0.05)。氟苯尼考处理5d后, 高浓度组肠道中SOD活性显著低于对照组(P<0.05), 而GSH-PX活性和MDA含量显著高于对照组(P<0.05); 处理10d后, 低浓度组和中浓度组肠道中CAT活性显著高于对照组(P<0.05); 高浓度组肠道中SOD活性显著低于对照组(P<0.05), 而GSH-PX活性和MDA含量显著高于对照组(P<0.05)。综上, 无论高浓度的青霉素或氟苯尼考处理5d还是10d均显著抑制肠道中SOD和CAT活性, 显著增加MDA含量。
2.3 青霉素和氟苯尼考在黄姑鱼肝脏和肌肉中的残余分析
青霉素和氟苯尼考在黄姑鱼肝脏和肌肉中的残留结果见表 3。结果表明, 无论低、中、高浓度的青霉素或氟苯尼考处理5d还是10d在黄姑鱼肝脏和肌肉中均检测到残余, 其中高浓度的青霉素或氟苯尼考处理10d后, 黄姑鱼肌肉中残余超过了最大残余限量[高浓度青霉素组(AH-10组): 54.48 μg/kg; 高浓度氟苯尼考组(FH-10组): 1039.47 μg/kg]。黄姑鱼肝脏和肌肉中抗生素的残余量与抗生素使用浓度和时间呈正相关, 即随着抗生素浓度和时间的增加, 肝脏和肌肉中残留量随之增加。
表 3 青霉素和氟苯尼考在黄姑鱼肝脏和肌肉内残留结果Table 3. Residual results of penicillin and florfenicol in yellow drum liver and muscle组别
Group肝脏Liver
(μg/kg)肌肉Muscle
(μg/kg)组别
Group肝脏Liver
(μg/kg)肌肉Muscle
(μg/kg)CON-5 0 0 CON-10 0 0 AL-5 10.75 15.46 AL-10 12.79 22.75 AM-5 16.83 27.82 AM-10 29.53 37.13 AH-5 28.49 31.93 AH-10 44.62 54.48 FL-5 103.78 127.67 FL-10 415.35 467.08 FM-5 232.63 264.87 FM-10 562.69 727.64 FH-5 323.62 369.29 FH-10 726.57 1039.47 2.4 青霉素和氟苯尼考对黄姑鱼肠道结构基因表达的影响
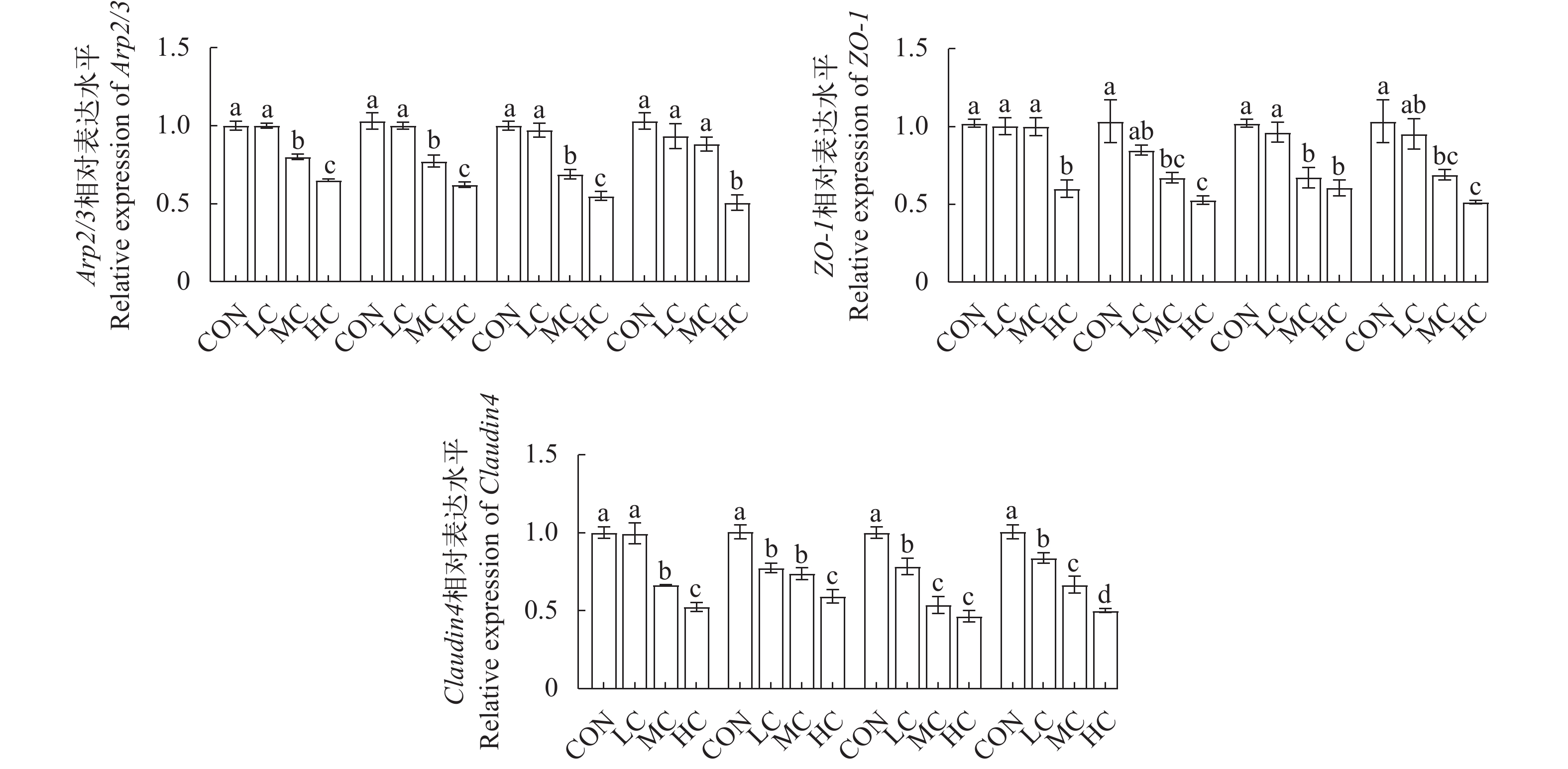
如图 3所示, 青霉素和氟苯尼考处理5d后, 中浓度组和高浓度组黄姑鱼肠道中Arp2/3和Claudin4基因的相对表达量均显著低于对照组(P<0.05), 而低浓度组肠道中Arp2/3和ZO-1基因的相对表达量与对照组相比差异不显著(P>0.05)。青霉素和氟苯尼考处理10d后, 中浓度组和高浓度组肠道中ZO-1和Claudin4基因的相对表达量显著低于对照组(P<0.05), 而低浓度组肠道中Arp2/3和ZO-1基因的相对表达量与对照组相比差异不显著(P>0.05)。综上, 无论中浓度和高浓度的青霉素和氟苯尼考处理5d还是10d均显著抑制黄姑鱼肠道相关结构基因的表达。
2.5 青霉素和氟苯尼考对黄姑鱼肠道相关免疫基因及炎症基因表达的影响
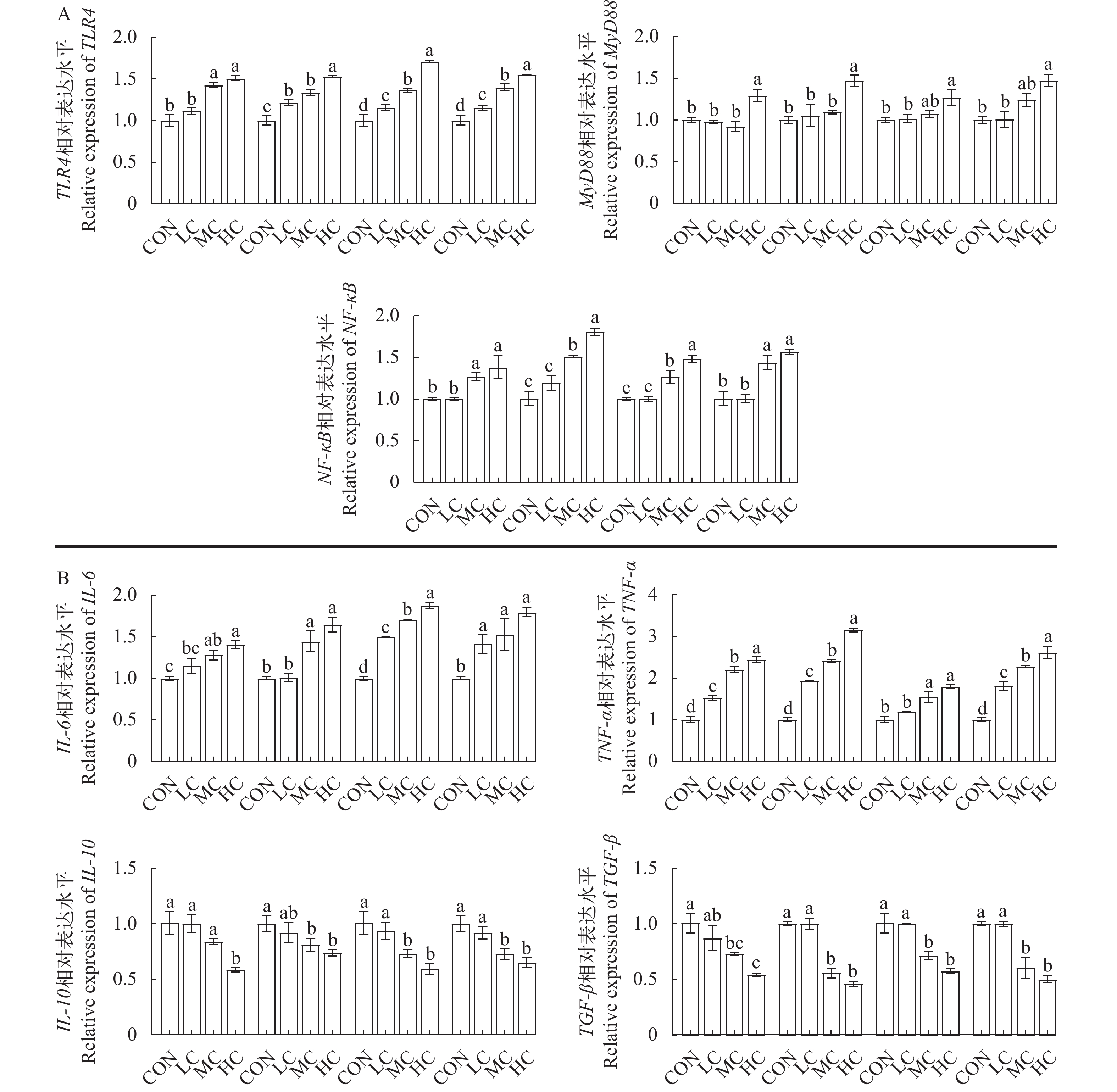
如图 4A所示, 青霉素和氟苯尼考处理5d后, 中浓度组和高浓度组黄姑鱼肠道中TLR4基因、NF-κB基因的相对表达量显著增加(P<0.05), 而高浓度组肠道中MyD88基因的相对表达量显著增加(P<0.05)。青霉素和氟苯尼考处理10d后, 低浓度组、中浓度组和高浓度组肠道中TLR4基因相对表达量均显著高于对照组(P>0.05); 高浓度组肠道中MyD88基因的相对表达量显著高于对照组(P<0.05); 中浓度组和高浓度组肠道中NF-κB基因的相对表达量显著高于对照组(P<0.05)。综上, 无论青霉素和氟苯尼考处理5d还是10d, 中浓度组和高浓度组肠道中TLR4基因和NF-κB基因均显著上调, 而高浓度组肠道中MyD88基因显著上调。
如图 4B所示, 青霉素和氟苯尼考处理5d后, 中浓度组和高浓度组黄姑鱼肠道中IL-6基因和TNF-α基因的相对表达量均显著高于对照组(P<0.05), 而TGF-β基因的相对表达量均显著低于对照组(P<0.05)。青霉素处理10d后, 中浓度组和高浓度组肠道中IL-6和TNF-α基因的相对表达量均显著高于对照组(P<0.05), 而IL-10和TGF-β基因的相对表达量均显著低于对照组(P<0.05)。氟苯尼考处理10d后, 低浓度组、中浓度组和高浓度组肠道中IL-6和TNF-α基因的相对表达量均显著高于对照组(P<0.05), 而中浓度组和高浓度组肠道中IL-10基因和TGF-β基因的相对表达量均显著低于对照组(P<0.05)。综上, 无论青霉素和氟苯尼考处理5d还是10d, 中浓度组和高浓度组肠道中IL-6和TNF-α基因的表达量均显著增加, 而IL-10和TGF-β基因的表达量显著降低。
2.6 青霉素和氟苯尼考对黄姑鱼肠道菌群的影响
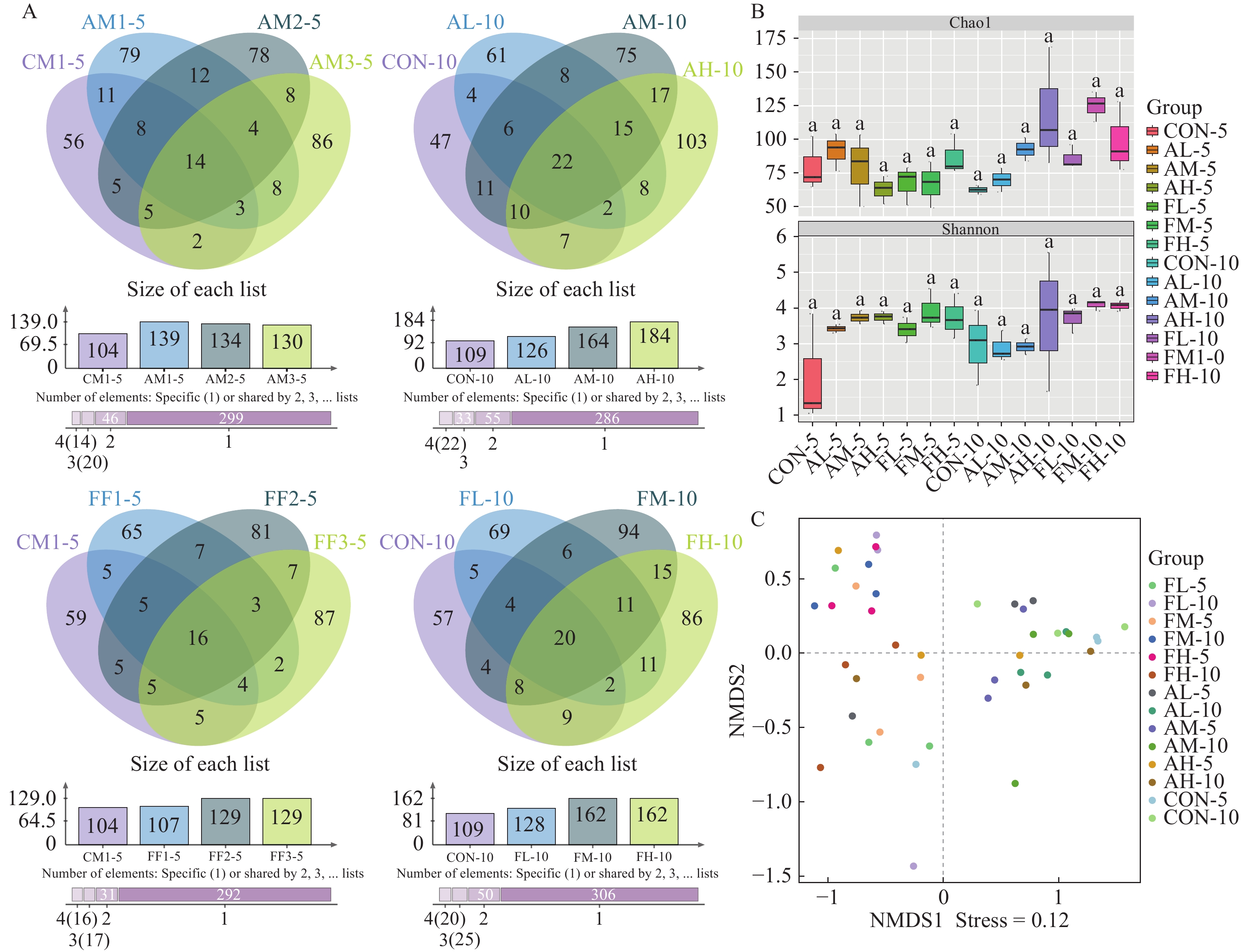
青霉素和氟苯尼考对黄姑鱼肠道菌群多样性的影响 测序结果显示, 42个样本共计得到有效序列2924032条(平均值: 69619, 最小值: 51393, 最大值: 76341); 非参数统计学结果显示, 所有组间肠道菌群中有效序列和ASVs数量均没有显著差异(P>0.05)。如图 5A所示, 青霉素处理5d后, 低浓度组、中浓度组和高浓度组黄姑鱼肠道菌群中共有ASVs数量为14个(主要隶属于厚壁菌门和变形菌门), 占各组肠道菌群中有效序列的比例分别为34.95%、20.50%、22.25%和14.57%; 而处理10d后, 肠道菌群中共有ASVs数量为22个(主要隶属于厚壁菌门和变形菌门), 占各组肠道菌群中有效序列的比例分别为33.47%、35.67%、28.75%和23.16%。氟苯尼考处理5d后, 低浓度组、中浓度组和高浓度组肠道菌群中共有ASVs数量为16个(主要隶属于变形菌门), 占各组肠道菌群中有效序列的比例分别为7.04%、11.64%、17.12%和13.96%; 而处理10d后, 肠道菌群中共有ASVs数量为20个(主要隶属于厚壁菌门和变形菌门), 占各组肠道菌群中有效序列的比例分别为30.32%、10.97%、14.17%和4.27%。
![]() 图 5 青霉素和氟苯尼考对黄姑鱼肠道菌群多样性的影响A. 韦恩图展示各组间特有ASVs和共有ASVs; B. 不同浓度的青霉素和氟苯尼考处理后黄姑鱼肠道菌群α-多样性分析; C. 各组细菌群落的非度量多维尺度分析Figure 5. Effects of penicillin and florfenicol on the diversity of intestinal microbiota of yellow drumA. Venn plots display the unique and shared amplicon sequence variants (ASVs) in groups; B. Analysis of gut microbiota α-diversity in yellow drum following treatment with different concentrations of penicillin and florfenicol; C. Non-metric multidimensional scaling analysis (NMDS) of bacterial communities in each group
图 5 青霉素和氟苯尼考对黄姑鱼肠道菌群多样性的影响A. 韦恩图展示各组间特有ASVs和共有ASVs; B. 不同浓度的青霉素和氟苯尼考处理后黄姑鱼肠道菌群α-多样性分析; C. 各组细菌群落的非度量多维尺度分析Figure 5. Effects of penicillin and florfenicol on the diversity of intestinal microbiota of yellow drumA. Venn plots display the unique and shared amplicon sequence variants (ASVs) in groups; B. Analysis of gut microbiota α-diversity in yellow drum following treatment with different concentrations of penicillin and florfenicol; C. Non-metric multidimensional scaling analysis (NMDS) of bacterial communities in each group由图 5B可知, 无论青霉素和氟苯尼考处理5d还是10d, 低浓度组、中浓度组和高浓度组的黄姑鱼肠道菌群中Chao1指数、Shannon指数与对照组相比差异均不显著(P>0.05)。进一步的双因素分析(表 4)结果显示, 青霉素或氟苯尼考对黄姑鱼肠道菌群的Chao1指数和Shannon指数无显著影响。氟苯尼考处理5d后的Chao1指数与处理10d后的Chao1指数相比差异显著。由图 5C可知, 各组样本细菌群落分布没有明显的聚类规律。进一步的ANOSIM分析(表 5)揭示, 无论青霉素或氟苯尼考处理5d或10d, 黄姑鱼肠道菌群结构均未发生显著变化(P>0.05)。由此, 饲料中添加低浓度、中浓度和高浓度的青霉素或氟苯尼考对黄姑鱼肠道细菌群落的结构均没有显著影响。
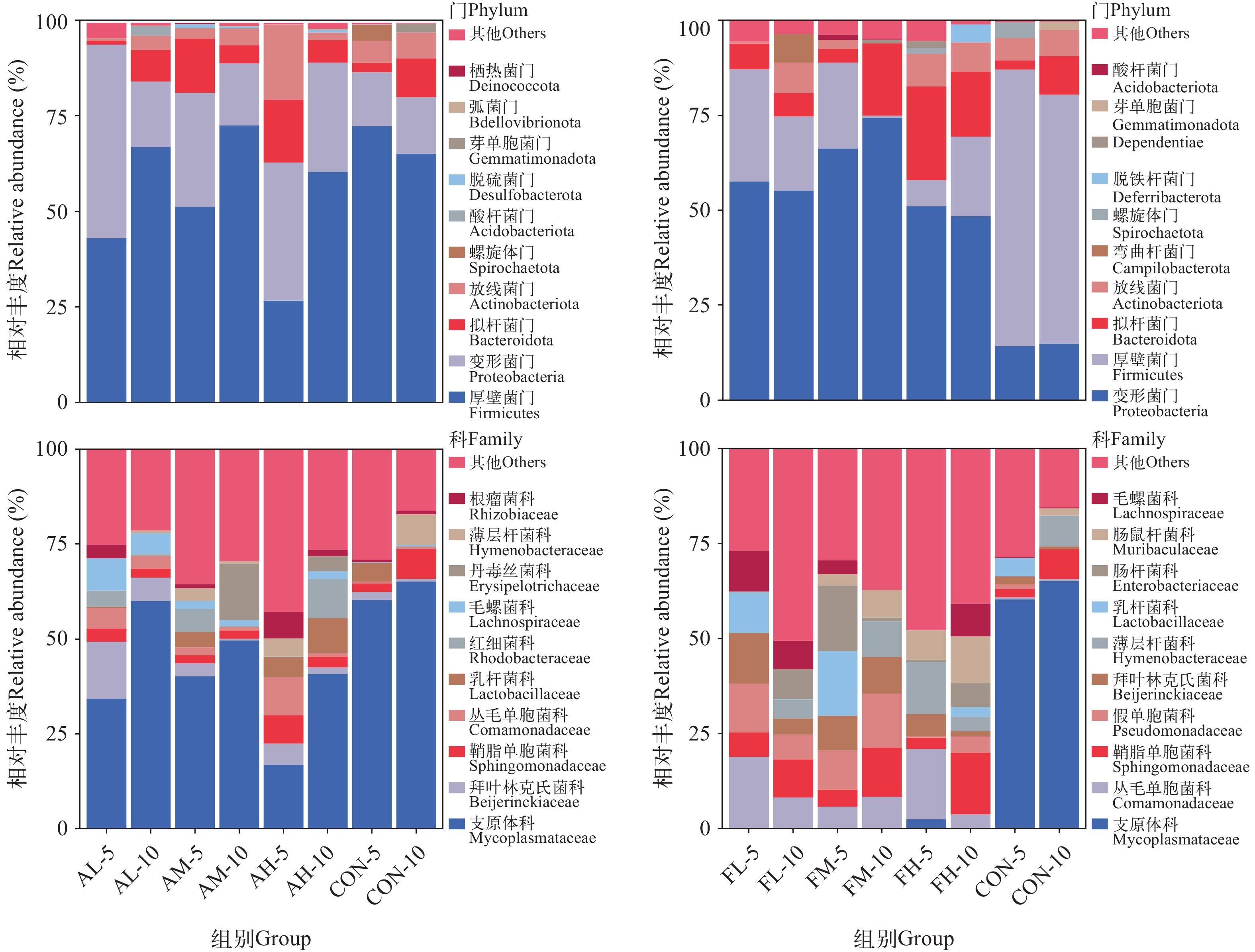
表 4 基于双因素方差分析比较不同浓度和天数的α-多样性指数Table 4. Comparison of α-diversity indexes in concentrations and days based on two-way ANOVA testTwo-way ANOVA test 青霉素 氟苯尼考 Chao1 Shannon Chao1 Shannon F P F P F P F P 浓度 (低, 中, 高) 0.313 0.737 0.692 0.520 2.403 0.132 1.963 0.183 天数 (5, 10) 2.275 0.157 0.792 0.391 14.577 0.002* 1.908 0.192 浓度×天数 4.375 0.037 0.177 0.840 3.467 0.065 0.065 0.937 注: *代表差异显著Note: *indicate statistically significant differences 表 5 各组间黄姑鱼肠道细菌群落的差异分析Table 5. Analysis of differences in intestinal bacterial communities of yellow drum between groups成对样品Paired-sample ANOSIM 成对样品Paired-sample ANOSIM R P R P AL-5 vs CON-5 0.88 0.20 AL-10 vs CON-10 0.81 0.10 AM-5 vs CON-5 0.62 0.10 AM-10 vs CON-10 0.44 0.10 AH-5 vs CON-5 0.18 0.10 AH-10 vs CON-10 0.29 0.30 FL-5 vs CON-5 1.00 0.10 FL-10 vs CON-10 1.00 0.10 FM-5 vs CON-5 1.00 0.10 FM-10 vs CON-10 1.00 0.10 FH-5 vs CON-5 1.00 0.10 FH-10 vs CON-10 0.59 0.10 青霉素和氟苯尼考对黄姑鱼肠道菌群组成的影响 不同浓度青霉素和氟苯尼考对黄姑鱼肠道菌群组成的影响如图 6所示。在门水平上, 青霉素和氟苯尼考处理5d后, 黄姑鱼肠道菌群中优势菌门为变形菌门和厚壁菌门; 而处理10d后, 肠道菌群中优势菌门为变形菌门、厚壁菌门和拟杆菌门。进一步的统计学分析揭示, 青霉素和氟苯尼考处理5d后, 低浓度组、中浓度组和高浓度组变形菌门的相对丰度均显著高于对照组(P<0.05), 而厚壁菌门的相对丰度均显著低于对照组(P<0.05)。青霉素处理5d后, 中浓度组和高浓度组拟杆菌门的相对丰度显著增加(P<0.05); 而高浓度组放线菌门的相对丰度显著高于其他组(P<0.05)。氟苯尼考处理10d后, 低浓度组、中浓度组和高浓度组变形菌门的相对丰度均显著高于对照组(P<0.05), 而厚壁菌门的相对丰度显著低于对照组(P<0.05)。综上, 低、中、高浓度的青霉素或氟苯尼考均可显著影响黄姑鱼肠道菌群中门水平优势组成的相对丰度。
在科水平上(图 6), 无论青霉素处理5d或10d, 黄姑鱼肠道菌群中优势菌科与对照组相同均为支原体科。氟苯尼考处理5d后, 低浓度组肠道菌群中优势菌科为丛毛单胞菌科、拜叶林克氏菌科、乳杆菌科、毛螺菌科和假单胞菌科; 中浓度组为乳杆菌科和假单胞菌科; 高浓度组为丛毛单胞菌科和薄层杆菌科; 氟苯尼考处理10d后, 低浓度组为丛毛单胞菌科和鞘脂单胞菌科; 中浓度组为鞘脂单胞菌科和假单胞菌科; 高浓度组为鞘脂单胞菌科。进一步的统计学分析揭示, 无论青霉素处理5d或10d, 低浓度组、中浓度组和高浓度组肠道菌群中支原体科的相对丰度与对照组相比均无显著差异(P>0.05)。而无论氟苯尼考处理5d或10d, 低浓度组、中浓度组和高浓度组肠道菌群中支原体科的相对丰度均显著低于对照组(P<0.05)。氟苯尼考处理5d后, 中浓度组乳杆菌科和假单胞菌科的相对丰度均显著高于对照组(P<0.05); 低浓度组毛螺菌科和假单胞菌科的相对丰度均显著高于对照组(P<0.05); 而处理10d后, 低浓度组和中浓度组假单胞菌科相对丰度显著高于对照组(P<0.05); 高浓度组乳杆菌科和毛螺菌科的相对丰度均显著高于对照组(P<0.05)。综上, 黄姑鱼肠道菌群中科水平物种的相对丰度更易受到氟苯尼考的影响。
3. 讨论
3.1 不同浓度的青霉素或氟苯尼考对黄姑鱼肝脏和肠道组织学结构的影响
肠道是鱼类消化吸收营养物质的场所, 肠道健康对鱼类生长至关重要。肠道组织结构的破坏不但会影响鱼类对饲料营养的吸收和利用, 而且增加病原微生物的入侵风险[19]。肝脏是鱼类进行生命活动和代谢的主要器官, 不但具有防御功能, 而且可有效降低外来污染物对机体的毒性作用[20]。抗生素作为鱼类细菌性疾病防治的主要药物, 添加浓度使用不当会对其肠道形态学结构造成损伤。如, Bardhan等[13]研究发现, 饲料中添加30 mg/kg的氟苯尼考可导致罗非鱼肠道上皮细胞变性坏死, 肠细胞间隙和固有层肿胀。Sun等[21]研究发现, 饲料中添加2 mg/g鱼体重的氟苯尼考及其他三种抗生素的混合悬浮液可导致草鱼肝细胞肿胀、空泡化以及核萎缩等现象。在本研究中, 高浓度的青霉素和氟苯尼考均可造成黄姑鱼肝脏和肠道组织结构损伤。由此, 鱼类细菌性疾病防治中, 抗生素添加浓度的选择对鱼类机体健康至关重要。
3.2 不同浓度的青霉素或氟苯尼考对黄姑鱼抗氧化能力的影响
研究表明, 不同抗生素类药物对鱼类产生的抗氧化应激反应有所不同。如许氏平鲉(Sebastes schlegelii)投喂含20 mg/L氟苯尼考的饲料后, 其SOD的活性显著增加[22]; 草鱼投喂含10 mg/kg氟苯尼考的饲料后, 其后肠道中GPx和CAT活性均显著下降[23]; 在本研究中, 饲料中添加高浓度的青霉素或氟苯尼考, 可导致黄姑鱼肝脏中SOD、CAT及GSH-PX活性均显著下降, 而MDA含量显著升高; 肠道中SOD活性显著下降, 而GSH-PX活性和MDA含量显著升高; 在肝脏和肠道中GSH-PX的活性趋势相反, 这可能与组织的特异性抗氧化电位差异有关[24]。此外, 青霉素和氟苯尼考对黄姑鱼肝脏和肠道中抗氧化酶活性的影响表现出剂量-时间-效应。由此, 在黄姑鱼养殖实践中细菌性疾病的治疗不但要考虑使用剂量, 同时也要注意治疗疗程。
3.3 不同浓度的青霉素或氟苯尼考对黄姑鱼肠道结构及炎症相关基因的影响
紧密连接蛋白(Tight junctions, TJ)主要包括Occludin、Claudins、ZOs和Arp2/3等[25], 其在肠道结构稳态中发挥重要的作用; ZO-1是紧密连接蛋白复合物的一种亚单位, 在调节细胞内信号传导路径中扮演关键角色[26]; Claudin4作为紧密连接蛋白家族中的代表, 其表达水平的下调已被证实对肠道屏障功能产生显著影响[27]; Arp2/3复合物是细胞骨架中肌动蛋白的一种, 其在细胞运动性和维持紧密连接的稳定性中发挥重要作用[28]。先前的研究证实, 饲料中添加不同浓度的盐酸多西环素或恩诺沙星, 可导致大黄鱼肠道紧密连接蛋白Claudin7、Occludin和ZO-1基因的表达量显著下降[29]。在本研究中, 中浓度和高浓度的青霉素或氟苯尼考均显著抑制了黄姑鱼肠道中Claudin4基因、ZO-1基因和Arp2/3基因的mRNA表达; 由此表明, 饲料中添加中浓度和高浓度的青霉素或氟苯尼考可能会引起黄姑鱼肠道屏障结构的损伤。
TLR/NF-κB信号通路是鱼类免疫防御中的主要通路之一, 其信号经TLR受体(如TLR4等)传导至细胞核内, 激活核内的NF-κB转录因子, 进而通过一系列的联级反应等最终产生相关的抗菌肽等抑菌物质[30]。当抗生素等外源性化学物侵入生物体时, 它们能够直接作用于单核细胞、中性粒细胞、巨噬细胞及自然杀伤细胞, 诱导这些免疫细胞分泌TNF-α、IL-6及IL-1β等促炎细胞因子, 致使机体产生炎症反应, 从而有效降低抗生素等物质可能引起的机体损伤[31]。在本研究中, 中浓度和高浓度的青霉素或氟苯尼考可诱导黄姑鱼肠道中TLR4、MyD88、NF-κB、IL-6、TNF-α基因的显著表达, IL-10和TGF-β基因的显著下调。这与斑马鱼[16, 32, 33]、草鱼[21] 和大黄鱼[34] 的研究结果相类似 。
3.4 不同浓度的青霉素或氟苯尼考在黄姑鱼体内残留结果检测
抗生素类药物的使用会导致水产动物体内药物残留, 残余量不但对鱼类经济价值有直接影响, 更关乎食品安全, 进而影响人类健康与安全。另外, 抗生素残留会引起细菌耐药性的增加, 导致治疗难度加大, 严重影响了公共卫生安全[35]。然而, 关于抗生素残余检测主要集中于养殖水环境中残余分析[36], 而对于鱼体中抗生素残余量的检测研究较少。本研究中, 肝脏和肌肉中2种抗生素残余测定显示出浓度-时间-残余留量的正相关系, 并且高浓度的青霉素或氟苯尼考导致了黄姑鱼肌肉中残余留量超出了国标《动物性食品中兽药最大残留限量》中最大残留限量(青霉素: 50 μg/kg; 氟苯尼考: 1000 μg/kg)[37, 38]; 因此, 系统检测抗生素使用浓度与其鱼体中残余的对应分析, 对抗生素在海水鱼类养殖生产中的使用具有指导意义。
3.5 不同浓度的青霉素或氟苯尼考对黄姑鱼肠道菌群组成的影响
肠道菌群的种类和数量可反映其与宿主间的互作关系[39], 其被称作宿主体内的“内分泌器官”, 与宿主的生长、发育及免疫密切相关[40]。研究表明, 抗生素类药物可引起鱼类肠道菌群组成或结构改变, 但其对不同鱼类的影响有所差异[24]。如, 饲喂10 mg/kg的氟苯尼考后, 草鱼肠道菌群中α-多样性无显著变化, 而β-多样性显著改变[23]。本研究中, 无论青霉素或氟苯尼考处理5d还是10d均显著改变肠道菌群的优势组成, 尤其是氟苯尼考; 氟苯尼考可显著影响黄姑鱼肠道菌群中假单胞菌科物种相对丰度。假单胞菌是一种革兰氏阴性杆菌, 近年来, 其致病性被不断发现, 如恶臭假单胞菌(Pseudomonas putida)可引起黑鲷(Acanthopagrus schlegelii)爆发肠炎病[41]; 铜绿假单胞菌(P. aeruginosa)可引起大菱鲆(Scophthalmus maximus)幼鱼患腹水症[42]; 变形假单胞菌(P. plecoglossicida)是大黄鱼内脏白点病的主要病原菌[43]。因此, 氟苯尼考在海水鱼类细菌性疾病防治中也要关注假单胞菌科细菌病的爆发。
4. 结论
本研究综合组织学分析、氧化应激指标分析、免疫反应以及肠道菌群分析, 解析了青霉素和氟苯尼考应用对黄姑鱼肝脏和肠道的影响; 结果表明, 高浓度的青霉素或氟苯尼考可导致黄姑鱼肝脏和肠道的组织损伤, 引起氧化应激反应和炎症反应, 显著影响其肠道菌群组成; 同时发现, 不同抗生素对黄姑鱼的影响存在一定差异。此研究结果可为青霉素或氟苯尼考在海水鱼类细菌性疾病的防治提供科学参考。
-
图 1 饲料中添加不同浓度的青霉素和氟苯尼考对黄姑鱼肠道(A)和肝脏(B)组织学结构的影响
SM. 黏膜下层; VH 绒毛高度; GC. 杯状细胞; NA. 坏死区; HC. 肝细胞; VC. 空泡
Figure 1. The effects of dietary penicillin and florfenicol at different concentrations on the histological structure of intestinal (A) and liver (B) in yellow drum
SM. submucosa; VH. villus height; GC. goblet cells; NA. necrotic area; HC. hepatocyte; VC. vacuolation
图 2 饲料中添加不同浓度的青霉素和氟苯尼考对黄姑鱼肝脏(A)和肠道(B)抗氧化能力的影响
同一时间点不同字母表示各组间差异显著(P<0.05); 下同
Figure 2. Effects of penicillin and florfenicol at different concentrations on the antioxidant capacity of liver (A) and intestine (B) in yellow drum
Different letters at the same time point indicate statistically significant differences in groups (P<0.05); the same applies below
图 5 青霉素和氟苯尼考对黄姑鱼肠道菌群多样性的影响
A. 韦恩图展示各组间特有ASVs和共有ASVs; B. 不同浓度的青霉素和氟苯尼考处理后黄姑鱼肠道菌群α-多样性分析; C. 各组细菌群落的非度量多维尺度分析
Figure 5. Effects of penicillin and florfenicol on the diversity of intestinal microbiota of yellow drum
A. Venn plots display the unique and shared amplicon sequence variants (ASVs) in groups; B. Analysis of gut microbiota α-diversity in yellow drum following treatment with different concentrations of penicillin and florfenicol; C. Non-metric multidimensional scaling analysis (NMDS) of bacterial communities in each group
表 1 饲料成分和配方
Table 1 Feed ingredients and formulation
原料Ingredients 组成
Composition (%)鱼粉Fish meal 50.34 酪蛋白Casein 15.50 面粉Wheat flour 7.00 鱼油Fish oil 3.87 豆油Soybean oil 1.00 大豆卵磷脂Soybean lecithin 0.92 海水鱼用预混料Premix for marine fish * 1.85 氯化胆碱Choline chloride 0.28 磷酸二氢钙Monocalcium phosphate 0.46 L-赖氨酸L-Lysine 1.50 羧甲基纤维素钠Sodium carboxymethyl cellulose 1.93 纤维素Cellulose 15.35 合计Total 100.00 营养水平(干物质基础)
Nutrient level (dry matter basis)粗蛋白Crude protein 46.45 粗脂肪Crude lipid 11.37 注: *海水鱼用预混料包括维生素预混物和无机盐预混物。维生素预混物(mg/kg)包括: VB1, 25; VB2, 36.7; VA, 32; VE, 120; VD, 35; VK3, 5.1; VC, 142; VB6, 20; VB12, 0.1; VH, 1.2; VB5, 60; VB9, 20; VB3, 200; 无机盐预混物(mg/kg)包括: 硫酸镁, 1826; 硫酸亚铁, 119; 硫酸锌, 76; 硫酸锰, 44; 氯化钴, 2; 碘化钾, 0.8; 硫酸铜, 1; 氯化钠, 100; 磷酸二氢钾, 233.2; 磷酸二氢钠, 137Note: * The premix for marine fish includes vitamin premix and mineral premix. Vitamin premix (mg/kg): VB1, 25; VB2, 36.7; VA, 32; VE, 120; VD, 35; VK3, 5.1; VC, 142; VB6, 20; VB12, 0.1; VH, 1.2; VB5, 60; VB9, 20; VB3, 200. Mineral premix (mg/kg): magnesium sulfate, 1826; ferrous sulfate, 119; zinc sulfate, 76; manganese sulfate, 44; cobalt chloride, 2; potassium iodide, 0.8; copper sulfate, 1; sodium chloride, 100; monopotassium phosphate, 233.2; monosodium phosphate, 137 表 2 目标基因的qPCR引物序列
Table 2 qPCR primer sequence of target genes
目的基因
Target gene序列5'—3'
Rsquences来源
SourceArp2/3 TACCCGGTGCTGTTTGTGTA Ma et al[16] TGCACTGGTTTCTTCCTCCT Claudin4 GCCAACATTGTCACAGCTCA 曾延清[17] AGCCACTACACCAACGATGA ZO-1 TCACTCACCATGTTCCTCCC Ma et al[16] CAGAAACACAGTTGGCTCCC TLR4 ACTCCGTGGTTCTGGTCTTCCTG Xu et al[18] GCTTCTGACGAAAGGCCGGTATC MyD88 GGCAGTTGGAACAGACGGAGTA Xu et al[18] TGAAAGTCGCAGGCATCG NF-κB CAGCAGCTGTTTCAGATCGC Xu et al[18] CCAGGTGCAAAGGAGTGTCT IL-10 CACTTTGTGGGCTACATCCA Ma et al[16] GTTGAGGTATGCTGTGGTAGTC IL-6 TGAAGGCTCCGACGAAATG Ma et al[16] GTCCAGTAGGCTAAACTGCTATC TNF-α TGAAGAAGATGGTGCCCTTAC Ma et al[16] GCCTGGAATCGAGCTCTAAAT TGF-β CGTCGCAGAACGCATCTATAA Ma et al[16] CACGGCTATGATGTCCTGTATT β-actin CCAACTCATTGGCATGGCTT 曾延清[17] GATGCAACTGCAGAACCCTG 表 3 青霉素和氟苯尼考在黄姑鱼肝脏和肌肉内残留结果
Table 3 Residual results of penicillin and florfenicol in yellow drum liver and muscle
组别
Group肝脏Liver
(μg/kg)肌肉Muscle
(μg/kg)组别
Group肝脏Liver
(μg/kg)肌肉Muscle
(μg/kg)CON-5 0 0 CON-10 0 0 AL-5 10.75 15.46 AL-10 12.79 22.75 AM-5 16.83 27.82 AM-10 29.53 37.13 AH-5 28.49 31.93 AH-10 44.62 54.48 FL-5 103.78 127.67 FL-10 415.35 467.08 FM-5 232.63 264.87 FM-10 562.69 727.64 FH-5 323.62 369.29 FH-10 726.57 1039.47 表 4 基于双因素方差分析比较不同浓度和天数的α-多样性指数
Table 4 Comparison of α-diversity indexes in concentrations and days based on two-way ANOVA test
Two-way ANOVA test 青霉素 氟苯尼考 Chao1 Shannon Chao1 Shannon F P F P F P F P 浓度 (低, 中, 高) 0.313 0.737 0.692 0.520 2.403 0.132 1.963 0.183 天数 (5, 10) 2.275 0.157 0.792 0.391 14.577 0.002* 1.908 0.192 浓度×天数 4.375 0.037 0.177 0.840 3.467 0.065 0.065 0.937 注: *代表差异显著Note: *indicate statistically significant differences 表 5 各组间黄姑鱼肠道细菌群落的差异分析
Table 5 Analysis of differences in intestinal bacterial communities of yellow drum between groups
成对样品Paired-sample ANOSIM 成对样品Paired-sample ANOSIM R P R P AL-5 vs CON-5 0.88 0.20 AL-10 vs CON-10 0.81 0.10 AM-5 vs CON-5 0.62 0.10 AM-10 vs CON-10 0.44 0.10 AH-5 vs CON-5 0.18 0.10 AH-10 vs CON-10 0.29 0.30 FL-5 vs CON-5 1.00 0.10 FL-10 vs CON-10 1.00 0.10 FM-5 vs CON-5 1.00 0.10 FM-10 vs CON-10 1.00 0.10 FH-5 vs CON-5 1.00 0.10 FH-10 vs CON-10 0.59 0.10 -
[1] Wang A, Ran C, Wang Y, et al. Use of probiotics in aquaculture of China—a review of the past decade [J]. Fish & Shellfish Immunology, 2019(86): 734-755.
[2] 张美玲, 董温昕, 杜震宇. 益生菌对幼鱼生长发育的影响及调控机制 [J]. 水产学报, 2024, 48(1): 19-27.] Zhang M L, Dong W X, Du Z Y. Effects of probiotics on the growth and development of juvenile fish [J]. Journal of Fisheries of China, 2024, 48(1): 19-27. [
[3] Gentry R R, Rassweiler A, Ruff E O, et al. Global pathways of innovation and spread of marine aquaculture species [J]. One Earth, 2023, 6(1): 20-30. doi: 10.1016/j.oneear.2022.12.007
[4] 贾亚楠, 唐忠. 中国和欧美国家养殖业抗生素使用负面问题及管理政策比较 [J]. 农业环境科学学报, 2024, 43(6): 1205-1219.] Jia Y N, Tang Z. Negative issues of antibiotic use in livestock and management policies comparison between China, the United States, and the European Union [J]. Journal of Agro-Environment Science, 2024, 43(6): 1205-1219. [
[5] 袁圣武, 黄超, 季晓亚, 等. 环境污染物导致氧化应激的关键信号通路及其检测方法 [J]. 生态毒理学报, 2017, 12(1): 25-37.] Yuan S W, Huang C, Ji X Y, et al. Main signaling pathways and detection methods of oxidative stress caused by environmental pollutants [J]. Asian Journal of Ecotoxicology, 2017, 12(1): 25-37. [
[6] Yang C, Song G, Lim W. A review of the toxicity in fish exposed to antibiotics [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2020(237): 108840.
[7] Kim A, Kim N, Roh H J, et al. Administration of antibiotics can cause dysbiosis in fish gut [J]. Aquaculture, 2019(512): 734330.
[8] Sumithra T G, Sharma K S R, Gangadharan S, et al. Dysbiosis and restoration dynamics of the gut microbiome following therapeutic exposure to florfenicol in snubnose pompano (Trachinotus blochii) to aid in sustainable aquaculture production strategies [J]. Frontiers in Microbiology, 2022(13): 881275.
[9] Keerthisinghe T P, Wang F, Wang M, et al. Long-term exposure to TET increases body weight of juvenile zebrafish as indicated in host metabolism and gut microbiome [J]. Environment International, 2020(139): 105705.
[10] 田璐, 游翘楚, 迟长凤, 等. 黄姑鱼耐寒相关基因CIRP、nefm的克隆及表达特征分析 [J]. 浙江海洋大学学报(自然科学版), 2019, 38(4): 286-294.] Tian L, You Q C, Chi C F, et al. Characterization of cold -tolerance related genes, CIRP and nefm in Nibea albiflora by cloning and expression analysis [J]. Journal of Zhejiang Ocean University (Natural Science), 2019, 38(4): 286-294. [
[11] 唐秀琴. 黄姑鱼(Nibea albiflora) TLR13基因克隆及免疫相关机制探究 [D]. 舟山: 浙江海洋大学, 2022: 1.] Tang X Q. Cloning of TLR13 gene from Nibea albiflora exploration of related immune mecha [D]. Zhoushan: Zhejiang Ocean University, 2022: 1. [
[12] 王苓, 田相利, 董双林, 等. 两株芽孢杆菌对凡纳滨对虾生长和血清非特异性免疫指标的影响研究 [J]. 中国海洋大学学报(自然科学版), 2017, 47(4): 14-21.] Wang L, Tian X L, Dong S L, et al. Effects of two Bacillus on growth performance and serum non-specific immunity of Litopenaeus vannamei [J]. Periodical of Ocean University of China, 2017, 47(4): 14-21. [
[13] Bardhan A, Abraham T J, Dash G, et al. Intestinal histopathological aberrations in Oreochromis niloticus juveniles upon dietary florfenicol administration [J]. Bulletin of Environmental Contamination and Toxicology, 2024, 112(4): 50. doi: 10.1007/s00128-024-03876-z
[14] 张石云, 宋超, 张敬卫, 等. 微塑料暴露对罗非鱼肌肉中磺胺甲唑残留的影响 [J]. 生态与农村环境学报, 2018, 34(9): 857-864.] Zhang S Y, Song C, Zhang J W, et al. Effects of Micro-Plastics on Sulfamethoxazole (SMZ) Residues in Tilapia (Oreochromis niloticus) Muscle [J]. Journal of Ecology and Rural Environment, 2018, 34(9): 857-864. [
[15] Zhou L, Limbu S M, Qiao F, et al. Influence of long-term feeding antibiotics on the gut health of zebrafish [J]. Zebrafish, 2018, 15(4): 340-348. doi: 10.1089/zeb.2017.1526
[16] Ma S P, Wang L G, Zeng Y Q, et al. Reparative effect of different dietary additives on soybean meal-induced intestinal injury in yellow drum (Nibea albiflora) [J]. Frontiers in immunology, 2023(14): 1296848-1296848.
[17] 曾延清. 低鱼粉饲料中添加姜黄素对黄姑鱼生长性能、饲料利用及肠道健康的影响研究 [D]. 舟山: 浙江海洋大学, 2022: 13.] Zeng Y Q. Effects of curcumin supplementation in low-fish meal diet on growth performance, feed utilization and intestinal health of yellow drum (Nibea albiflora) [D]. Zhoushan: Zhejiang Ocean University, 2022: 13. [
[18] Xu D D, Zhang W C, Chen R Y, et al. Chromosome-scale assembly and high-density genetic map of the yellow drum, Nibea albiflora [J]. Scientific Data, 2021, 8(1): 268. doi: 10.1038/s41597-021-01045-z
[19] 吴莉芳, 邢秀苹, 赖红娥, 等. 大豆抗原蛋白Glycinin对鲤稚鱼和幼鱼肠道组织的影响 [J]. 西北农林科技大学学报(自然科学版), 2014, 42(10): 7-14.] Wu L F, Xing X P, Lai H E, et al. Effects of soybean antigen protein Glycinin on intestinal tissues of larval and juvenile common carps [J]. Journal of Northwest A& F University(Natural Science Edition), 2014, 42(10): 7-14. [
[20] Roy S, Bhattacharya S. Arsenic-induced histopathology and synthesis of stress proteins in liver and kidney of Channa punctatus [J]. Ecotoxicology and Environmental Safety, 2006, 65(2): 218-229. doi: 10.1016/j.ecoenv.2005.07.005
[21] Sun B Y, Yang H X, He W, et al. A grass carp model with an antibiotic-disrupted intestinal microbiota [J]. Aquaculture, 2021(541): 736790.
[22] 宋德青, 于晓清, 季相山, 等. 植物乳杆菌LP-37和氟苯尼考对许氏平鲉(Sebastes schlegelii)肠道形态、消化酶及免疫酶活性的影响 [J]. 水产学杂志, 2024, 37(4): 49-55.] Song D Q, Yu X Q, Ji X S, et al. Effects of Lactobacillus plantarum LP-37 and florfenicol on intestinal histomorphology, and activities of digestive enzymes and immune enzymes of Schlegel’s black rockfish Sebastes schlegelii [J]. Chinese Journal of Fisheries, 2024, 37(4): 49-55. [
[23] 黄垚, 秦真东, 陈嘉俊, 等. 抗菌素对草鱼肠道免疫和菌群的影响 [J]. 水产学报, 2023, 47(10): 58-71.] Huang Y, Qin Z D, Chen J J, et al. Effects of antimicrobials on intestinal immunity and microflora in grass carp (Ctenopharyngodon idella) [J]. Journal of Fisheries of China, 2023, 47(10): 58-71. [
[24] Ahmad I, Hamid T, Fatima M, et al. Induction of hepatic antioxidants in freshwater catfish (Channa punctatus Bloch) is a biomarker of paper mill effluent exposure [J]. Biochimica et Biophysica Acta (BBA) - General Subjects, 2000, 1523(1): 37-48. doi: 10.1016/S0304-4165(00)00098-2
[25] Belardi B, Hamkins-Indik T, Harris A R, et al. A weak link with actin organizes tight junctions to control epithelial permeability [J]. Developmental Cell, 2020, 54(6): 792-804. e7.
[26] Yamamoto T, Harada N, Kano K, et al. The Ras target AF-6 interacts with ZO-1 and serves as a peripheral component of tight junctions in epithelial cells [J]. The Journal of Cell Biology, 1997, 139(3): 785-795. doi: 10.1083/jcb.139.3.785
[27] Zhadanov A B, Provance D W, Speer C, et al. Absence of the tight junctional protein AF-6 disrupts epithelial cell–cell junctions and cell polarity during mouse development [J]. Current Biology, 1999, 9(16): 880-8S2. doi: 10.1016/S0960-9822(99)80392-3
[28] Lie P P, Mruk D D, Lee W M, et al. Cytoskeletal dynamics and spermatogenesis [J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2010, 365(1546): 1581-1592. doi: 10.1098/rstb.2009.0261
[29] 成好学, 王庚申, 许叶祥, 等. 2种抗生素对大黄鱼肠道组织及紧密连接蛋白基因表达的影响 [J]. 水产科学, 2024, 43(4): 531-540.] Cheng H X, Wang G S, Xu Y X, et al. Effects of two antibiotics on intestinal histological structure and tight junction protein gene expression in large yellow croaker Larimichthys crocea [J]. Fisheries Science, 2024, 43(4): 531-540. [
[30] Hoffmann J A, Reichhart J M. Drosophila innate immunity: an evolutionary perspective [J]. Nature Immunology, 2002, 3(2): 121-126. doi: 10.1038/ni0202-121
[31] Zhou L, Limbu S M, Shen M, et al. Environmental concentrations of antibiotics impair zebrafish gut health [J]. Environmental Pollution, 2018(235): 245-254.
[32] Wei J, Zhou T, Hu Z, et al. Effects of triclocarban on oxidative stress and innate immune response in zebrafish embryos [J]. Chemosphere, 2018(210): 93-101.
[33] Liang X, Wang F, Li K, et al. Effects of norfloxacin nicotinate on the early life stage of zebrafish (Danio rerio): Developmental toxicity, oxidative stress and immunotoxicity [J]. Fish & Shellfish Immunology, 2020(96): 262-269.
[34] Cen H, Li H, Chen R, et al. Exploring the sex dimorphism in the expression of intestinal barrier and immune-related genes and intestinal microbiota in cage-cultured large yellow croaker (Larimichthys crocea) during the overwintering period along the Zhoushan coast [J]. Frontiers in Marine Science, 2024(11): 1391035 .
[35] 浦岩松. 抗生素在水产养殖应用存在的问题及对策 [J]. 黑龙江水产, 2023, 42(4): 291-293.] doi: 10.3969/j.issn.1674-2419.2023.04.015 Pu Y S. Problems and countermeasures of antibiotic application in aquaculture [J]. Northern Chinese Fisheries, 2023, 42(4): 291-293. [ doi: 10.3969/j.issn.1674-2419.2023.04.015
[36] 董飞, 于悦, 丁可, 等. HPLC-MS/MS法测定水产养殖用水中6种常用抗生素残留 [J]. 化学研究与应用, 2024, 36(5): 1148-1153.] doi: 10.3969/j.issn.1004-1656.2024.05.027 Dong F, Yu Y, Ding K, et al. Determination of six antibiotics residues in aquaculture water by High-performance liquid chromatography tandem mass spectrometry [J]. Chemical Research and Application, 2024, 36(5): 1148-1153. [ doi: 10.3969/j.issn.1004-1656.2024.05.027
[37] 中华人民共和国农业农村部. 农业部发布动物性食品中兽药最高残留限量(续): 中国兽医杂志: 1002-1280[S]. 2003: 5-11.] Ministry of Agriculture and Rural Affairs of the People's Republic of China. The Ministry of Agriculture issued the maximum residue limits for veterinary drugs in animal food (continued): Chinese Journal of Veterinary Medicine: 1002-1280[S]. 2003: 5-11.
[38] 杨秋红, 艾晓辉, 李荣, 等. 固相萃取-气相色谱法同时检测水产品中的氯霉素、甲砜霉素、氟苯尼考和氟苯尼考胺 [J]. 分析试验室, 2015, 34(5): 533-537.] Yang Q H, Ai X H, Li R, et al. Simultaneous determination of chloramphenicol thiamphnicol, florfenicol and forfenicol-amine in aquatic products by Gas chromatographic method with solid phase extraction [J]. Chinese Journal of Analysis Laboratory, 2015, 34(5): 533-537. [
[39] 钟蕾, 向建国, 曾丹, 等. 饵料对鳡肠道微生物多样性的影响 [J]. 水生生物学报, 2016, 40(4): 830-835.] doi: 10.7541/2016.107 Zhong L, Xiang J G, Zeng D, et al. Effects of different diets on intestinal microbiota of Elopichthys bambusa [J]. Acta Hydrobiologica Sinica, 2016, 40(4): 830-835. [ doi: 10.7541/2016.107
[40] O'Hara A M, Shanahan F. The gut flora as a forgotten organ [J]. EMBO Reports, 2006, 7(7): 688-693. doi: 10.1038/sj.embor.7400731
[41] 毛芝娟, 王美珍, 陈吉刚, 等. 黑鲷肠炎病原恶臭假单胞菌的分离和鉴定 [J]. 渔业科学进展, 2010, 31(3): 23-28.] doi: 10.3969/j.issn.1000-7075.2010.03.004 Mao Z J, Wang M Z, Chen J G, et al. Isolation and characterization of Pseudomonas putida, a causative agent of gastroenteritis in black sea bream, Sparus Macrocephalus [J]. Progress in Fishery Sciences, 2010, 31(3): 23-28. [ doi: 10.3969/j.issn.1000-7075.2010.03.004
[42] 赵晓伟, 许瀚之, 黄华, 等. 大菱鲆源恶臭假单胞菌的分离鉴定及全基因组分析[J]. 水产科学, 2024: 1-10.] Zhao X W, Xu H Z, Huang H, et al. Isolation, Identification and Whole Genome Analysis of Pseudomonas putida Strain Isolated from Diseased Turbot Scophthalmus maximus[J]. Fisheries Science, 2024: 1-10.
[43] 许斌福, 陈秀霞, 池洪树, 等. 变形假单胞菌免疫刺激复合物对大黄鱼口服免疫效果的评价 [J]. 农业生物技术学报, 2024, 32(9): 2181-2189.] doi: 10.3969/j.issn.1674-7968.2024.09.020 Xu B F, Chen X X, Chi H S, et al. Evaluation of the oral immune effects of Pseudomonas plecoglossicida immune stimulating complexes on large yellow croaker (Larimichthys crocea) [J]. Journal of Agricultural Biotechnology, 2024, 32(9): 2181-2189. [ doi: 10.3969/j.issn.1674-7968.2024.09.020



 下载:
下载: