RESPONSE CHARACTERISTICS OF VALLISNERIA NATANS AND RHIZOSPHERE MICROBIAL COMMUNITY UNDER SEDIMENT-CADMIUM POLLUTION
-
摘要:
研究以典型沉水植物苦草(Vallisneria natans)为研究对象, 通过在0、1、5、10、20和50 mg/kg沉积物镉(Cd)污染环境下苦草鲜重、株高和叶绿素(Chlorophyll)及丙二醛(Malondialdehyde, MDA)、超氧化物歧化酶(Superoxide Dismutase, SOD)和过氧化物酶(Peroxidase, POD)活性测定来分析苦草对镉的耐受效应, 并借助生物/底泥富集因子(BSAF)和植物转运因子(TF)来了解苦草的富集能力, 同时利用16S rRNA基因扩增子测序技术研究苦草根际细菌的群落结构对沉积物镉污染环境下的响应特征。结果表明: (1) 当Cd≥20 mg/kg处理时, 苦草植株鲜重、株高、叶绿素含量和抗逆能力下降, SOD和POD活性先上升后下降, MDA含量上升; (2) BSAF均超过1表明苦草能有效地富集污染底泥中的镉, 转运系数(TF)均小于1, 说明苦草依靠根滤机制来富集镉, 建议在收获苦草时需要定期连根去除; (3) 测序结果表明苦草根际由放线菌门、厚壁菌门和变形菌门等37个门细菌组成, 包含鞘氨醇单胞菌属、黄杆菌属、马赛菌属、芽孢杆菌属和节杆菌属等植物促生细菌, 这些细菌可能在促进苦草生长、耐受和富集重金属镉起到重要作用。研究分析了苦草在镉胁迫环境下形态学和生理生化等相关指标的变化和苦草根际细菌群落组成及其对镉胁迫的响应特征, 为后续提高苦草修复效果提供了基础。
Abstract:In this study, the typical submerged macrophyte Vallisneria natans was selscted, and the fresh weight, plant height, chlorophyll, malondialdehyde (MDA), superoxide dismutase (SOD) and peroxidase (POD) activities of Vallisneria natans were measured at 0, 1, 5, 10, 20 and 50 mg/kg of sediment cadmium contamination to analyze the cadmium tolerance effect of Vallisneria natans, and the enrichment capacities were indicated by the values of Biota-sediment accumulation factor (BSAF) and translocation factor (TF), while the 16S rRNA gene amplicon sequencing technique was used to study the community structure of Vallisneria natans rhizosphere bacteria response to the sediment cadmium contamination. The results showed that: (1) When Cd≥20 mg/kg treatment, the fresh weight, plant height, chlorophyll content and the stress resistance decreased of Vallisneria natans. The activities of SOD and POD increased firstly and then reduced, MDA content increased with increasing concentration; (2) in all the treatments, BSAF exceeded 1, indicating that Vallisneria natans could effectively enrich cadmium in the contaminated sediment, and TF was less than 1, indicating that Vallisneria natans relied on root filtration mechanism to enrich cadmium, and needed to be harvested regularly; (3) the sequencing results showed that the rhizosphere bacteria of Vallisneria natans were mainly composed of 37 phylum, such as Actinobacteria, Firmicutes and Proteobacteria, including plant growth-promoting bacteria such as Sphingomonas, Flavisobacter, Massilia, Bacillus, and Arthrobacter, which may play important roles in promoting the growth, tolerance, and enrichment of cadmium in Vallisneria natans. In this study, we preliminarily analyzed the changes of morphological, physiological and biochemical indicators of Vallisneria natans under varied cadmium stress environments, and the composition of Vallisneria natans rhizosphere bacterial community and its response characteristics to cadmium stress, which provide guidance for the subsequent improvement of Vallisneria natans restoration efficiency.
-
Keywords:
- Sediment /
- Cadmium /
- Restoration /
- Microorganisms community /
- Vallisneria natans
-
环境中镉含量的升高来源于各种人为活动, 例如采矿、冶炼、施肥、灌溉和化石燃料的使用等将镉释放到环境中[1]。与有机污染物不同, 镉不能自然分解, 仅能直接或间接通过地表径流被排放到水环境中, 并在沉积物中累积。在贵州草海[2]、大冶湖[3]和洪泽湖[4]等湖泊沉积物中镉浓度高达31.38、22.5和24.11 mg/kg, 超过湖泊沉积物地球化学背景值0.22—9 mg/kg。Li等[5]对2000—2019年中国五个地理区域的190个湖泊沉积物中重金属(Cu、Pb、Zn、Ni、Cr、As、Hg和Cd)数据分析研究, 得出中国湖泊沉积物表现出中等的潜在生态风险, 镉是其主要污染物。因此, 迫切需要制定低成本的镉污染沉积物修复策略。
植物修复是一种通过根系富集重金属后收获组织的原位处理技术, 由于其有效、低成本和环境友好性已被用于修复受镉污染的沉积物[6—8]。已经证明, 水生植物如轮叶黑藻(Hydrilla verticillata)、加拿大伊乐藻(Elodea canadensi)和苦草(Vallisneria natans)可以从受污染的沉积物中积累重金属镉[6, 9]。然而植物修复只适合于一定程度的重金属污染。如高浓度的镉会通过影响碳水化合物代谢、硝酸盐的吸收、光合活性、抗氧化系统及破坏主要细胞器等来影响水生植物生长[7, 10, 11], 进而导致水生植物修复重金属镉污染沉积物受到限制。近年来, 研究人员致力于调节根际区域环境, 使之能够提高植物修复效果[12]。微生物是镉迁移和植物解毒的重要参与者[13]。根际微生物群落中的一些细菌可以通过分泌铁载体和植物激素来促进植物根系的生长, 提高养分的利用率[6, 14, 15], 增加重金属可利用性, 从而促进植物吸收和积累重金属[14, 16]。所以了解植物根际微生物对沉积物镉污染的响应特征将有助于有效地进行植物修复。
苦草广泛存在于水生态系统中, 具有耐受性强、光补偿点低、繁殖能力强和重金属富集效果好等优点, 因此常被作为富营养化湖泊中沉水植物恢复重建和水体底泥重金属污染生态修复的先锋物种[9, 17]。目前对苦草的研究主要是镉污染底泥的富集效果和对其生理指标的影响, 对根际微生物群落结构的研究相对较少。因此, 本研究以苦草为研究对象, 研究在不同浓度镉污染胁迫下苦草生长特性和生理特征, 并且明晰苦草根际微生物群落结构变化, 旨在找到沉水植物苦草耐受的沉积物镉含量以指导实际的植物修复措施的使用, 并为根际微生物促进植物修复沉积物镉污染的研究提供支撑。
1. 材料与方法
1.1 试验材料及试验设计
本研究采用的水生植物苦草来源于江苏省宿迁市水生植物基地。挑选生长状态一致的植株, 用1/10 Hoagland 营养液预培养1周。实验采用梁子湖沉积物, 风干后去除其中的粗杂质, 并过80目筛后均质化。用CdCl2·2.5H2O(分析纯)配制1 g/L的镉储存液, 稀释不同的倍数倒入沉积物中, 均匀混合并老化风干, 最终制成0、1、5、10、20 和50 mg/kg 五个含量梯度的镉污染实验沉积物备用[6, 18]。实验采用高×直径=15 cm×13 cm 的塑料小桶来模拟静态条件下的水体环境。每个小桶中称取300 g的实验沉积物, 将苦草叶片统一修剪至10 cm, 根修剪至3 cm以每桶5株的密度植入, 恒温室内培养, 培养温度为(25±1)℃, 每天用90 μmol/(m2·s)的光照12h/黑暗12h, 每隔4d用自来水补充蒸发的水分, 实验设置3个平行, 实验周期为36d。
1.2 植物、水体与沉积物中镉含量测定
植物中镉含量测定: 实验结束后取出植物整株用去离子水冲洗2—3遍, 擦干植物表面水分后置于烘箱中, 在80℃烘干至恒重, 磨碎后称取0.1 g用H2O2﹕HNO3=1﹕3(v/v)进行微波消解[19], 然后采用电感耦合等离子体发射光谱仪(ICP-OES PekinElmer Optima 8000DV)测定镉含量[20]。沉积物样本在去除烂根及碎屑后, 冷冻干燥并研磨过100目筛用于重金属和理化性质测定, 沉积物镉含量经酸性混合物(HNO3、HF)微波消解后, 采用电感耦合等离子体质谱仪(ICP-MS PekinElmer NexION300X)测定。取植物样开始前取上覆水样10 mL, 用0.22 μm滤膜过滤后, 测定其中的镉含量。
1.3 植物指标分析方法
植株形态学测定 取样时每个装置中各取3株植物, 用去离子水冲洗干净, 将植物用吸水纸吸干植物表面残留的水分, 在电子天平上称量鲜重, 并用直尺测量植株高度(在测量植株高度时, 均取整株最高的叶脉测量)。
植物生理生化指标测定 叶绿素含量的测定采用分光光度法, 用95%乙醇研磨提取后, 于470、649和665 nm处测定吸光度, 计算叶绿素a、叶绿素b含量和叶绿素总量[21, 22]; 丙二醛(Malondialdehyde, MDA)含量采用2-硫代巴比妥酸(TBA)比色法测定[23—25]: 新鲜的叶片组织在冰浴中均质化, 并用5 mL 10%三氯乙酸 (TCA) 溶液提取。匀浆在4℃下以5000 r/min离心10min。将2 mL TCA(含0.67% TBA)加入到2 mL提取液中, 纯水为空白对照, 将混合液在100℃水浴加热30min, 立即用冰水冷却, 离心后, 在450、532和600 nm处测量吸光度; 超氧化物歧化酶(Superoxide Dismutase, SOD)活性采用氮蓝四唑法测定, 过氧化物酶(Peroxidase, POD)采用愈创木酚法测定[26]。
叶片活性氧(Reactive Oxygen Species, ROS) 采用试剂盒方法进行测定: 用荧光染料DCFH-DA对苦草叶片细胞进行染色, 将苦草叶片上端叶尖处剪成小块, 用PBS冲洗2—3遍, 加入适当体积稀释好的DCFH-DA工作液(10 μmol /L)。加入的体积能充分盖住叶片为宜, 在37℃黑暗条件下染色30min, 之后用PBS缓冲液将叶片上的染液冲洗干净。将叶片固定于载玻片上, 置于激光共聚焦显微镜(Leica)下直接观察, 使用488 nm的激发波长, 525 nm的发射波长。
1.4 沉积物指标分析方法
沉积物样品分为两部分: 一份用于理化性质分析, 另一份储存在–80℃用于DNA提取。沉积物pH测定采用水土质量比10﹕1电位法测定; 总氮(TN)测定用过硫酸钾氧化—紫外分光光度法, 总磷(TP)测定用钼锑抗分光光度法[21]。采用酶活性检测试剂盒(Solarbio, 北京), 通过可见分光光度法测定沉积物中脲酶(S-UE)和磷酸酶(S-NP)活性的大小。
1.5 微生物群落的测序分析
使用FastDNA SPIN试剂盒(MP Biomedicals, USA)从沉积物样品中提取细菌群落基因组DNA。在1%琼脂糖凝胶上检查DNA提取物, 并使用NanoDrop 2000紫外—可见分光光度计(Thermo Scientific, Wilmington, USA)测定 DNA 浓度和纯度。使用PCR引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)/806R(5′-GGACTACHVGGGTWTCTAAT-3′)扩增细菌16S rRNA基因的V3—V4高变区[27]。PCR扩增如下: 95℃初始变性3min, 95℃变性30s 27个循环, 55℃退火30s, 72℃延伸45s, 然后在72℃单次延伸10min, 最后维持在10℃。5×FastPfu Buffer 4 μL、2.5 mmol/L dNTPs 2 μL、Forward Primer (5 μmol/L) 0.8 μL、Reverse Primer (5 μmol/L) 0.8 μL、FastPfu Polymerase 0.4 μL、BSA 0.2 μL、Template DNA 10 ng, 最后加ddH2O至20 μL, PCR反应一式三份进行[28]。从2%琼脂糖凝胶中提取PCR产物并使用AxyPrep DNA凝胶提取试剂盒进行纯化, 将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行检测定量。然后将扩增好的产物的两个末端加上接头, 采用IlluminaMiseq配对引物(2×300 bp)测序平台进行测序分析。使用USEARCH11-uparse算法对具有97%相似性的序列进行聚类并定义为操作分类单位(OTU), 并基于Silva138数据库进行分类, 置信度阈值为0.7。
1.6 数据统计分析
生物/底泥富集因子(Biota-Sediment Accumulation Factor, BSAF)是衡量植物对底泥中重金属的富集累积情况, 可以反映植物对该重金属的去除能力。富集因子越大, 植物对重金属的去除效果就越强, 其公式为[18, 24]:
BSAF=植物体内重金属含量/沉积物中重金属含量 (1)
转运系数(Translocation Factor, TF)可以表征植物根部向地上部分转移重金属的能力, 其公式为[19]:
TF=植物地上部分重金属含量/植物地下部分重金属含量 (2)
所有测定均重复3次, 采用SPSS 26统计软件和DPS7.05进行单因素方差分析(One way ANOVA), 不同处理组间的差异性通过最小显著性差异法(Least Significant Difference, LSD)检验, 差异显著性水平设为0.05, 采用Origin 2021绘制相关图形。利用Majorbio Cloud提供的微生物多样性分析平台, 进行数据分析。
2. 结果
2.1 苦草形态学及生理生化指标变化情况
由表 1可知, 苦草的鲜重和株高随着镉处理浓度的增加呈现下降趋势, 在胁迫处理36d后, 20和50 mg/kg处理组苦草鲜重显著低于对照组(P<0.05), 镉抑制了苦草的生长且浓度越高对其毒害作用越大。株高生长量是衡量植物吸收转化营养成分的重要指标, 在50 mg/kg处理时苦草株高最低, 为对照组的58.42%, 表明高浓度的镉显著抑制了植物的生长, 导致苦草叶片失绿和根部发黑。苦草的BSAF随镉胁迫浓度的增加呈下降趋势, 且在所有处理组中BSAF均超过1时, 表明苦草具有一定的镉污染底泥富集能力。本研究同时还分析了镉胁迫处理组中苦草叶片和根镉含量, 结果发现苦草根系镉含量大于叶片, 转运系数(TF)均小于1, 说明苦草依靠植物根滤的机制来富集镉。
表 1 不同浓度的镉处理对苦草生长的影响Table 1. Effects of different Cd concentrations on growth of Vallisneria natans (mean±SD, n=3)处理组Treatment
(mg/kg)整株生物量
Whole plant (g)株高
Plant height (cm)叶片
Leaf (mg/kg)根
Root (mg/kg)BSAF TF 0 3.123±0.534a 31.7±1.700a — — — — 1 2.712±0.157ab 27.4±0.432b 7.53±0.17e 15.33±0.78e 13.01±0.25a 0.49±0.01b 5 2.517±0.449abc 26.3±1.700b 14.73±0.37d 63.96±0.70d 6.84±0.31b 0.23±0.00d 10 2.429±0.393abc 24.9±0.660bc 32.30±0.13c 134.44±0.37c 6.01±0.16c 0.24±0.00d 20 2.092±0.209bc 23.7±1.247c 61.25±1.46b 183.52±1.66b 4.69±0.04d 0.33±0.00c 50 1.942±0.170b 18.5±0.508d 221.67±6.72a 365.84±4.75a 5.08±0.09d 0.61±0.01a 注: 表中数据为3个重复的平均值; 同一列相同右上角含有不同英文上标字母表示有显著差异(P<0.05); 下同Note: Data are means of triplicates. Means in each line sharing the different superscript are significantly different determined by Least test (P<0.05), the same applies below 为了解实验期间沉积物中的镉向上覆水释放情况, 对水样中的镉含量进行了测定, 结果发现水样中镉污染物质浓度很低, 仅在50 mg/kg时的实验组发现有少量镉存在, 检出浓度为0.24 μg/L, 与沉积物镉含量相比很低, 因此本研究不考虑水体中的镉污染对植物的影响。
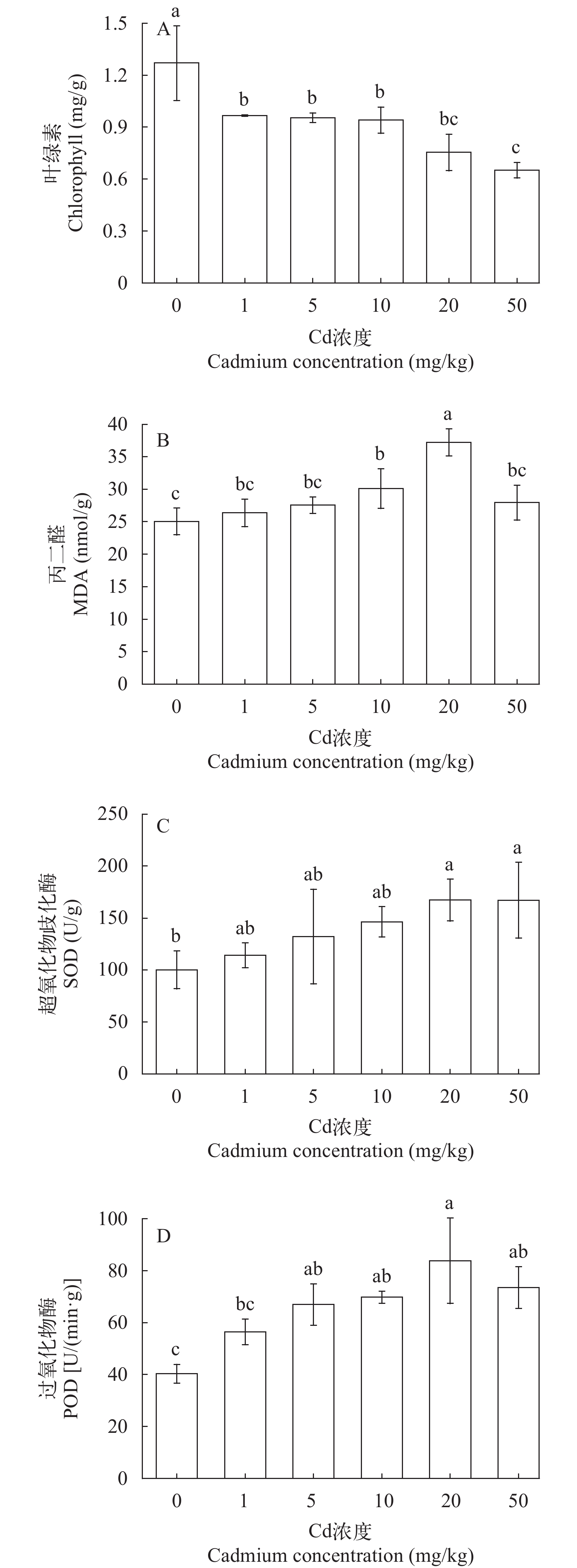
从图 1A可以看出: 叶绿素含量随胁迫浓度的增加呈下降趋势, 在50 mg/kg时胁迫处理36d时叶绿素含量最低为0.65 mg/g, 为对照组的45.85%, 此时苦草叶片较对照明显变黄、根部变黑, 表明高镉胁迫明显影响植物叶绿素的合成。从图 1B可以看出: MDA含量随镉浓度的增加呈现先上升后下降的趋势, 在20 mg/kg胁迫处理36d后MDA含量达到最大值为37.24 nmol/g, 比对照增加了48.68%。在50 mg/kg时苦草体内MDA含量下降可能是镉对苦草叶片细胞膜的毒害作用已经超过了自身调节能力, 使得植株的生长受到抑制。从图 1C可以看出: 在20 mg/kg 胁迫处理36d后SOD活性达到最大值为167.39 U/g, 与对照组相比存在显著性差异(P<0.05), 增加了67.11%, 说明苦草对镉胁迫具有一定的抗性和适应能力。从图 1D可以看出: POD活性随镉浓度的增加呈现先增加后降低的趋势, 在胁迫处理36d后, 在20 mg/kg处理组时达到最大值为83.77 U/(min·g), 比对照增加了107.81%。在20和50 mg/kg处理时, POD活性与对照组相比具有显著性差异(P<0.05)。在50 mg/kg处理时, POD活性开始下降说明此时植物抗氧化系统受到了毒害作用, 但此时POD活性依然高于对照组, 说明苦草对镉胁迫有一定的耐受性。
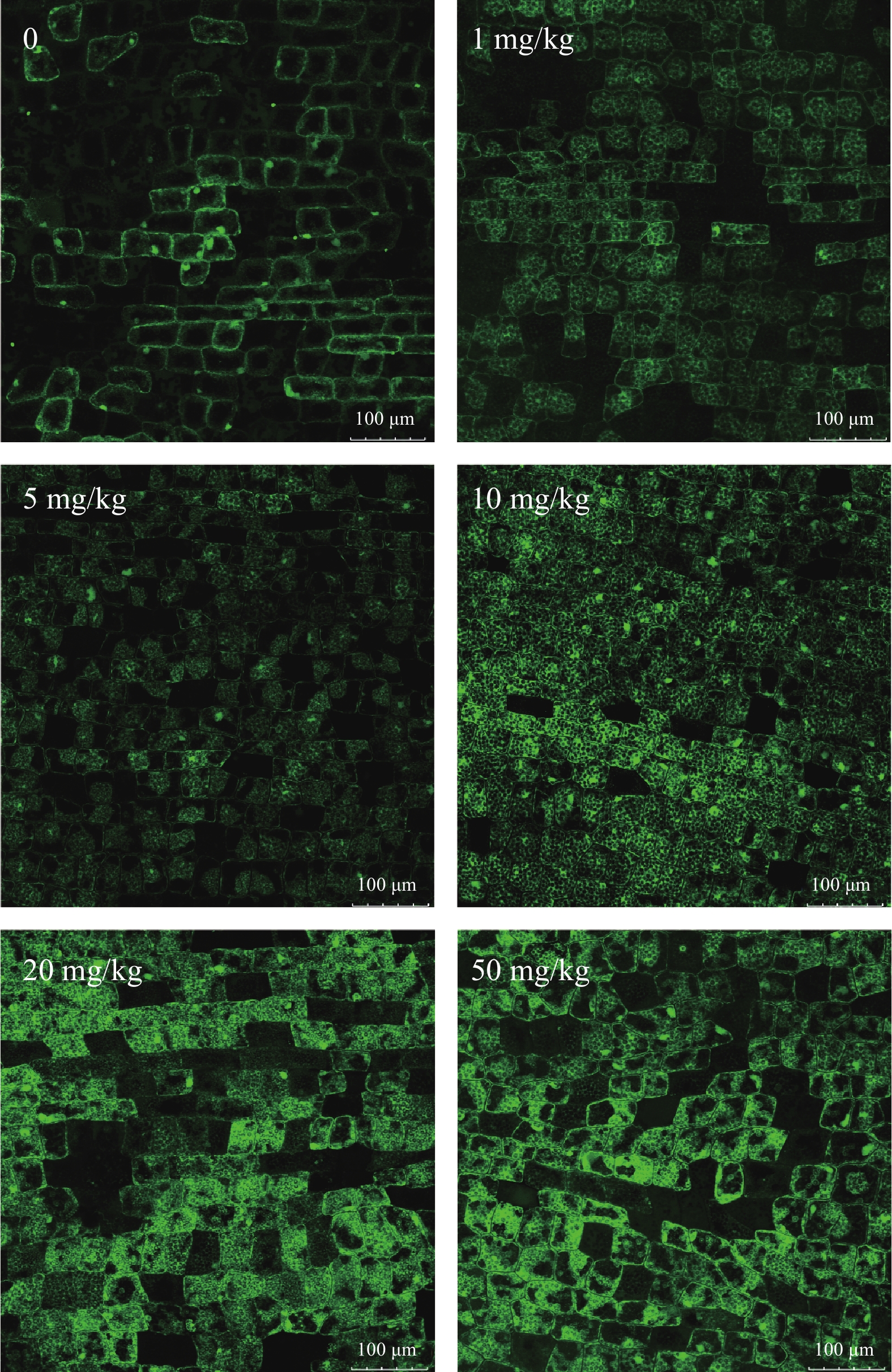
图 2是镉胁迫36d时苦草叶片的ROS分布, 绿色表示叶片中ROS的含量, 颜色越亮表示叶片ROS含量越高, 从图中可以看出随着镉浓度的增加苦草叶片中ROS的含量逐渐升高, 在20和50 mg/kg 处理组ROS含量明显高于对照组, 说明苦草叶片中受镉毒害后产生的ROS增多, ROS的过量积累是造成苦草生长抑制及植株矮小且叶片逐渐变黄的主要原因之一。
2.2 沉积物理化性质和酶活性
随着沉积物中镉污染浓度的升高, pH呈现上升趋势, 沉积物中的TN和TP的含量随镉浓度的增加呈现出先下降后上升的变化, 说明苦草在受到镉毒性后植物获取养分来满足自身生长(表 2)。镉对沉积物中的酶活性产生了一定的影响, 且随着镉浓度的增加而变化。脲酶随着镉浓度的增加呈现先降低后增加的趋势, 在10 mg/kg处理水平下达到最小值为对照组的68.09%; 磷酸酶随着镉浓度的增加呈现降低的趋势, 处理组与对照组存在显著性差异, 在10 mg/kg处理水平下达到最小值为对照组的49.51%。
表 2 沉积物pH、氮磷和酶活性Table 2. pH, nitrogen and phosphorus, and enzyme activities of sediments (mean±SD, n=3)处理组Treatment (mg/kg) 镉Cd (mg/kg) pH 总氮 TN (mg/kg) 总磷 TP (mg/kg) 脲酶 S-UE [μg/(d·g)] 磷酸酶 S-NP [μmol/(d·g)] 0 0.01±0.00e 5.46±0.02f 492.93±48.05a 134.58±10.01ab 97.76±4.09a 5.09±0.04a 1 0.72±0.01e 6.25±0.08e 324.07±52.56b 156.46±19.55a 93.86±3.92ab 4.52±0.15b 5 4.53±0.22d 6.37±0.01d 390.71±6.90b 127.90±11.36ab 80.96±12.05abc 4.50±0.22b 10 8.39±0.11c 6.62±0.02c 334.82±16.78b 139.77±12.49ab 66.56±5.71c 2.52±0.09d 20 17.58±0.46b 6.74±0.04b 350.79±50.02b 123.45±7.73b 76.87±13.01bc 2.93±0.08c 50 46.12±0.74a 7.04±0.01a 537.36±34.83a 147.19±18.38ab 88.30±3.64ab 2.77±0.04cd 2.3 苦草细菌群落组成与多样性分析
对 Illumina Miseq 测序得到的原始数据进行拼接、质控及嵌合体过滤, 最终得到可用于后续分析的有效数据(Effective Tags) 225546条。每个样品保留26849条Effective reads, 样本的文库覆盖率高于98.99%, 在97%的相似性水平上对OTUs数据进行均一化处理后进行Alpha多样性指数分析, 随着镉浓度的增加, 处理组中Shannon指数介于4.14—4.88, Chao1介于1429.09—1591.95, Simpson指数介于0.04—0.06, Sobs指数介于1146—1347, ACE介于1483.61—1619.37。随着镉浓度的升高苦草根际细菌的Sobs、Shannon指数、ACE和Chao1指数呈先上升后下降的趋势, Simpson指数无明显变化。多样性指数结果表明, 镉污染沉积物在一定程度上影响了苦草根际细菌群落丰富度, 但没有明显降低微生物多样性。
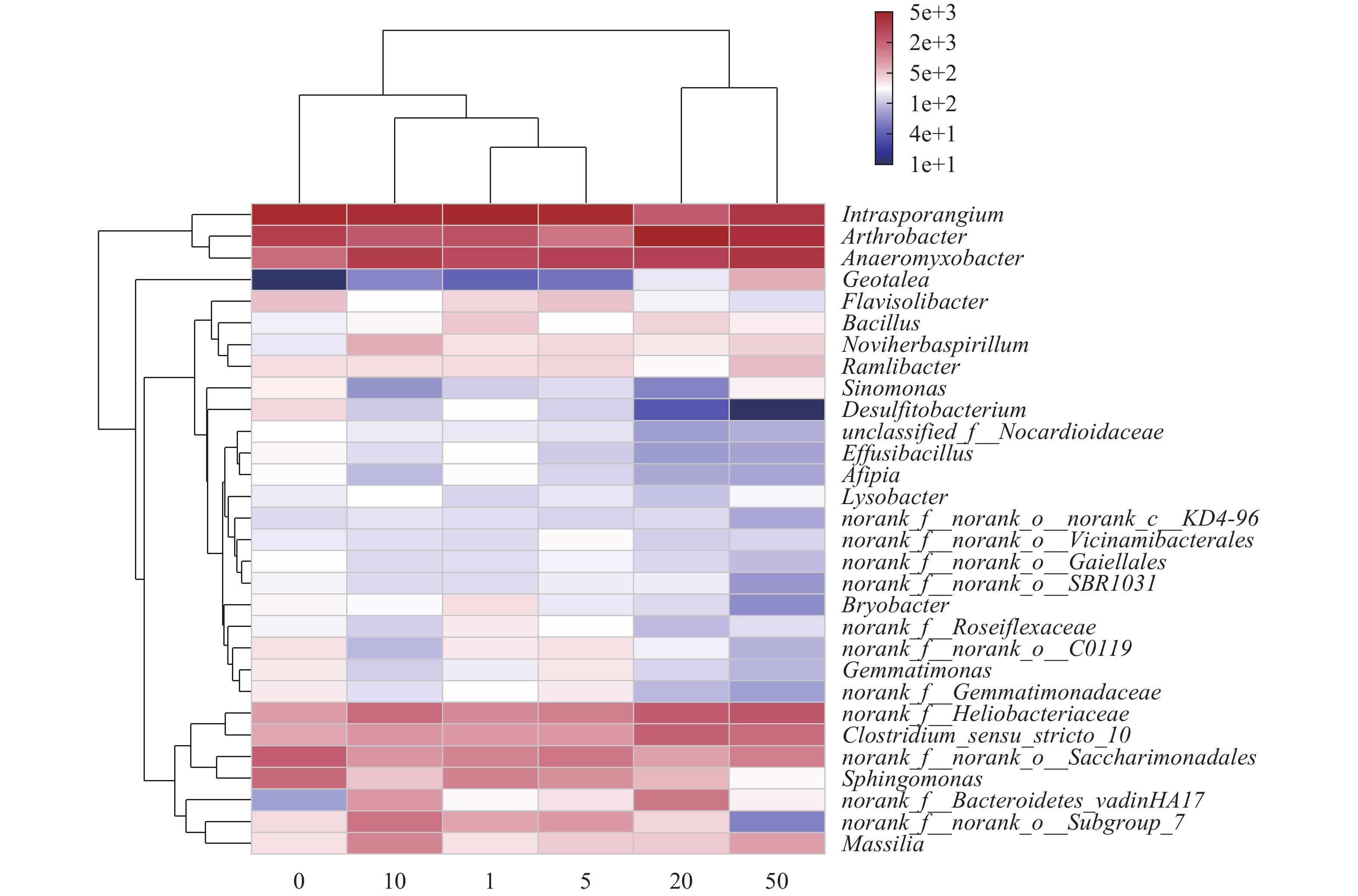
由图 3可知, 层级聚类分析表明, 微生物的相对丰度受沉积物镉浓度影响, 分为两个大类, 一类是在低浓度镉条件下(Cd≤20 mg/kg), 节杆菌属、厌氧黏杆菌属丰度降低, 另一类是在高镉浓度条件下(Cd≥20 mg/kg)改变了物种组成, 降低了间孢囊菌属、鞘氨醇单胞菌属、芽单胞菌属、黄杆菌属和苔藓杆菌属的相对丰度。对属水平丰度前30的细菌进行分析, 镉胁迫显著富集了沉积物中潜在的有益细菌, 主要包括节杆菌属、厌氧黏杆菌属、芽孢杆菌属和马赛菌属等。与对照相比, 节杆菌属、厌氧黏杆菌属、类地杆菌属和芽孢杆菌属明显增加, 间孢囊菌属、鞘氨醇单胞菌属、芽单胞菌属、黄杆菌属和苔藓杆菌属的丰度降低。
2.4 镉污染沉积物与苦草、微生物相关性分析
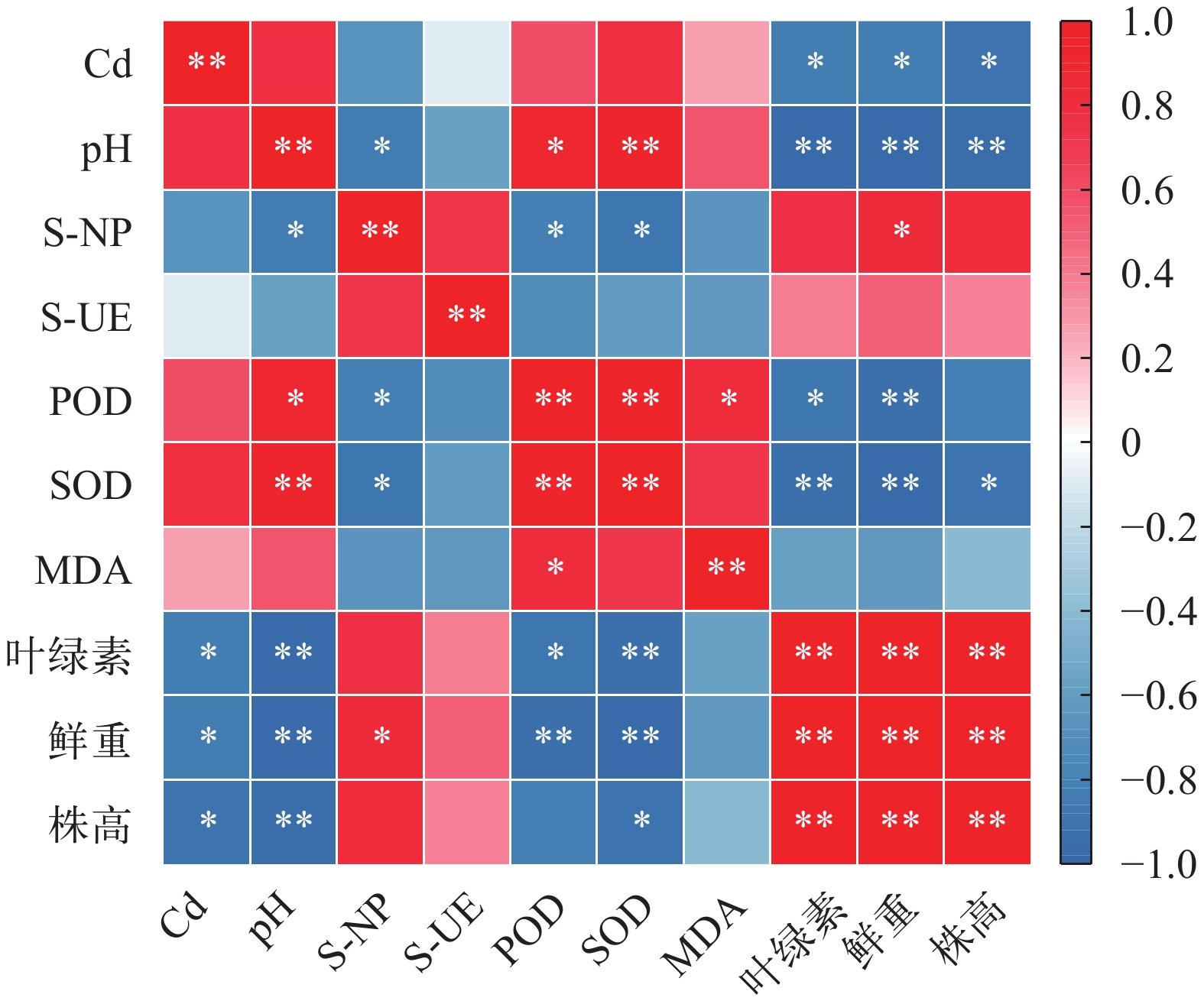
Pearson相关性分析表明(图 4): 沉积物镉浓度与苦草SOD、POD呈正相关关系, 与叶绿素含量、鲜重和株高呈显著负相关(P<0.05), 相关性系数分别为0.796(P>0.05)、0.588(P>0.05)和–825(P<0.05)、–0.837(P<0.05)和–0.915(P<0.05), 表明沉积物镉污染会影响植物的正常生理功能; 沉积物镉浓度与pH呈正相关关系, pH与磷酸酶呈显著负相关(P<0.05), 表明镉浓度会通过影响pH来改变酶活性。
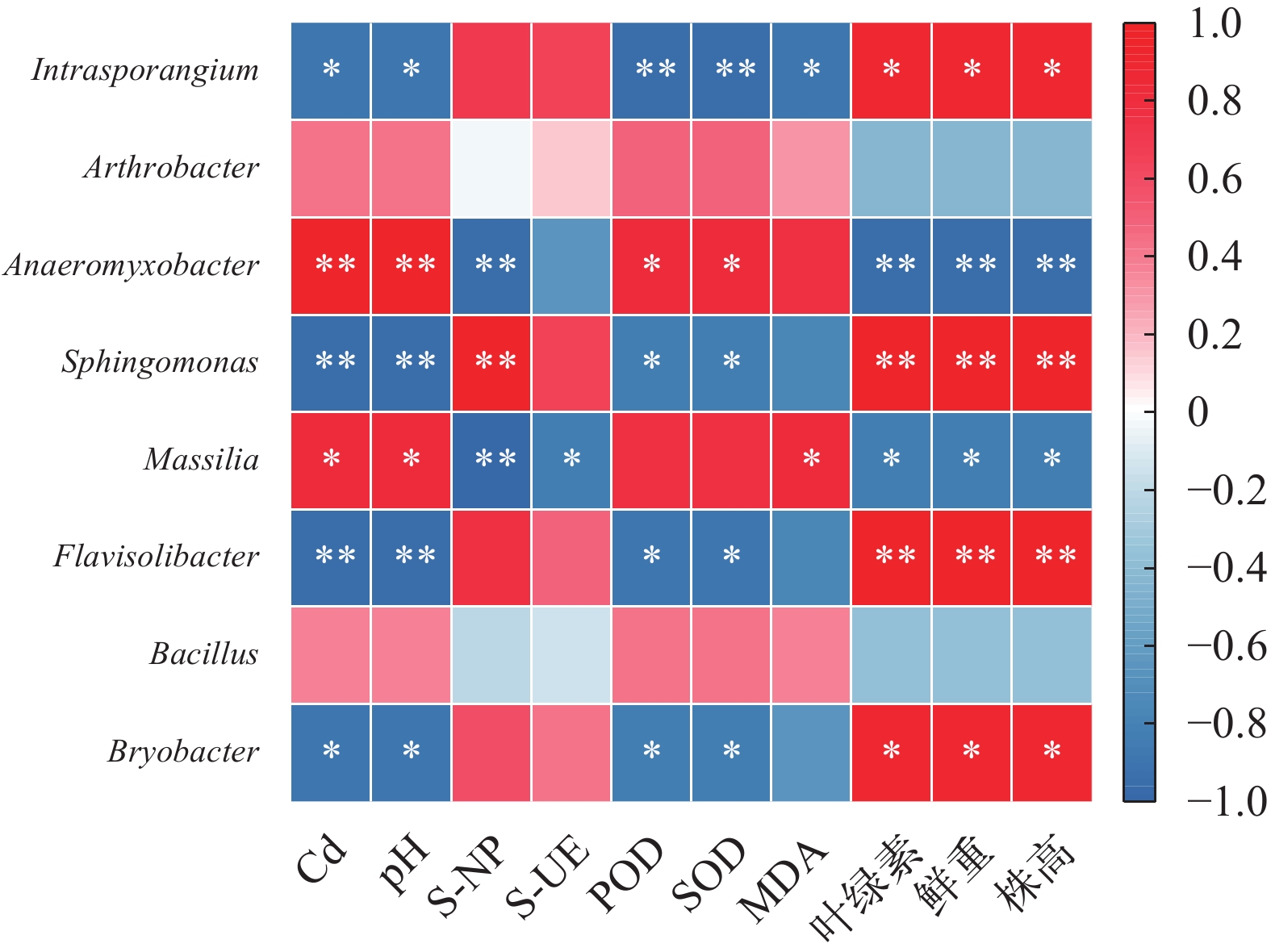
基于微生物属水平与沉积物环境指标、植物生理生化指标Spearman相关性分析表明(图 5): 沉积物镉浓度与间孢囊菌属、鞘氨醇单胞菌属、苔藓杆菌属和黄杆菌属呈显著负相关(P<0.05), 与厌氧黏杆菌属和马赛菌属呈显著正相关(P<0.05); 同时, 间孢囊菌属、鞘氨醇单胞菌属、苔藓杆菌属和黄杆菌属与苦草鲜重、叶绿素含量、株高呈显著正相关(P<0.05), 与抗氧化酶活性呈显著负相关(P<0.05); 厌氧黏杆菌属和马赛菌属与抗氧化酶活性呈显著正相关(P<0.05), 与磷酸酶、苦草鲜重、叶绿素含量、株高呈显著负相关(P<0.05); 此外, 节杆菌属、芽孢杆菌属与镉浓度呈正相关, 与植物生物量、叶绿素含量呈负相关。这些研究结果表明镉污染沉积物会影响根际微生物群落结构, 根际微生物的活动会影响苦草的生长。苦草的生长受沉积物镉污染和根际微生物活动共同影响。
3. 讨论
3.1 沉积物镉污染对苦草生长及富集转运影响
镉通过诱导一系列植物毒性症状来限制植物的生长和发育, 包括质壁分离、营养失调、叶绿素降解、水分利用效率受损和过量产生活性氧[29]。在本实验中, 随着沉积物中镉浓度的增加, 苦草的鲜重和株高呈下降趋势, 这与Wang等[30]研究结果一致。这表明高浓度的镉可以抑制苦草的生长。在一定镉浓度胁迫下, 苦草具有适应环境、抵抗逆境的能力。在本研究中, 沉水植物苦草耐受沉积物镉的浓度为1—20 mg/kg, 当超过这一浓度时, 苦草的鲜重和株高显著下降, 分别是对照组的62.18%和58.42%。
根系充当连接沉积物和叶片生物量的枢纽[31]。结果表明, 苦草不同器官积累的镉浓度呈根>叶片的模式, 表明镉从根部向叶片器官的转移减少, 这与He等[31]研究结果一致。苦草体内镉最大积累量超过100 mg/kg(DW), 且BSAF系数均超过1。此外, 从转运能力来看TF为0.33, 苦草更容易将镉富集在根部, 表明镉主要在根系中富集, 从根部到叶片部位能力较弱。这可能与植物对重金属的耐性机制有关, 植物根部有特定的结构或生理特性限制重金属离子由根部向叶片转移, 使得叶片中保持较低的重金属含量, 或者通过凋叶将重金属排出体外, 以减轻重金属对叶片的毒害[32]。由于叶片积累的镉浓度显著低于根部, 根据相关标准, 重金属向牧食者转移的量较小, 其生物放大的风险较低。综合苦草对镉污染沉积物的富集能力、转运能力和生物放大效应, 苦草可以作为修复含镉污染沉积物的优势植物。在实际应用中, 根部富集能力较强的苦草, 建议在修复时需要定期连根去除, 另外由于种植时间越长, 根系越发达, 用苦草修复底泥镉的时候需要及时收割和清理。
3.2 苦草对沉积物镉污染的耐受效应
本研究从叶绿素含量、丙二醛及抗氧化酶活性方面来分析苦草对沉积物镉污染的耐受能力。光合色素是植物进行光合作用的物质基础, 它的含量多少是决定绿色植物光合作用强弱的一个关键生理指标[32]。在本研究中, 随着沉积物中镉浓度的增加, 苦草的叶绿素含量呈下降趋势, 这与Yuan等[6]研究轮叶黑藻和加拿大伊乐藻结果一致。镉作为植物生长发育的非必需元素, 具有很强的生物毒性。当沉积物镉浓度较高时(Cd≥20 mg/kg), 苦草叶绿素含量已经受明显的抑制, 直观表现为叶片失绿、根部发黑, 这种现象在50 mg/kg时更明显。苦草叶片叶绿素含量与镉浓度呈显著负相关关系(P<0.05), 与鲜重、株高呈极显著正相关关系(P<0.01), 表明镉浓度会导致叶绿素浓度降低进而抑制光合作用, 影响植物生长, 这可以部分解释植物在形态特征上的表现[11, 23]。
氧化损伤是植物受镉胁迫伤害的主要机理之一, 植物细胞中ROS的含量通常会随着镉浓度增加而增加, 从而破坏正常的代谢平衡[33]。为了减轻镉胁迫引发的氧化损伤, 植物通常会激活抗氧化防御系统改变细胞代谢以维持细胞稳态[34], 抗氧化酶的诱导是减少氧化损伤的重要保护机制。SOD通过形成 H2O2和O2在消除超氧自由基(
${\rm{O}}^-_2 $ ·)中发挥关键作用, POD可以将H2O2分解为H2O和O2, 降低氧化损伤[22]。在本研究中, 随着镉浓度的增加, 苦草叶片内的SOD和POD 活性均呈现出先升高再降低的变化趋势, 与陶理等[18]、Guo等[23]研究其他水生植物变化情况一致, 低浓度的镉胁迫诱导了抗氧化酶活性的提高。在较低镉污染环境里(Cd≤20 mg/kg), 苦草叶片细胞中的POD和SOD活性升高, 增强了细胞内${\rm{O}}^-_2 $ ·的清除能力, 对膜系统起到了一定的保护作用。但这种保护作用是有限的, 当镉处理浓度大于20 mg/kg时, SOD和POD活性均逐渐下降, 表明镉对苦草的毒害作用已经超过了抗氧化系统自身调节能力, 清除ROS能力减弱, 导致植物膜脂过氧化加剧, 破坏膜结构, 影响蛋白质合成等各种代谢活动, 使得植株的生长受到限制。而Pearson相关性结果显示镉浓度与抗氧化酶SOD和POD 活性之间呈正相关关系, 也说明镉胁迫可以诱导抗氧化酶的产生。由图 4可知, 苦草叶片内SOD与POD呈极显著正相关关系(P<0.01), MDA 含量与POD 活性呈显著正相关关系(P<0.05)。MDA 含量的增加表明植物遭受镉胁迫后发生氧化损伤, 苦草体内的超氧自由基、过氧化物增多, 刺激植物合成SOD和POD 等抗氧化酶, 以清除体内的过氧化物, 减少氧化损伤, 所以MDA 与SOD、POD 呈正相关关系。苦草对氧化应激的这些防御机制增加了细胞能量消耗, 从而减少了细胞能量分配, 这意味着细胞分裂和正常发育的可用能量更少[24], 故而植物的生长发育受到限制, 抗氧化酶SOD、POD活性和鲜重呈显著负相关关系(P<0.05), 也说明了这一观点。3.3 苦草根际细菌群落组成及其潜在功能
重金属会对微生物群落产生影响, 破坏生物体内的单/双链和修饰碱基, 还会降低酶的活性[35], 导致微生物的多样性和丰富度减低[14]。细菌群落的多样性对于维持污染沉积物的稳定性和功能具有重要的生态意义[27]。与对照组相比, 处理组的ACE和Chao1多样性指数略有增加, 但细菌多样性(Shannon和Simpson指数)变化不明显, 表明镉毒性没有明显影响苦草根际细菌微生物群落多样性, 但降低了物种丰富度。本研究中发现在不同镉污染浓度的沉积物中pH发生明显变化, Bundoora等[36]结果表明, pH的高低会对细菌群落结构有显著影响。pH的变化会影响微生物细胞的表面性质, 从而导致生理生化过程的改变, 影响特定细菌的生存和生长, 最终改变沉积物中细菌群落结构[37]。
沉积物中的微生物可通过直接和间接作用影响修复植物的生长和修复效率。本研究结果表明: 苦草在不同镉污染和对照条件下根际细菌由放线菌(Actinobacteria)、变形菌(Proteobacteria) 和厚壁菌(Firmicutes) 等37个门和间孢囊菌属(Intrasporangium)、厌氧黏杆菌属(Anaeromyxobacter) 和norank_f Heliobacteriaceae等542个属组成。Yuan等[6]研究发现植物根际沉积物中存在有植物促生特性的细菌, 其在植物生长和植物耐受逆境胁迫等方面起到重要的作用。此外, 研究团队前期在苦草根际筛选到具有促进植物生长的根际促生菌, 如芽孢杆菌、假单胞菌和肠杆菌属, 它们通过固氮、溶磷、合成1-氨基环丙烷-1-羧酸(1-aminocy clopropane-1-carb oxylate, ACC)脱氨酶活性、吲哚乙酸和铁载体促进植物生长。与之类似, 我们对苦草根际相对丰度前30的属进行分析, 结果表明: 间孢囊菌属、鞘氨醇单胞菌属、黄杆菌属、苔藓杆菌属、节杆菌属、马赛菌属、芽单胞菌属和芽孢杆菌属等优势种群或差异种群为已报告具有耐重金属和促进植物生长的根际促生细菌[14, 28, 38—42]。芽孢杆菌属、节杆菌属和黄杆菌属已用于重金属污染土壤植物(PGPR)联合修复研究中。目前苦草生长过程中 PGPR 的有效利用开展较少, 对苦草根际PGPR分离、纯化并开展联合修复是后续研究的重要内容之一。
基于微生物属水平与沉积物环境指标、植物生理生化及形态学之间的Spearman相关性分析发现: 本研究中随着镉浓度的增加鞘氨醇单胞菌属、苔藓杆菌属、黄杆菌属、间孢囊菌属属丰度降低与镉浓度呈显著负相关(P<0.05), 与叶绿素、鲜重、株高呈显著正相关(P<0.05), 表明镉浓度降低该几种菌属的相对丰度, 进而可能导致植物叶绿素含量、鲜重和株高降低, 从而影响植物的生长。鞘氨醇单胞菌属作为一种典型的植物促生细菌, 促进叶绿素的产生和植物的生长[20], 通过提高镉的生物利用性来增强植物对镉的吸收[14]; 苔藓杆菌属可利用各种糖, 多糖和脂肪酸, 具有在缺氧条件下生长和还原硝酸盐的能力[43]; 间孢囊菌属是一种具有抵抗重金属和高还原能力的细菌[44]; 黄杆菌属具有催化H2O2以保护自身和宿主植物免受重金属氧化的功能[45], 是一种植物生长促进菌, 通过溶磷酸盐和吲哚乙酸来促进植物生长, 增加植物的抗氧化酶活性[46]。而节杆菌属、厌氧黏杆菌属、芽孢杆菌属和马赛菌属的相对丰度随镉浓度的增加而增加, 与镉浓度呈正相关关系。当Cd≥20 mg/kg时, 沉积物中脲酶活性增加可能归因于苦草根际沉积物中节杆菌属丰度的增加, 胡利伟等[47]通过宏基因组测序数据表明节杆菌属是主要的产脲酶细菌, 在土壤脲酶酶活的发挥中贡献较大。同时节杆菌属又是一种植物生长促进菌, 可以抵抗重金属毒性并产生胞外聚合物和吲哚乙酸来促进植物生长[39, 40], 从而增加植物对重金属的吸收, 在减轻氧化应激损害方面具有保护作用。厌氧黏杆菌是一种多功能的Gammaproteobacteria, 被用于重金属和放射性核素的生物修复[48]。芽孢杆菌可增强水稻的植物修复并减轻镉毒性, 通过增加抗氧化酶的活性来增强水稻对镉的耐受性, 包括过氧化氢酶、POD和SOD, 并减少对植物根系的氧化损伤[38]。马赛菌属于草酸杆菌科, 是根际微生物的重要组成部分[49], 可以产生铁载体, 螯合重金属以增加其生物可利用性来促进植物的根部吸收[41], 提高植物的抗氧化酶活性, 从而提高苦草的抗逆性。从以上报道的结果可以得知, 具有植物促生性能的细菌可通过两个方面促进植物对于重金属沉积物的修复。一方面, 直接诱导产生有机酸、铁载体、植物生长激素、ACC脱氨酶、表面活性剂和磷酸盐的增溶作用, 改善植物营养、促进植物生长, 提高重金属离子的生物可利用性[50], 进而易于被植物提取, 从而提高植物对重金属污染沉积物的修复效率。另一方面, 间接通过诱导植物抗性系统, 增加抗氧化酶活性, 降低重金属离子的迁移率和毒性等增强植物的重金属抗性[51]。目前芽孢杆菌、鞘氨醇单胞菌、节杆菌和黄杆菌, 已应用于植物-根际促生细菌联合修复镉污染土壤, 同时也有根际促生菌促进沉水植物生长的研究[52], 对后续修复镉污染沉积物具有很好的借鉴意义。
4. 结论
本文探究了镉污染沉积物对苦草的生理生化指标和微根际生物群落结构的影响。结果表明: (1)当Cd≥20 mg/kg处理时, 苦草植株开始出现伤害症状, 具体表现为鲜重和株高, 叶绿素含量和抗逆能力下降, SOD和POD活性先上升后下降, MDA含量上升; (2)根系作用是沉水植物吸收和富集沉积物镉污染的关键途径, 苦草将多数富集的镉积累在植物根部, 综合苦草对镉污染的耐受和富集能力, 并结合实际情况, 苦草可作为修复含镉沉积物的理想植物。参考植物的转运能力, 建议在收获苦草时需要定期连根去除; (3)测序结果表明苦草根际由放线菌门、厚壁菌门和变形菌门等37个门组成, 包含鞘氨醇单胞菌属、黄杆菌属、马赛菌属、芽孢杆菌属和节杆菌属等植物促生细菌(PGPR)种群, 这些细菌可能在促进苦草生长、耐受和富集重金属镉起到重要作用。对苦草根际PGPR分离、纯化并开展微生物-植物协同修复是后续研究的重要内容之一。
-
表 1 不同浓度的镉处理对苦草生长的影响
Table 1 Effects of different Cd concentrations on growth of Vallisneria natans (mean±SD, n=3)
处理组Treatment
(mg/kg)整株生物量
Whole plant (g)株高
Plant height (cm)叶片
Leaf (mg/kg)根
Root (mg/kg)BSAF TF 0 3.123±0.534a 31.7±1.700a — — — — 1 2.712±0.157ab 27.4±0.432b 7.53±0.17e 15.33±0.78e 13.01±0.25a 0.49±0.01b 5 2.517±0.449abc 26.3±1.700b 14.73±0.37d 63.96±0.70d 6.84±0.31b 0.23±0.00d 10 2.429±0.393abc 24.9±0.660bc 32.30±0.13c 134.44±0.37c 6.01±0.16c 0.24±0.00d 20 2.092±0.209bc 23.7±1.247c 61.25±1.46b 183.52±1.66b 4.69±0.04d 0.33±0.00c 50 1.942±0.170b 18.5±0.508d 221.67±6.72a 365.84±4.75a 5.08±0.09d 0.61±0.01a 注: 表中数据为3个重复的平均值; 同一列相同右上角含有不同英文上标字母表示有显著差异(P<0.05); 下同Note: Data are means of triplicates. Means in each line sharing the different superscript are significantly different determined by Least test (P<0.05), the same applies below 表 2 沉积物pH、氮磷和酶活性
Table 2 pH, nitrogen and phosphorus, and enzyme activities of sediments (mean±SD, n=3)
处理组Treatment (mg/kg) 镉Cd (mg/kg) pH 总氮 TN (mg/kg) 总磷 TP (mg/kg) 脲酶 S-UE [μg/(d·g)] 磷酸酶 S-NP [μmol/(d·g)] 0 0.01±0.00e 5.46±0.02f 492.93±48.05a 134.58±10.01ab 97.76±4.09a 5.09±0.04a 1 0.72±0.01e 6.25±0.08e 324.07±52.56b 156.46±19.55a 93.86±3.92ab 4.52±0.15b 5 4.53±0.22d 6.37±0.01d 390.71±6.90b 127.90±11.36ab 80.96±12.05abc 4.50±0.22b 10 8.39±0.11c 6.62±0.02c 334.82±16.78b 139.77±12.49ab 66.56±5.71c 2.52±0.09d 20 17.58±0.46b 6.74±0.04b 350.79±50.02b 123.45±7.73b 76.87±13.01bc 2.93±0.08c 50 46.12±0.74a 7.04±0.01a 537.36±34.83a 147.19±18.38ab 88.30±3.64ab 2.77±0.04cd -
[1] Liu Y, Tie B, Peng O, et al. Inoculation of Cd-contaminated paddy soil with biochar-supported microbial cell composite: a novel approach to reducing cadmium accumulation in rice grains [J]. Chemosphere, 2020(247): 125850. doi: 10.1016/j.chemosphere.2020.125850
[2] 林绍霞, 柳小兰, 张转铃, 等. 贵州草海表层沉积物重金属污染特征与源解析 [J]. 农业环境科学学报, 2021, 40(2): 390-399. doi: 10.11654/jaes.2020-1078 Lin S X, Liu X L, Zhang Z L, et al. Heavy metal pollution characteristics and source apportionment in overlying deposits of Caohai Lake, Guizhou Province [J]. Journal of Agro-Environment Science, 2021, 40(2): 390-399. doi: 10.11654/jaes.2020-1078
[3] Xu M, Wang R, Yang X, et al. Spatial distribution and ecological risk assessment of heavy metal pollution in surface sediments from shallow lakes in East China [J]. Journal of Geochemical Exploration, 2020(213): 106490. doi: 10.1016/j.gexplo.2020.106490
[4] Wei J, Hu K, Xu J, et al. Determining heavy metal pollution in sediments from the largest impounded lake in the eastern route of China’s South-to-North Water Diversion Project: ecological risks, sources, and implications for lake management [J]. Environmental Research, 2022, 214(3): 114118.
[5] Li D, Yu R, Chen J, et al. Ecological risk of heavy metals in lake sediments of China: a national-scale integrated analysis [J]. Journal of Cleaner Production, 2022(334): 130206. doi: 10.1016/j.jclepro.2021.130206
[6] Yuan Q, Wang P, Wang X, et al. Phytoremediation of cadmium-contaminated sediment using Hydrilla verticillata and Elodea canadensis harbor two same keystone rhizobacteria Pedosphaeraceae and Parasegetibacter [J]. Chemosphere, 2022, 286(1): 131648.
[7] Wu B, Li J, Peng D, et al. Cadmium exposure alters rhizospheric microbial community and transcriptional expression of Vetiver Grass [J]. Frontiers in Plant Science, 2022(13): 808844. doi: 10.3389/fpls.2022.808844
[8] Rezania S, Taib S M, Md Din M F, et al. Comprehensive review on phytotechnology: heavy metals removal by diverse aquatic plants species from wastewater [J]. Journal of Hazardous Materials, 2016(318): 587-599. doi: 10.1016/j.jhazmat.2016.07.053
[9] 乔云蕾, 李铭红, 谢佩君, 等. 沉水植物对受重金属镉、锌污染的水体底泥的修复效果 [J]. 浙江大学学报(理学版), 2016, 43(5): 601-609. Qiao Y L, Li M H, Xie P J, et al. A study on the absorption of cadmium and zinc in the water sediments with submerged plants [J]. Journal of Zhejiang University (Science Edition), 2016, 43(5): 601-609.
[10] Huang S, Huang X, Cheng H, et al. Role of phosphorus in Vallisneria natans and biofilm exposure to Pb2+ and Cd2+ stress [J]. Science of The Total Environment, 2022(835): 155235. doi: 10.1016/j.scitotenv.2022.155235
[11] Wang L, Gao Y, Wang X, et al. Warming enhances the cadmium toxicity on macrophyte Myriophyllum aquaticum (Vell. ) Verd. seedlings [J]. Environmental Pollution, 2021(268): 115912. doi: 10.1016/j.envpol.2020.115912
[12] Sarwar N, Imran M, Shaheen M R, et al. Phytoremediation strategies for soils contaminated with heavy metals: modifications and future perspectives [J]. Chemosphere, 2017(171): 710-721. doi: 10.1016/j.chemosphere.2016.12.116
[13] Sharma P. Efficiency of bacteria and bacterial assisted phytoremediation of heavy metals: An update [J]. Bioresource Technology, 2021(328): 124835. doi: 10.1016/j.biortech.2021.124835
[14] Zhou X, Shi A, Rensing C, et al. Wood vinegar facilitated growth and Cd/Zn phytoextraction of Sedum alfredii Hance by improving rhizosphere chemical properties and regulating bacterial community [J]. Environmental Pollution, 2022(305): 119266. doi: 10.1016/j.envpol.2022.119266
[15] 朱桐豆. 粉绿狐尾藻及根际促生菌强化人工湿地净化镉污染水体研究 [D]. 郑州: 郑州大学, 2021: 29-41. Zhu T D. Study on the enhancement of constructed wetland purification of cadmium polluted water by Myriophyllum aquaticum and plant growth-promoting rhizobacteria [D]. Zhengzhou: Zhengzhou University, 2021: 29-41.
[16] Kushwaha P, Neilson J W, Maier R M, et al. Soil microbial community and abiotic soil properties influence Zn and Cd hyperaccumulation differently in Arabidopsis halleri [J]. Science of The Total Environment, 2022(803): 150006. doi: 10.1016/j.scitotenv.2021.150006
[17] 陈萍萍, 赵风斌, 王丽卿, 等. 铜离子胁迫对苦草生长特性及生理指标的影响 [J]. 生态与农村环境学报, 2013, 29(2): 230-233. Chen P P, Zhao F B, Wang L Q, et al. Effect of copperion stress on growth and physiological parameters of Vallisneria natans [J]. Journal of Ecology and Rural Environment, 2013, 29(2): 230-233.
[18] 陶理, 王沛芳, 袁秋生, 等. 4种典型沉水植物对去除镉污染底泥的应用效果 [J]. 环境科学, 2021, 42(9): 4311-4318. Tao L, Wang P F, Yuan Q S, et al. Application effect of four typical submerged macrophytes on removing cadmium from polluted sediment [J]. Environmental Science, 2021, 42(9): 4311-4318.
[19] Chen Z, Tian W, Li Y, et al. Responses of rhizosphere bacterial communities, their functions and their network interactions to Cd stress under phytostabilization by Miscanthus spp. [J]. Environmental Pollution, 2021(287): 117663. doi: 10.1016/j.envpol.2021.117663
[20] He T, Xu Z, Wang J, et al. Improving cadmium accumulation by Solanum nigrum L. via regulating rhizobacterial community and metabolic function with phosphate-solubilizing bacteria colonization [J]. Chemosphere, 2022(287): 132209. doi: 10.1016/j.chemosphere.2021.132209
[21] Lin Q, Fan M, Peng X, et al. Response of Vallisneria natans to aluminum phytotoxicity and their synergistic effect on nitrogen, phosphorus change in sediments [J]. Journal of Hazardous Materials, 2020(400): 123167. doi: 10.1016/j.jhazmat.2020.123167
[22] Abduro Ogo H, Tang N, Li X, et al. Combined toxicity of microplastic and lead on submerged macrophytes [J]. Chemosphere, 2022(295): 133956. doi: 10.1016/j.chemosphere.2022.133956
[23] Guo H, Jiang J, Gao J, et al. Evaluation of cadmium hyperaccumulation and tolerance potential of Myriophyllum aquaticum [J]. Ecotoxicology and Environmental Safety, 2020(195): 110502. doi: 10.1016/j.ecoenv.2020.110502
[24] Fan P, Liu C, Ke Z, et al. Growth and physiological responses in a submerged clonal aquatic plant and multiple-endpoint assessment under prolonged exposure to ciprofloxacin [J]. Ecotoxicology and Environmental Safety, 2022(239): 113690. doi: 10.1016/j.ecoenv.2022.113690
[25] Gou T, Yang L, Hu W, et al. Silicon improves the growth of cucumber under excess nitrate stress by enhancing nitrogen assimilation and chlorophyll synthesis [J]. Plant Physiology and Biochemistry, 2020(152): 53-61. doi: 10.1016/j.plaphy.2020.04.031
[26] 陈金梅, 褚一凡, 谭启洋, 等. 外源脱落酸对湿地植物美人蕉抗寒性的影响 [J]. 水生生物学报, 2021, 45(6): 1264-1272. Chen J M, Chu Y F, Tan Q Y, et al. Study on increase of the cold resistance and overwintering effect of Canna indica Linn in constructed wetland by abscisic acid [J]. Acta Hydrobiologica Sinica, 2021, 45(6): 1264-1272.
[27] Liu Q, Chen Z, Tang J, et al. Cd and Pb immobilisation with iron oxide/lignin composite and the bacterial community response in soil [J]. Science of The Total Environment, 2022(802): 149922. doi: 10.1016/j.scitotenv.2021.149922
[28] 陈兆进, 林立安, 李英军, 等. 镉胁迫对芒草根际细菌群落结构、共发生网络和功能的影响 [J]. 环境科学, 2021, 42(8): 3997-4004. doi: 10.13227/j.hjkx.202011198 Chen Z J, Lin L A, Li Y J, et al. Shifts in rhizosphere bacterial community structure, co-occurrence network, and function of Miscanthus following cadmium exposure [J]. Environmental Science, 2021, 42(8): 3997-4004. doi: 10.13227/j.hjkx.202011198
[29] Wang J, Chen X, Chu S, et al. Influence of Cd toxicity on subcellular distribution, chemical forms, and physiological responses of cell wall components towards short-term Cd stress in Solanum nigrum [J]. Environmental Science and Pollution Research, 2021, 28(11): 13955-13969. doi: 10.1007/s11356-020-11505-5
[30] Wang L, Gao Y, Jiang W, et al. Microplastics with cadmium inhibit the growth of Vallisneria natans (Lour.) Hara rather than reduce cadmium toxicity [J]. Chemosphere, 2021(266): 128979. doi: 10.1016/j.chemosphere.2020.128979
[31] He L, Wang B, Cui H, et al. Clay-hydrochar composites return to cadmium contaminated paddy soil: Reduced Cd accumulation in rice seed and affected soil microbiome [J]. Science of The Total Environment, 2022(835): 155542. doi: 10.1016/j.scitotenv.2022.155542
[32] 朱志国, 周守标. 铜锌复合胁迫对芦竹生理生化特性、重金属富集和土壤酶活性的影响 [J]. 水土保持学报, 2014, 28(1): 276-280+288. doi: 10.3969/j.issn.1009-2242.2014.01.053 Zhu Z G, Zhou S B. Effects of physiological and biochemical characteristics, accumulation of Arundo donax and soil enzyme activities under combined stress of Cu and Zn [J]. Journal of Soil and Water Conservation, 2014, 28(1): 276-280+288. doi: 10.3969/j.issn.1009-2242.2014.01.053
[33] Huang Y, Chen J, Sun Y, et al. Mechanisms of calcium sulfate in alleviating cadmium toxicity and accumulation in pak choi seedlings [J]. Science of The Total Environment, 2022(805): 150115. doi: 10.1016/j.scitotenv.2021.150115
[34] Guo Z, Lv J, Zhang H, et al. Red and blue light function antagonistically to regulate cadmium tolerance by modulating the photosynthesis, antioxidant defense system and Cd uptake in cucumber (Cucumis sativus L.) [J]. Journal of Hazardous Materials, 2022(429): 128412. doi: 10.1016/j.jhazmat.2022.128412
[35] Li Y, Chen H, Song L, et al. Effects on microbiomes and resistomes and the source-specific ecological risks of heavy metals in the sediments of an urban river [J]. Journal of Hazardous Materials, 2021(407): 124472.
[36] Bandara T, Krohn C, Jin J, et al. The effects of biochar aging on rhizosphere microbial communities in cadmium-contaminated acid soil [J]. Chemosphere, 2022(303): 135153. doi: 10.1016/j.chemosphere.2022.135153
[37] Zhang H, Wan Z, Ding M, et al. Inherent bacterial community response to multiple heavy metals in sediment from river-lake systems in the Poyang Lake, China [J]. Ecotoxicology and Environmental Safety, 2018(165): 314-324. doi: 10.1016/j.ecoenv.2018.09.010
[38] Ali Q, Ayaz M, Yu C, et al. Cadmium tolerant microbial strains possess different mechanisms for cadmium biosorption and immobilization in rice seedlings [J]. Chemosphere, 2022(303): 135206. doi: 10.1016/j.chemosphere.2022.135206
[39] Li M, Guo R, Yu F, et al. Indole-3-acetic acid biosynthesis pathways in the plant-beneficial bacterium Arthrobacter pascens ZZ21 [J]. International Journal of Molecular Sciences, 2018, 19(2): 443-458. doi: 10.3390/ijms19020443
[40] Sangsuwan P, Prapagdee B. Cadmium phytoremediation performance of two species of Chlorophytum and enhancing their potentials by cadmium-resistant bacteria [J]. Environmental Technology & Innovation, 2021(21): 101311.
[41] Sarria Carabalí M M, García-Oliva F, Cortés Páez L E, et al. Effect of cadmium contamination on the rhizosphere bacterial diversity of Echinocactus platyacanthus [J]. Rhizosphere, 2020(13): 100187. doi: 10.1016/j.rhisph.2020.100187
[42] Lin H, Liu C, Li B, et al. Trifolium repens L. regulated phytoremediation of heavy metal contaminated soil by promoting soil enzyme activities and beneficial rhizosphere associated microorganisms [J]. Journal of Hazardous Materials, 2021(402): 123829. doi: 10.1016/j.jhazmat.2020.123829
[43] Hu L, Li Q, Yan J, et al. Vegetation restoration facilitates belowground microbial network complexity and recalcitrant soil organic carbon storage in southwest China Karst region [J]. Science of the Total Environment, 2022(820): 153137. doi: 10.1016/j.scitotenv.2022.153137
[44] Liu H, Wang H, Wang G. Intrasporangium chromatireducens sp. nov., a chromate-reducing actinobacterium isolated from manganese mining soil, and emended description of the genus Intrasporangium [J]. International Journal of Systematic and Evolutionary Microbiology, 2012, 62(Pt 2): 403-408.
[45] Liu C, Lin H, Li B, et al. Responses of microbial communities and metabolic activities in the rhizosphere during phytoremediation of Cd-contaminated soil [J]. Ecotoxicology and Environmental Safety, 2020(202): 110958. doi: 10.1016/j.ecoenv.2020.110958
[46] Zhou X, Zhang X, Ma C, et al. Biochar amendment reduces cadmium uptake by stimulating cadmium-resistant PGPR in tomato rhizosphere [J]. Chemosphere, 2022(307): 136138. doi: 10.1016/j.chemosphere.2022.136138
[47] 胡利伟, 轩贝贝, 戴华鑫, 等. 宏转录组测序揭示褐土脲酶基因的表达丰度和细菌来源 [J]. 烟草科技, 2020, 53(11): 7-14. Hu L W, Xuan B B, Dai H X, et al. Expression abundances of urease genes and microbe sources of urease in cinnamon soil revealed via metatranscriptomic sequencing [J]. Tobacco Science & Technology, 2020, 53(11): 7-14.
[48] Puthusseri R M, Nair H P, Johny T K, et al. Insights into the response of mangrove sediment microbiomes to heavy metal pollution: ecological risk assessment and metagenomics perspectives [J]. Journal of Environmental Management, 2021(298): 113492. doi: 10.1016/j.jenvman.2021.113492
[49] Wang L, Wang L A, Zhan X, et al. Response mechanism of microbial community to the environmental stress caused by the different mercury concentration in soils [J]. Ecotoxicology and Environmental Safety, 2020(188): 109906. doi: 10.1016/j.ecoenv.2019.109906
[50] Wu B, He T, Wang Z, et al. Insight into the mechanisms of plant growth promoting strain SNB6 on enhancing the phytoextraction in cadmium contaminated soil [J]. Journal of Hazardous Materials, 2020(385): 121587. doi: 10.1016/j.jhazmat.2019.121587
[51] 李交昆, 余黄, 曾伟民, 等. 根际促生菌强化植物修复重金属污染土壤的研究进展 [J]. 生命科学, 2017, 29(5): 434-442. doi: 10.13376/j.cbls/2017057 Li J K, Yu H, Zeng W M, et al. Research progress on plant growth promoting rhizobacteira and their role in phytoremediation of heavy metal-contaminated soil [J]. Chinese Bulletin of Life Sciences, 2017, 29(5): 434-442. doi: 10.13376/j.cbls/2017057
[52] 王会会, 李前正, 李亚华, 等. 根际促生菌对沉水植物的促生效应及其与沉积物氮磷赋存形态的关系 [J]. 水生生物学报, 2021, 45(2): 299-307. doi: 10.7541/2021.2020.008 Wang H H, Li Q Z, Li Y H, et al. The effect of PGPR on submerged macrophyte and its relationship with the sediment nitrogen and phosphorus forms [J]. Acta Hydrobiologica Sinica, 2021, 45(2): 299-307. doi: 10.7541/2021.2020.008
-
期刊类型引用(4)
1. 范小妹,董易坤,吴聪,王帅,廖文娟,周卫军,崔浩杰. 厌氧环境下黏土矿物结构Fe(Ⅲ)还原对Cd(Ⅱ)固持特性的影响. 农业环境科学学报. 2024(05): 1045-1055 .  百度学术
百度学术
2. 陶苗苗,李亚楠,宋海涯,李维斌,周晓红,许小红. 挺水植物菖蒲根区沉积物细菌群落结构和功能特征分析. 环境化学. 2024(06): 1942-1953 .  百度学术
百度学术
3. 刘苗. 中水湿地不同植物对重金属镉的去除效果. 林业科技通讯. 2024(08): 84-87 .  百度学术
百度学术
4. 安文. 底泥疏浚对河湖水环境的影响分析. 生态与资源. 2024(01): 35-37 .  百度学术
百度学术
其他类型引用(2)



 下载:
下载: