THE MEASUREMENT OF PHOTOSYNTHETIC PARAMENTERS OF SUBMERSED MACROPHYTES WITH AIMS TO EXPLORE THE PLANT DISTRIBUTION DEPTH IN ERHAI LAKE
-
摘要: 为研究沉水植物光合特性与其分布水深的关系, 选取黑藻(Hydrilla verticillata)、苦草(Vallisneria natans)、水蕴草(Egeria densa)、大茨藻(Najas marina)、微齿眼子菜(Potamogeton maackianus)、光叶眼子菜(Potamogeton lucens)和穿叶眼子菜(Potamogeton perfoliatus)等15种洱海常见沉水植物, 测定其光合作用参数。结果表明: 光合速率为2.8—18 .1 μmol O2/(g DW·h)、暗呼吸速率为0.3—2.0 μmol O2/(g DW·h)、光补偿点为6.3—63.8 μE/(m2·s)、光饱和点为55.6—441.5 μE/(m2·s), 不同沉水植物间光合作用参数存在显著差异。结合洱海全湖沉水植物分布水深调查结果, 沉水植物的光补偿点和光饱和点与分布水深呈显著负相关; 苦草与其他物种比较具有更低的光补偿点6.3 μE/(m2·s)、光饱和点55.6 μE/(m2·s), 更适宜在深水或弱光条件下生长, 可作为沉水植被修复的先锋物种。Abstract: Photosynthesis is vital physiological process producing carbohydrate for the growth and distribution of submersed macrophytes, and thus may closely relate to the plant distribution depth. To clarify the differences of photosynthetic parameters and their relevance to the colonization depths of submersed macrophytes, we measured the light compensation and saturation points, photosynthetic rate and dark respiration of 15 submerged macrophytes, using a liquid-phase oxygen electrode, and investigated the plants distribution depth in Erhai Lake, China. The results showed that the photosynthetic rate ranged from 2.8 to 18.1 μmol O2/(g DW·h), the dark respiration rate ranged from 0.3 to 2.0 μmol O2/(g DW·h), the light compensation point ranged from 6.3 to18.1 μE/(m2·s), the light saturation point ranged from 55.6 to 441.5 μE/(m2·s). The plants had significant differences in the photosynthetic parameters. Based on a field survey of the plant distribution depth, the light compensation and saturation points of the submerged macrophytes were negatively correlated with their distribution depths. V. natans had the lowest light compensation and saturation points, and were more suitable to grow in deeper water where the experienced low light stress, and thus V. natans could be taken as a pioneer species for the restoration of submerged macrophytes in eutrophic lakes.
-
沉水植物是浅水湖泊的重要初级生产者, 光合作用作为沉水植物的基础代谢活动, 影响着其生长、发育、繁殖和分布等生理生态功能[1, 2]。在富营养化水体中, 浮游植物的大量繁殖导致水体透明度降低, 对沉水植物造成弱光胁迫, 影响沉水植物的生长, 导致沉水植物多样性减少, 并最终引起水体由清水态到浊水态转变[3, 4], 然而, 部分沉水植物在浑浊水体中有一定的耐受性, 能够在相当浑浊的水体中生存[5, 6], 沉水植物的光合特性可能是探究沉水植物对弱光胁迫的适应与不同物种间对弱光环境的适应性差异的关键[7]。近50年来, 沉水植物光合作用、呼吸作用等基础代谢活动虽有少量研究, 但仍存在诸多不足, 难以系统分析不同沉水植物间光合作用的差异, 导致在沉水植物的管理和生态修复实践中缺乏基础性知识支撑。沉水植物的光合作用和呼吸作用通常是测定其光合或呼吸作用过程中产生或消耗的水体溶解氧含量, 从而计算得出, 例如黑白瓶碘量法、YSL法、铂金电极自动测定法、氧电极法, 使用得最多的测定方法为经典的黑白瓶碘量法。本实验中采用液相氧电极法测定沉水植物的光合与呼吸过程中水体溶解氧含量的变化, 通过光合光响应(P-I)曲线拟合后获得光补偿点、光饱和点、光合速率和呼吸速率等特征参数[8]。目前, 已报道光合参数的沉水植物种类较少, 常见的报道仅有苦草(Vallisneria natans)、黑藻(Hydrilla verticillata)、穗状狐尾藻(Myriophyllum spicatum)、金鱼藻(Ceratophyllum demersum)和菹草(Potamogeton crispus)等少量物种, 或是不同生态因子胁迫影响下个别物种的光合速率、呼吸速率、光补偿点, 少见光饱和点的测定。由于光合作用对环境因子响应的敏感性较高, 不同测定方法与测定条件所得结果存在较大差异, 导致涉及多种沉水植物光合作用参数的对比分析缺乏系统性, 常见沉水植物光合作用、呼吸作用与光合参数之间的差异、不同物种间光合能力的区别难以得到清晰的认识。此外, 对某种沉水植物光合能力的理解有赖于通过其光合速率、呼吸速率、光补偿点和光饱和点四个指标进行综合判断, 光合速率和呼吸速率分别表征植物在光照条件下光合产量的能力、遮光条件下消耗氧气的能力, 光补偿点与光饱和点则可以表征植物对阴生环境的适应性, 在陆生植物的研究中, 陆地耐荫植物表现出较低的净光合速率、较低的暗呼吸速率、较低的光补偿点、较低的光饱和点和较低的高光强下光合最大产量[9]。根据我们掌握的资料, 目前尚未有其他研究同时测定上述四个指标; 因此, 本研究首次对多种沉水植物上述4个光合参数进行了测定, 可为本领域后续研究提供基础性参考。
沉水植物生长于水面以下, 受水下光照条件影响较大。在富营养水体中, 水下光照受水深、悬浮颗粒和浮游植物等因素影响, 导致水体光照不足[10, 11], 在模拟光衰减系数为0.1— 3/m条件下, 沉水植物的最适生长水深区域随着光衰减系数的增加可从6 m缩小至1 m[12], 因此, 光照是影响沉水植物分布的重要因素。沉水植物在低光照条件下的光合作用能力被认为是影响其在水体中分布深度的主要因素之一[5, 13], 沉水植物为应对水下弱光环境而改变其形态性状与生理生态性状的适应策略已有较多研究, 但沉水植物光合作用特性与其分布水深的关系仍不甚清楚。我们认为沉水植物的光补偿点与光饱和点可能是决定其在水中水深分布因素之一, 光补偿点与光饱和点低的物种可以适应更低的光照环境, 即能够分布在更深的水深范围。
我国湖泊生态系统中沉水植物退化情况严重, 沉水植物难以自然恢复, 在这种情况下, 对于受损湖泊应尽快开展有效的沉水植被修复或重建工作, 我国对于沉水植被生态修复物种的选择注重其对水体环境改善的功能性和经济性[14—16], 而忽视了不同物种的耐弱光性差异和不同物种所适宜的种植水深。然而, 这些正是沉水植物成活和繁殖的关键, 对沉水植物光合作用基础特性研究的空白, 导致沉水植被恢复工程成败参半, 因此, 若能了解不同沉水植物的光合特性及其与分布水深的关系, 从而为沉水植物恢复工程的物种选择与生态位分配提供理论支持, 对湖泊生态系统沉水植物修复具有重要意义。
洱海(100°05′—100°17′E, 25°36′—25°58′N)位于云南省大理白族自治州大理市境内, 是云南省第二大淡水湖泊, 沉水植物分布面积广泛, 分布水深范围跨度大, 沉水植物物种多样性丰富, 有利于对比分析不同沉水植物光合作用差异及其与水深分布的关系。因此, 本研究选取洱海中常见的15种沉水植物进行光合作用测定与分布水深调查研究, 测定并比较各沉水植物的光合速率、暗呼吸速率、光补偿点与光饱和点, 探讨沉水植物光合作用及特性与分布水深间的关系。
1. 材料与方法
1.1 实验材料
本研究选取洱海15种沉水植物, 分属5科9属, 包括水鳖科的黑藻(H. verticillata)、苦草(V. natans)、水蕴草(Egeria densa)和大茨藻(Najas marina); 眼子菜科的微齿眼子菜(Potamogeton maackianus)、光叶眼子菜(Potamogeton lucens)、穿叶眼子菜(Potamogeton perfoliatus)、扭叶眼子菜(Potamogeton intortusifolius)、小眼子菜(Potamogeton pusillus)、单果眼子菜(Potamogeton acutifolius)、竹叶眼子菜(Potamogeton wrightii)和篦齿眼子菜(Stuckenia pectinata); 轮藻科的轮藻(Chara vulgaris); 小二仙草科的穗状狐尾藻(M. spicatum); 金鱼藻科的金鱼藻(C. demersum)。
1.2 调查方法与测定指标
2021年6月在沿洱海湖岸设置139条样带, 每条样带采样点为湖岸0.5 m深至湖心无植物深度, 各采样点间水深差约0.5 m, 采用水下镰刀采草器(采样面积为0.2 m2)采集沉水植物, 每个采样点重复采集3个样方, 将采集到的植物按种类区分并记录分布水深。
另外, 同时期于洱海采集沉水植物, 采集到的植株均为根、茎和叶完整植株, 采集到的植株均放置在添加NaHCO3溶液的原位水中(水中NaHCO3浓度为50 mmol/L), 置于环境温度25℃并且可接受自然光照射的地点适应12h。植物叶片光合速率和呼吸速率采用液相氧电极(Hansatech Instruments, Chrololab-3, UK)测定。测定前, 使用去离子水冲洗植株叶表面附着物, 选取顶端绿色健康叶片进行测定, 将采集回的原位水用GF/C膜(Middlesex, UK., 1.2 μm-per diameter)过滤, 使用制氧机(SUNSUN, YT—302)向过滤后的原位水充入氧气。测定时, 设置测量室温度为25℃, 测量室中加入10 mL充氧原位水(反应室内初始氧含量为6.4—7.04 mg/L), 植物叶片放入测量室后, 先进行遮光处理, 测定叶片的呼吸速率, 测定时长为4—5min。在测定完成后, 向测量室中加入5 mLNaHCO3溶液(反应室内溶液最终浓度为50 mmol/L), 设置光照为10、20、40、80、160、320、640和850 μE/(m2·s)共8个光照梯度, 打开光源(红光光源, 型号: LH36/2R), 调整叶片使受光面正对光源, 根据设置的光照梯度逐渐增加光照强度, 测定植物叶片的光合速率, 每个光照梯度测定时间为4—5min, 所有光照的改变均由电脑连接Oxy-Lab控制盒完成, 呼吸速率和光合速率测定全程在封闭的反应室内完成。
每个物种的呼吸速率和光合速率的测定进行8次重复, 测量完毕后将样品放入80℃的烘箱内烘干至恒重, 并记录干重。
1.3 数据分析
沉水植物光合速率P [μmol O2/(g DW·h)]与光照I [μE/(m2·s)]间的非线性关系可以用双曲线正切方程描述。
$ P = P_{{\rm{m}}} \times {\rm{tan}}h(\text{α} \times I/P_{{\rm{m}}}) $
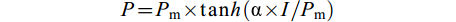
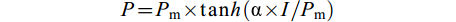
式中, P是某一光照下沉水植物的光合速率, Pm是沉水植物最大光合速率, α是高光照强度下曲线的初始斜率。然后, 按照以下公式计算沉水植物的光补偿点和光饱和点。
$ I_{{\rm{c}}} = R_{{\rm{d}}}/\text{α} $
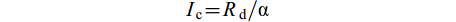
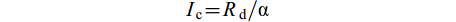
$ I_{{\rm{k}}} = P_{{\rm{m}}}/\text{α} $
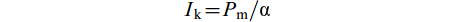
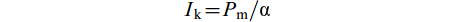
式中, Ic是沉水植物的光补偿点, Rd 是沉水植物的呼吸速率, Ik是沉水植物的光饱和点, Pm是沉水植物最大光合速率。P-I曲线拟合方程的构建、拟合和绘图在Origin 2016软件中完成。
15种沉水植物的光补偿点与暗呼吸速率采用单因素方差分析(One-way ANOVA), 当分析结果显著时, 采用Duncan法进行均值间的多重比较, 方差分析前已对所有数据进行正态分布和方差齐性检验。根据沉水植物的光补偿点和光饱和点, 对15种沉水植物进行层次聚类分析, 结果用树状图进行展示。15种沉水植物最大光合速率、呼吸速率、光补偿点、光饱和点与分布水深的关系用回归分析进行检验, 以上数据分析与绘图使用R 4.1.2软件完成, 其中Duncan分析使用“agrucolea”包、聚类分析使用“NbClust”包、绘图使用“ggplot2”包完成。
2. 结果
2.1 15种沉水植物的光合光响应拟合曲线及其光合速率和暗呼吸速率
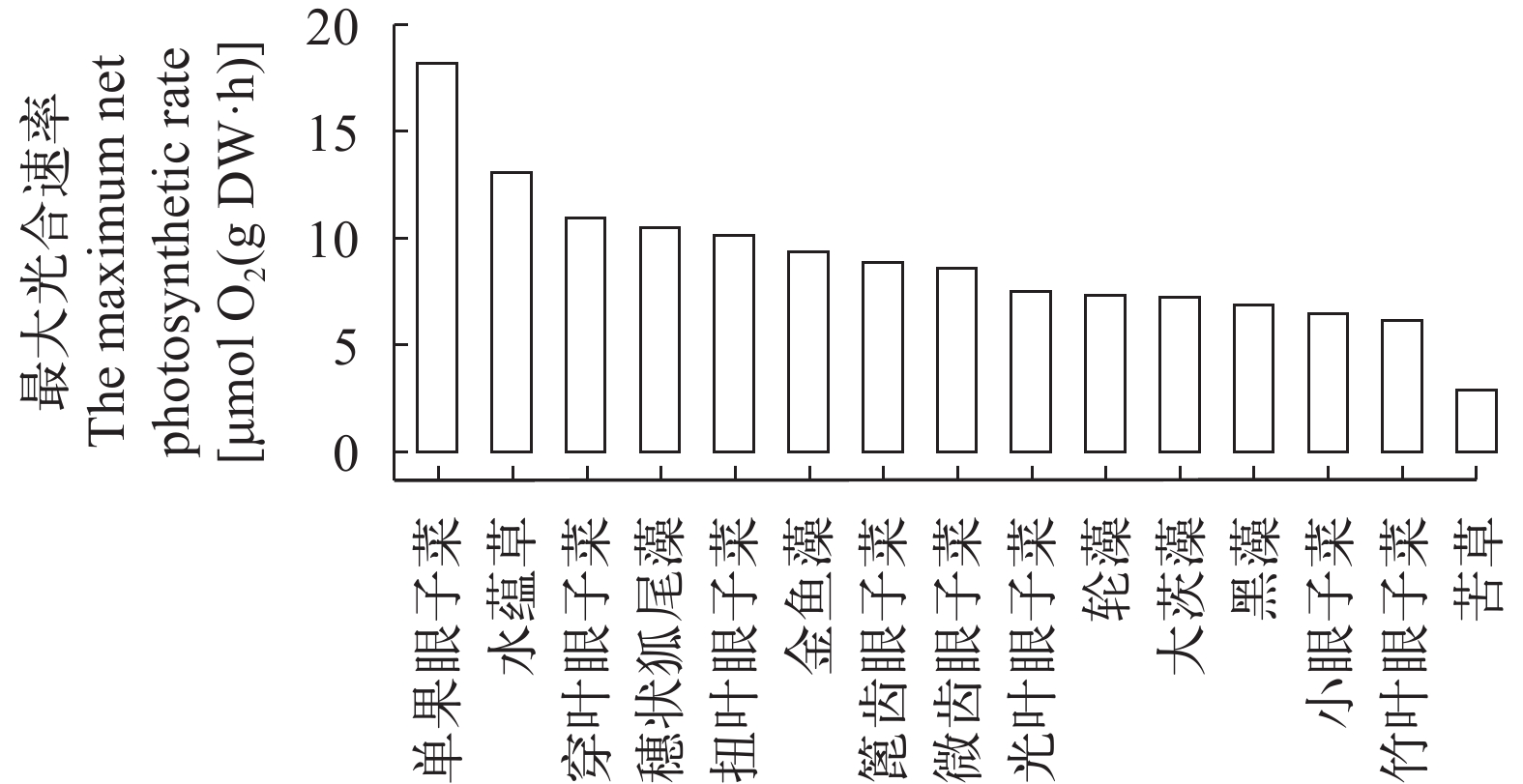
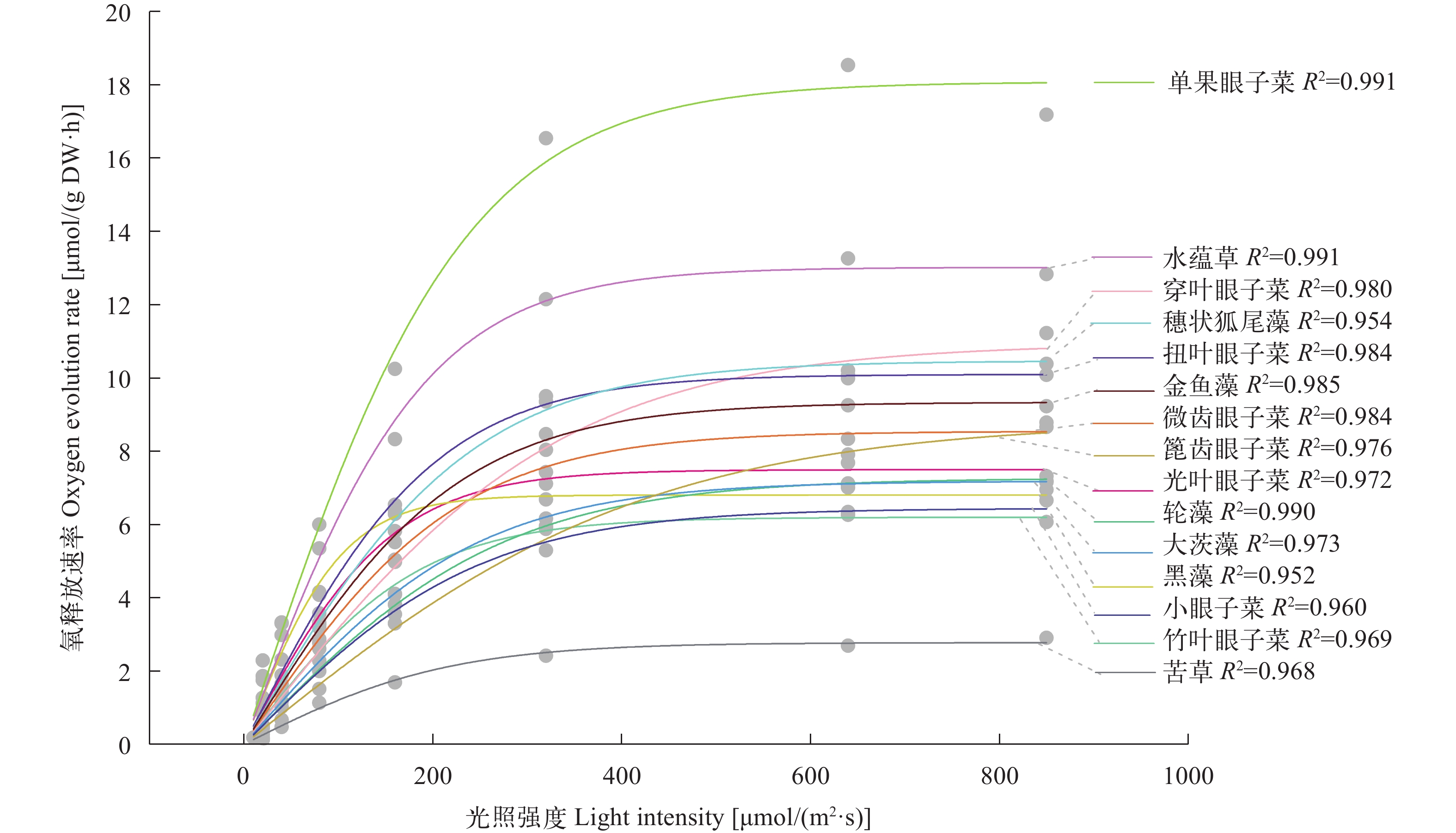
根据沉水植物的光合光响应拟合曲线结果(图 1), 15种沉水植物光合光响应拟合曲线的决定系数R2均大于0.95, 表示沉水植物氧释放速率与光照强度极相关。由图 1可见, 本研究中大部分沉水植物氧释放速率在光照强度0—360 μE/(m2·s)内随光强增加而明显增加, 在光照强度超过400 μE/(m2·s)后, 氧释放速率趋于平缓。不同的沉水植物在高光照强度下其光合光响应拟合曲线的初始斜率不同, 单果眼子菜有最大的初始斜率(α=0.08), 其次为黑藻和水蕴草(α=0.07); 篦齿眼子菜是15种沉水植物中高光照强度下光反应拟合曲线的初始斜率最小的物种(α=0.02); 穿叶眼子菜、小眼子菜、竹叶眼子菜、轮藻与大茨藻初始斜率相同(α=0.03)。
15种沉水植物的光合速率具有显著的种间差异, 表现为: 单果眼子菜>水蕴草>穿叶眼子菜>穗状狐尾藻>扭叶眼子菜>金鱼藻>篦齿眼子菜>微齿眼子菜>光叶眼子菜>轮藻>大茨藻>黑藻>小眼子菜>竹叶眼子菜>苦草, 所选取的15种沉水植物最大光合速率在2.8—18 .1 μmol O2/(g DW·h), 半数以上的沉水植物的最大光合速率在5.0 —10.0 μmol O2/(g DW·h), 从图 2可以看出, 单果眼子菜最大光合速率为18 .1 μmol O2/(g DW·h)明显高于其他14种沉水植物, 水蕴草也有较高的最大光合速率13.0 μmol O2/(g DW·h); 穿叶眼子菜、穗状狐尾藻和扭叶眼子菜最大光合速率大于10.0 μmol O2/(g DW·h)分别为10.9、10.5和10.1 μmol O2/(g DW·h); 苦草的最大光合速率为2.8 μmol O2/(g DW·h)明显低于其他14种沉水植物。
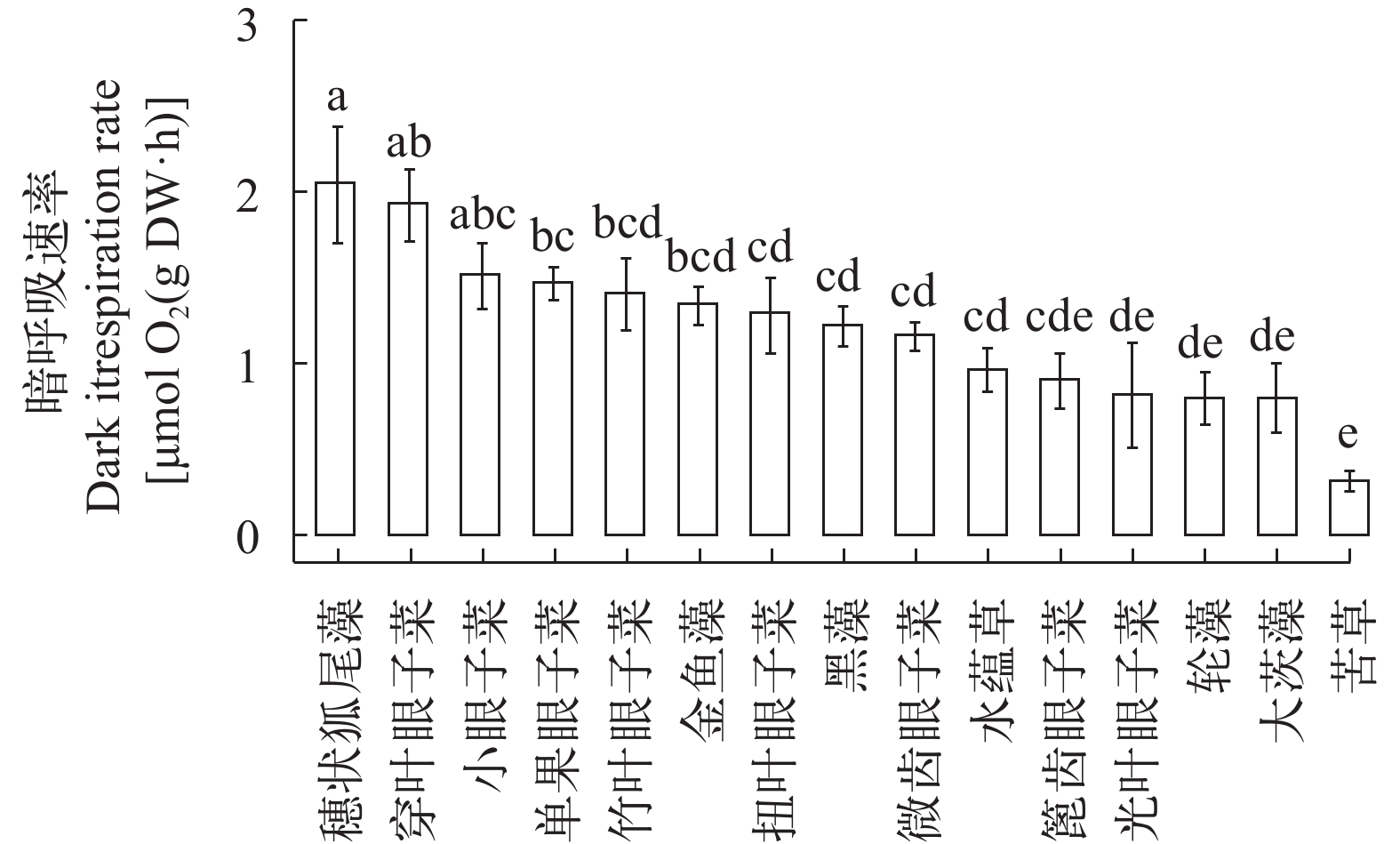
不同沉水植物的呼吸速率具有显著种间差异, 本实验测定的呼吸速率是植物在黑暗条件下的暗呼吸速率, 15种沉水植物的暗呼吸速率集中在0.3—2.0 μmol O2/(g DW·h), 穗状狐尾藻与穿叶眼子菜具有高暗呼吸速率, 分别为2.0和1.9 μmol O2/(g DW·h); 苦草具有最低暗呼吸速率, 为0.3 μmol O2/(g DW·h); 小眼子菜、单果眼子菜、竹叶眼子菜、金鱼藻、扭叶眼子菜、黑藻、微齿眼子菜、水蕴草、篦齿眼子菜、光叶眼子菜、轮藻和大茨藻的暗呼吸速率在0.8—1.5 μmol O2/(g DW·h), 各物种间差异较小(图 3)。
2.2 15种沉水植物光补偿点、光饱和点与聚类分析
15种沉水植物的光补偿点范围为6.3—63.8 μE/(m2·s)。15种沉水植物光补偿点可以分为低、中、高3个区间(图 4), 高光补偿点区间为44.8—63.8 μE/(m2·s), 包括穿叶眼子菜[63.8 μE/(m2·s)]、穗状狐尾藻[51.0 μE/(m2·s)]、小眼子菜[50.3 μE/(m2·s)]、竹叶眼子菜[46.7 μE/(m2·s)]和篦齿眼子菜[44.8 μE/(m2·s)], 其中, 穿叶眼子菜具有最高光补偿点; 中光补偿点区间为25.7—33.4 μE/(m2·s), 金鱼藻[33.4 μE/(m2·s)]、微齿眼子菜[28.9 μE/(m2·s)]、轮藻[26.7 μE/(m2·s)]、大茨藻[26.6 μE/(m2·s)]和扭叶眼子菜[25.7 μE/(m2·s)]; 低光补偿点区间为6.3—18.3 μE/(m2·s), 包括单果眼子菜[18.3 μE/(m2·s)]、黑藻[17.3 μE/ (m2·s)]、光叶眼子菜[16.2 μE/(m2·s)]、水蕴草[13.7 μE/(m2·s)]和苦草[6.3 μE/(m2·s)], 其中, 苦草具有最低光补偿点。
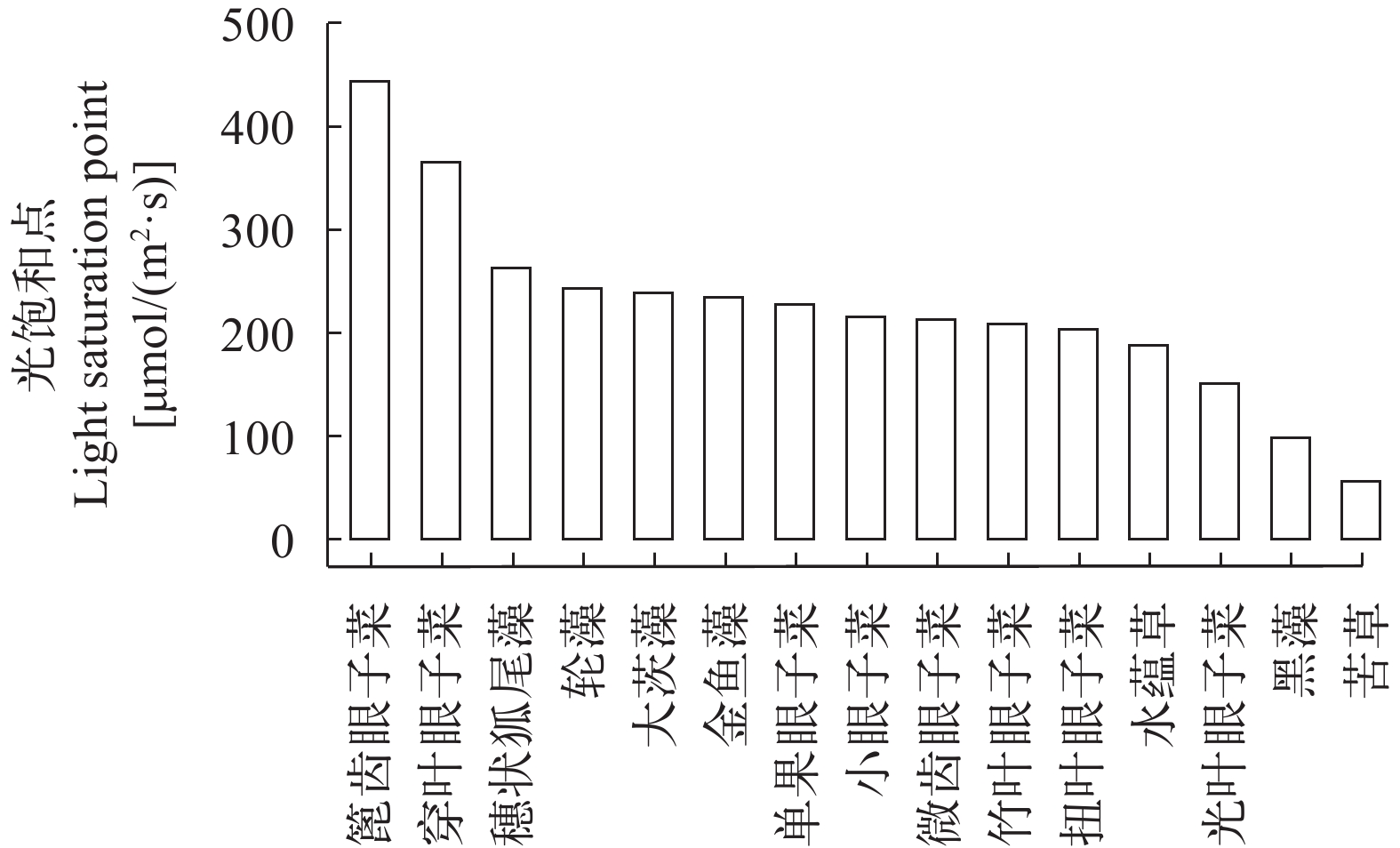
15种沉水植物光饱和点分布在55.6—441.5 μE/(m2·s)区间内, 15种沉水植物的光饱和点可以展示出明显的分区(图 5), 篦齿眼子菜与穿叶眼子菜在沉水植物中具有高光饱和点, 分别为441.5 μE/(m2·s)和364.7 μE/(m2·s); 共有11种沉水植物光饱和点集中在中光饱和点区间内, 即100—300 μE/(m2·s), 区间内的各物种间光饱和点差异不大, 区间内具体大小表现为: 穗状狐尾藻>轮藻>大茨藻>金鱼藻>单果眼子菜>小眼子菜>微齿眼子菜>竹叶眼子菜>扭叶眼子菜>水蕴草>光叶眼子菜; 黑藻与苦草具有低光饱和点, 分别为97.1和55.6 μE/(m2·s)。
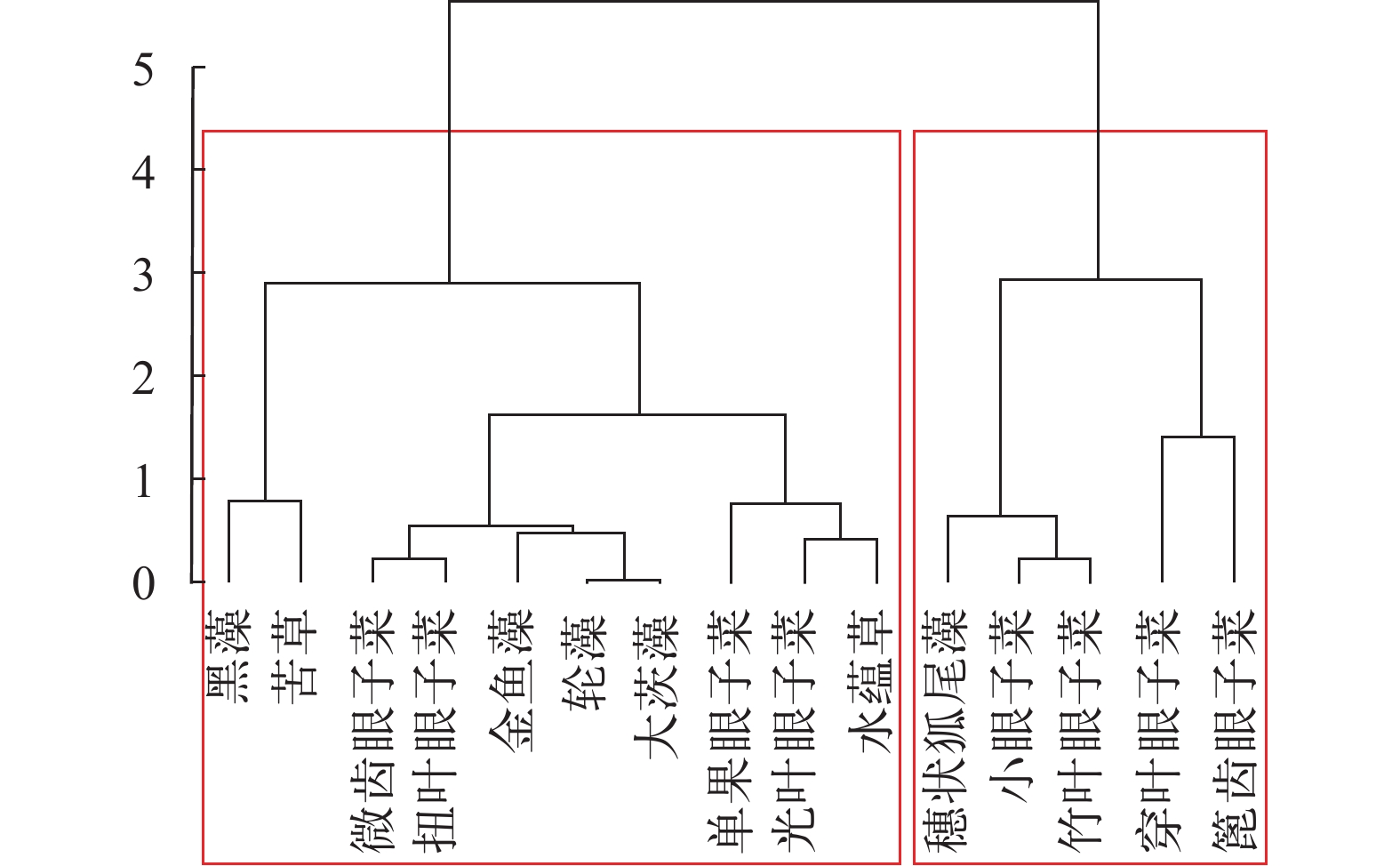
以15种沉水植物光补偿点和光饱和点为对象进行聚类分析, 可以分为2类(图 6), 第一类为穗状狐尾藻、小眼子菜、竹叶眼子菜、穿叶眼子菜与篦齿眼子菜, 这一分类中物种的特征为同时具有高光补偿点和高光饱和点, 光补偿点在44.8—63.8 μE/(m2·s), 光饱和点在441.5—206.7 μE/(m2·s); 第二类为轮藻、大茨藻、金鱼藻、微齿眼子菜、扭叶眼子菜、单果眼子菜、光叶眼子菜、水蕴草、黑藻和苦草, 该分类中所有物种光补偿点均低于第一类, 光补偿点在6.3—33.4 μE/(m2·s), 光饱和点在55.6—242.0 μE/(m2·s), 该分类中光叶眼子菜、水蕴草、黑藻和苦草存在相似性, 具有较同类别中其他6种物种较低的光饱和点, 是同时具有低光补偿点和低光饱和点的物种。
2.3 15种沉水植物最大光合速率、暗呼吸速率、光补偿点和光饱和点与分布水深的关系
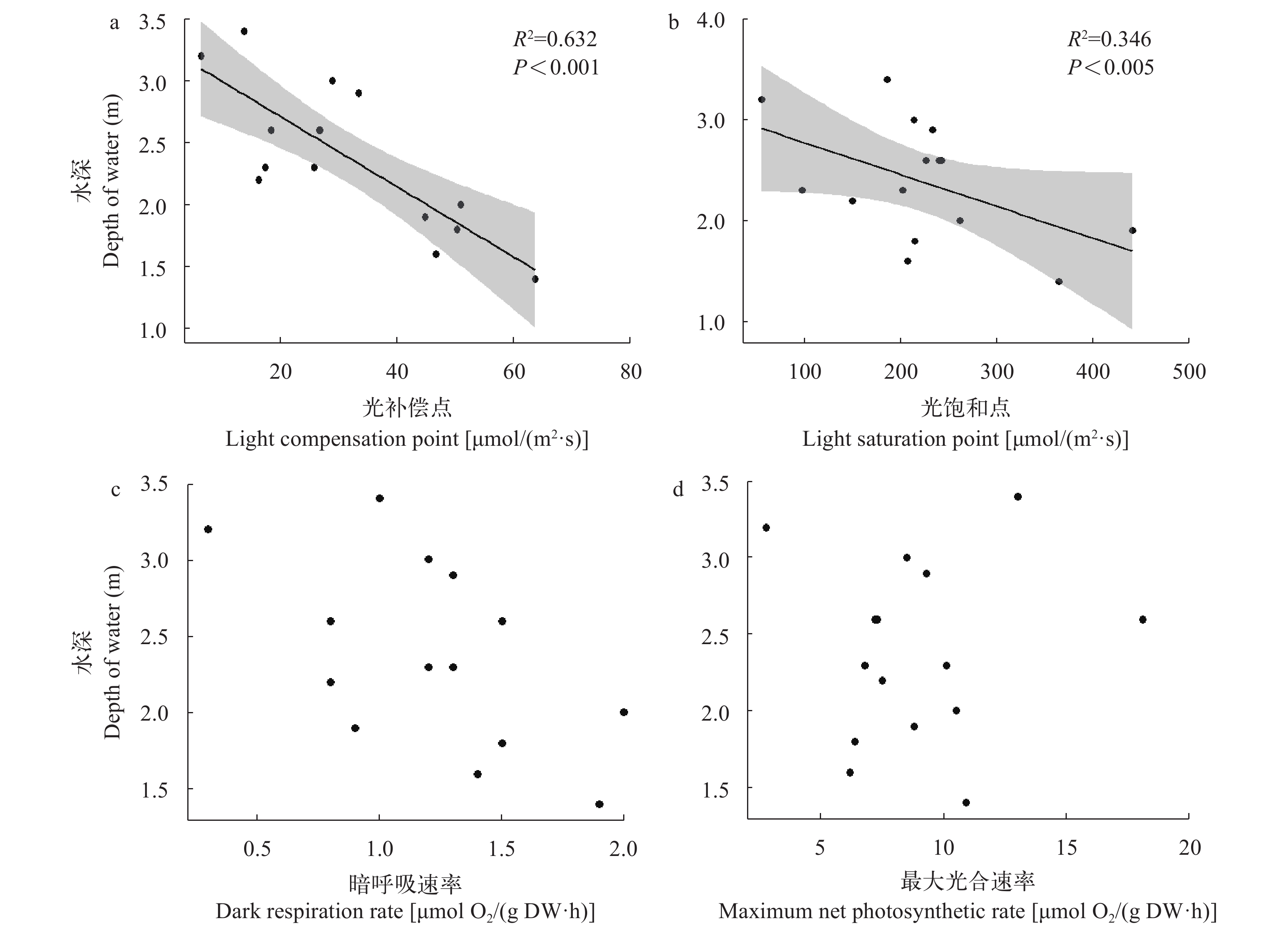
根据全湖沉水植物调查结果显示, 15种沉水植物的生长水深范围跨度较大, 微齿眼子菜、黑藻、水蕴草、轮藻分布水深为0.5—5.5 m, 金鱼藻、苦草分布水深为0.5—5.6 m, 穗状狐尾藻分布水深为0.5—5.4 m, 竹叶眼子菜分布水深为0.5—5.0 m, 大茨藻的分布水深为0.5—4.6 m, 篦齿眼子菜分布水深为0.5—4.5 m, 光叶眼子菜的分布水深为0.5—4.4 m, 小眼子菜分布水深为0.5—3.5 m, 扭叶眼子菜分布水深为1.0—4.5 m, 穿叶眼子菜分布水深为0.5—3.0 m, 单果眼子菜分布水深为1.4—3.9 m。根据回归分析结果显示, 15种沉水植物分布水深与物种光补偿点存在极显著的负相关关系(P<0.001; 图 7a), 同时, 与光饱和点呈显著负相关关系(P<0.05; 图 7b), 暗呼吸速率和最大光合速率与分布水深没有显著相关性(图 7c和图 7d)。
3. 讨论
光合作用作为沉水植物重要的代谢活动, 对沉水植物的生长活动有显著影响。本研究发现: (1)15种常见沉水植物光补偿点、光饱和点、最大净光合速率和暗呼吸速率具有物种差异性; (2)苦草同时具有最低的光补偿点6.3 μE/(m2·s)与光饱和点55.6 μE/(m2·s), 对深水与弱光环境具有较好的适应性; (3)沉水植物的分布水深与物种光补偿点、光饱和点呈显著负相关。
3.1 沉水植物光合特性比较及其影响因素
已报道的沉水植物光合作用及光合特性的测定结果中(表 1), 不同测定方法与测定条件下同一物种光合速率、呼吸速率和光补偿点的测定结果存在差异; 在同一测量条件下, 各物种间具有种间差异性, 苦草与其他物种相比具有低光补偿点, 这与本实验测定结果一致。本研究测定结果与所收集的数据相比在部分物种上具有较为明显的差异, 不同物种间也具有明显差异, 造成这些差异性的原因: 一方面, 植物具有不同的生理生化特征, 研究表明沉水植物低光合速率与植物羧化酶活性较低有关[17, 18], 在对陆生植物的研究中, 植物叶片的叶绿素含量与叶片光合能力呈正相关, 叶绿素a/b比值的改变也是陆生植物在叶绿体水平上对适应光照改变的策略[19, 20], 阴生植物的叶绿素a/b比值低于阳生植物[21], Nielsen等[22]认为因为沉水植物叶绿素含量与叶片采光能力直接相关, 与光合电子传递和羧化能力耦合, 所以叶绿素含量可以作为沉水植物叶片光合作用的主要预测因子, 对洱海4种沉水植物: 苦草、微齿眼子菜、光叶眼子菜和篦齿眼子菜叶绿素的研究中, 苦草的叶绿素a/b为2.04±0.18, 显著低于微齿眼子菜(2.36±11)、光叶眼子菜(2.27±0.17)与篦齿眼子菜(2.42±0.21)[23], 在本研究中苦草的光合速率为2.8 μmol O2/(g DW·h)显著低于微齿眼子菜[8.5 μmol O2/(g DW·h)]、光叶眼子菜[7.5 μmol O2/(g DW·h)]和篦齿眼子菜[8.8 μmol O2/(g DW·h)], 与此前研究结果一致。
表 1 国内外有关沉水植物光合参数测定结果比较Table 1. Comparison of photosynthetic parameters of submerged macrophytes物种Species 光补偿点Light
compensation point
[μE/(m2·s)]光饱和点Light
saturation point
[μE/(m2·s)]光合速率The maximum net
photosynthetic rate
[μmol O2/(g DW·h)]呼吸速率Dark
respiration rate
[μmol O2/(g DW·h)]α 黑藻H. verticillata* 17.3 97.1 6.8 1.2 0.07 苦草V.natans* 6.3 55.6 2.8 0.3 0.05 水蕴草E. densa* 13.7 186.0 13.0 1.0 0.07 微齿眼子菜P. maackianus* 28.9 213.5 8.5 1.2 0.04 光叶眼子菜P. lucens* 16.2 149.8 7.5 0.8 0.05 穿叶眼子菜P. perfoliatus* 63.8 364.7 10.9 1.9 0.03 扭叶眼子菜P. intortusifolius* 25.7 202.0 10.1 1.3 0.05 篦齿眼子菜S. pectinata* 44.8 441.5 8.8 0.9 0.02 小眼子菜P. pusillus* 50.3 214.7 6.4 1.5 0.03 单果眼子菜P. acutifolius* 18.3 226.0 18.1 1.5 0.08 竹叶眼子菜P. wrightii* 46.7 206.7 6.2 1.4 0.03 轮藻C. vulgaris* 26.7 242.0 7.3 0.8 0.03 大茨藻N. marina* 26.6 239.7 7.2 0.8 0.03 穗状狐尾藻M. spicatum* 51.0 261.8 10.5 2.0 0.04 金鱼藻C. demersum* 33.4 233.3 9.3 1.3 0.04 黑藻H. verticillata[42] 28.9 10.09 2.85 狐尾藻M. spicatum[42] 21.6 9.65 6.73 金鱼藻C. demersum[42] 20.5 2.57 1.07 狐尾藻M. spicatum[43] 27.5 14.84 1.78 金鱼藻C. demersum[43] 24.4 16.56 1.23 菹草[43] 20 14.41 0.54 黑藻H. verticillata[43] 15.8 16.43 3.06 苦草V. natans[43] 9.4 8.79 0.85 菹草P. crispus 4℃[32] 3.51 菹草15℃[32] 7.164 菹草20℃[32] 10.44 苦草V. natans 4℃[32] 1.044 苦草15℃[32] 1.91 苦草20℃[32] 5.11 苦草30℃[32] 7.61 狐尾藻M. spicatum 4℃[32] 4.19 狐尾藻15℃[32] 7.63 狐尾藻20℃[32] 11.84 金鱼藻C. demersum 4℃[32] 6.75 金鱼藻15℃[32] 12.13 金鱼藻20℃[32] 20.66 金鱼藻30℃[32] 32.44 大茨藻N. marina 4℃[32] 3.58 大茨藻15℃[32] 6.21 大茨藻15℃[32] 6.21 大茨藻20℃[32] 8.208 竹叶眼子菜[2]P. wrightii 6.12 1.94 竹叶眼子菜[2] 9.33 2.24 微齿眼子菜[2]P. maackianus 6.42 2.2 微齿眼子菜[2] 6.42 2.11 穗状狐尾藻M. spicatum[2] 3.2 3.4 穗状狐尾藻[2] 5.05 1.49 菹草P. crispus[2] 4.04 1.59 菹草[2] 3.92 1.35 黑藻H. verticillata[2] 2.85 0.95 黑藻[2] 0.91 0.95 金鱼藻C. demersum[2] 1.36 1.31 金鱼藻[2] 2.30 0.70 苦草V. natans[2] 2.00 0.63 苦草[2] 2.73 0.82 篦齿眼子菜S. pectinata[44] 6.99 3.86 黑藻H. verticillata[17] 93.15 金鱼藻C. demersum[17] 1.74 狐尾藻M. spicatum[17] 23.5 穿叶眼子菜P. perfoliatus[7] 22.1 123 450 57.81 狐尾藻M. spicatum[7] 34.5 134 290.63 53.12 美洲苦草V. americana[7] 30.4 178.8 343.75 53.13 穗状狐尾藻M. spicatum[45] 36.8 禾叶眼子菜P. gramineus[45] 21.9 白茎眼子菜P. praelongus[45] 12.7 美洲苦草V. americana[45] 9.9 E. canadensis[45] 11.9 P. amplifolius[45] 12.4 P. robbinsii[45] 20 注: *为本研究测定数值; [ ]为参考文献数值Note: * reprents the value measured in this study; [ ] reprents the reference value 光照、温度等环境因子也是影响沉水植物光合作用的重要因素, 水深对水下光照强度、光质和温度有着明显影响。随着水深增加, 光照强度明显降低, 对沉水植物光合作用的影响主要体现在对叶片光合色素的改变, 在陆生植物的研究中, 植物叶片的叶绿素a/b值和类胡萝卜素/叶绿素值会随着光照强度减弱而降低, 通过提高叶绿素b的含量来增加光能的捕获量[24, 25]。在沉水植物的研究中苦草同样显示出这一适应策略, 叶绿素a/b值和类胡萝卜素/叶绿素值随着水深的增加而降低[23, 26]。春夏季, 水面与浅水区的高光照强度引起光抑制现象, 沉水植物的光化学最大产量(Fv/Fm)和有效荧光产量(ΔF
v′/Fm′)显著降低, 光合作用减弱, 大部分的光抑制现象更多是沉水植物自身应对强光的保护机制, 而不是植株叶片PSⅡ反应中心受到光破坏的体现[27]。水深的改变会导致水下光谱特征的改变, 随着水深梯度的增加, 各波段光照显著衰减, 红蓝光比值增加[28]。研究发现, 在同一光强条件下, 不同的光质对苦草幼苗光合色素含量和叶片叶绿素荧光参数具有显著影响, 因此, 导致不同植株叶片光合作用能力存在差异[29]。水体温度影响沉水植物代谢过程, 从而影响光合作用 [30, 31], 温度对光合速率的影响在不同的沉水植物中都有发现, 如表 1中, 菹草、穗状狐尾藻、金鱼藻、大茨藻和苦草的光补偿点在温度4—30℃内随着温度的升高而增大[32]。在周红等[33]的研究中, 轮藻、红线草(Potamogeton pectinateus)和黑藻15℃下的白昼光补偿点低于25℃下所测定的光补偿点, 其中轮藻25℃下的光补偿点高出近50%。在国外的科研人员研究中, 篦齿眼子菜光合速率在10—35℃内, 随着温度升高而增大, 在10℃时测定的最大净光合速率是最适温度时的63%[34]。埃格草(Egeria densa)和黑藻的净光合速率在温度16—32℃内随着温度的升高先增大后降低, 最适温度为24℃[35], 温度同样能影响沉水植物光补偿点。 在本研究中, 不同物种在高光照强度下光反应拟合曲线的初始斜率不同, 初始斜率越大, 光反应拟合曲线越陡, 表示随着光照强度从零开始增加, 植物净光合作用的增长越快。这种光反应拟合曲线的攀升可以认为是判断植物在光照强度满足其达到最大光合速率条件下, 植物光合作用接近饱和的速度快慢的依据。在Harley等[7]的研究中, 美洲苦草(Vallisneria americana)光拟合曲线初始斜率高于穿叶眼子菜和穗状狐尾藻, 在相同光照条件下, 美洲苦草相较于另外两个物种会更快到达最大光合速率更具有竞争优势。本研究中穿叶眼子菜与穗状狐尾藻α较低, 与美洲苦草同属的苦草具有高于穿叶眼子菜与穗状狐尾藻的α, 与此前研究结果一致。
3.2 沉水植物光合参数与分布水深的关系
在本研究中, 沉水植物光饱和点和光补偿点对沉水植物的分布水深呈显著负相关, 即随着光饱和点与光补偿点越小物种的分布水深越深, 这与我们之前的假设一致。沉水植物光补偿点是光合作用产生有机物与呼吸作用消耗有机物互相平衡时的光照强度, 沉水植物光饱和点是沉水植物光合速率达到最大时的光照强度, 这两个光合特性是预测沉水植物在水下弱光环境中是否能生长的理论基础。苦草具有最小的光补偿点与光饱和点, 表明其相较于其他物种在弱光环境下能更好地萌发与生长, 在洱海全湖沉水植物调查结果中, 苦草分布水生为0.5—5.6 m, 较其他沉水植物有更广的分布水深范围, 这与分析结果一致。在透明度较好的水体中, 苦草在5—6 m水深处仍能良好生长, 这与沉水植物对弱光环境的适应性研究中, 苦草较竹叶眼子菜、穗状狐尾藻和黑藻更能适应水下弱光环境结论一致[36], 穗状狐尾藻、穿叶眼子菜、小眼子菜和竹叶眼子菜光饱和点和光补偿点较高, 适合生长在水体上层1—3 m, 水蕴草、光叶眼子菜、黑藻、单果眼子菜、扭叶眼子菜、轮藻和大茨藻等介于两者之间, 适合生长在中下层水体, 即3—5 m位置。在野外调查结果中, 穗状狐尾藻和竹叶眼子菜分布的最大水深分别可达5.4与5.0 m, 其高光补偿点与高光饱和点的特性没有限制物种仅能在浅水区分布, 推测其原因可能是沉水植物为应对水下弱光条件, 采取了不同的适应策略。光照环境的改变会导致沉水植物在光合作用特性与形态特性两种策略下进行权衡[37], 冠层型物种应对弱光胁迫时, 倾向于茎伸长以获得上层或表层水体的光照[38]。苦草作为典型的莲座型沉水植物, 无法有效通过伸长株高来获取更多光能, 对弱光的适应策略偏向于改变其光合作用特性[26]。
沉水植物在弱光环境下的生长状况是修复工程中值得关注的问题, 沉水植物光补偿深度是依据沉水植物光补偿点与水体光照条件所得出的沉水植物能够生长的最大水深[39]。不同的湖泊, 不同的水体环境下沉水植物的光补偿深度不同, 沉水植物及不同群落光补偿深度与水体透明度显著相关[40, 41], 仅仅关注沉水植物的光补偿点是不够的。在本研究中, 沉水植物光饱和点与沉水植物分布水深显著相关, 在达到沉水植物光饱和点条件下, 沉水植物生产力达到最大, 生物量积累最快。所以在沉水植被修复中, 为了提高目标物种的存活率与生物量可以以沉水植物的光补偿点与光饱和点作为依据, 结合实际水体透明度情况, 设计沉水植物种植深度, 保证沉水植物正常生长与群落稳定。水下弱光环境抑制沉水植物的生长, 为沉水植被修复带来阻碍。通过实验室对沉水植物光合特性测定结果与野外湖泊沉水植物实际分布相结合, 苦草在弱光胁迫条件下具有最强的适应性, 黑藻、水蕴草和光叶眼子菜次之。因此, 在沉水植被修复工程中, 我们优先推荐苦草作为恢复先锋物种。改善湖泊生境, 再根据不同的水深与水下光照条件引入新物种, 增加湖泊中沉水植物的物种多样性。
-
表 1 国内外有关沉水植物光合参数测定结果比较
Table 1 Comparison of photosynthetic parameters of submerged macrophytes
物种Species 光补偿点Light
compensation point
[μE/(m2·s)]光饱和点Light
saturation point
[μE/(m2·s)]光合速率The maximum net
photosynthetic rate
[μmol O2/(g DW·h)]呼吸速率Dark
respiration rate
[μmol O2/(g DW·h)]α 黑藻H. verticillata* 17.3 97.1 6.8 1.2 0.07 苦草V.natans* 6.3 55.6 2.8 0.3 0.05 水蕴草E. densa* 13.7 186.0 13.0 1.0 0.07 微齿眼子菜P. maackianus* 28.9 213.5 8.5 1.2 0.04 光叶眼子菜P. lucens* 16.2 149.8 7.5 0.8 0.05 穿叶眼子菜P. perfoliatus* 63.8 364.7 10.9 1.9 0.03 扭叶眼子菜P. intortusifolius* 25.7 202.0 10.1 1.3 0.05 篦齿眼子菜S. pectinata* 44.8 441.5 8.8 0.9 0.02 小眼子菜P. pusillus* 50.3 214.7 6.4 1.5 0.03 单果眼子菜P. acutifolius* 18.3 226.0 18.1 1.5 0.08 竹叶眼子菜P. wrightii* 46.7 206.7 6.2 1.4 0.03 轮藻C. vulgaris* 26.7 242.0 7.3 0.8 0.03 大茨藻N. marina* 26.6 239.7 7.2 0.8 0.03 穗状狐尾藻M. spicatum* 51.0 261.8 10.5 2.0 0.04 金鱼藻C. demersum* 33.4 233.3 9.3 1.3 0.04 黑藻H. verticillata[42] 28.9 10.09 2.85 狐尾藻M. spicatum[42] 21.6 9.65 6.73 金鱼藻C. demersum[42] 20.5 2.57 1.07 狐尾藻M. spicatum[43] 27.5 14.84 1.78 金鱼藻C. demersum[43] 24.4 16.56 1.23 菹草[43] 20 14.41 0.54 黑藻H. verticillata[43] 15.8 16.43 3.06 苦草V. natans[43] 9.4 8.79 0.85 菹草P. crispus 4℃[32] 3.51 菹草15℃[32] 7.164 菹草20℃[32] 10.44 苦草V. natans 4℃[32] 1.044 苦草15℃[32] 1.91 苦草20℃[32] 5.11 苦草30℃[32] 7.61 狐尾藻M. spicatum 4℃[32] 4.19 狐尾藻15℃[32] 7.63 狐尾藻20℃[32] 11.84 金鱼藻C. demersum 4℃[32] 6.75 金鱼藻15℃[32] 12.13 金鱼藻20℃[32] 20.66 金鱼藻30℃[32] 32.44 大茨藻N. marina 4℃[32] 3.58 大茨藻15℃[32] 6.21 大茨藻15℃[32] 6.21 大茨藻20℃[32] 8.208 竹叶眼子菜[2]P. wrightii 6.12 1.94 竹叶眼子菜[2] 9.33 2.24 微齿眼子菜[2]P. maackianus 6.42 2.2 微齿眼子菜[2] 6.42 2.11 穗状狐尾藻M. spicatum[2] 3.2 3.4 穗状狐尾藻[2] 5.05 1.49 菹草P. crispus[2] 4.04 1.59 菹草[2] 3.92 1.35 黑藻H. verticillata[2] 2.85 0.95 黑藻[2] 0.91 0.95 金鱼藻C. demersum[2] 1.36 1.31 金鱼藻[2] 2.30 0.70 苦草V. natans[2] 2.00 0.63 苦草[2] 2.73 0.82 篦齿眼子菜S. pectinata[44] 6.99 3.86 黑藻H. verticillata[17] 93.15 金鱼藻C. demersum[17] 1.74 狐尾藻M. spicatum[17] 23.5 穿叶眼子菜P. perfoliatus[7] 22.1 123 450 57.81 狐尾藻M. spicatum[7] 34.5 134 290.63 53.12 美洲苦草V. americana[7] 30.4 178.8 343.75 53.13 穗状狐尾藻M. spicatum[45] 36.8 禾叶眼子菜P. gramineus[45] 21.9 白茎眼子菜P. praelongus[45] 12.7 美洲苦草V. americana[45] 9.9 E. canadensis[45] 11.9 P. amplifolius[45] 12.4 P. robbinsii[45] 20 注: *为本研究测定数值; [ ]为参考文献数值Note: * reprents the value measured in this study; [ ] reprents the reference value -
[1] Richards P W, Sculthorpe C D. The biology of aquatic vascular plants [J]. Journal of Ecology, 1968, 56(3): 915. doi: 10.2307/2258117
[2] 陈洪达. 11种沉水植物的生产力 [J]. 海洋与湖沼, 1988, 19(6): 525-531. Chen H D. Productivity of eleven species of submerged macrophytes [J]. Oceanologia et Limnologia Sinica, 1988, 19(6): 525-531.
[3] Ren W, Wen Z, Cao Y, et al. Cascading effects of benthic fish impede reinstatement of clear water conditions in lakes: A mesocosm study [J]. Journal of Environmental Management, 2022(301): 113898. doi: 10.1016/j.jenvman.2021.113898
[4] Hilt S, Brothers S, Jeppesen E, et al. Translating regime shifts in shallow lakes into changes in ecosystem functions and services [J]. Bioscience, 2017, 67(10): 928-936. doi: 10.1093/biosci/bix106
[5] Sand-Jensen K. Environmental variables and their effect on photosynthesis of aquatic plant communities [J]. Aquatic Botany, 1989, 34(1/2/3): 5-25.
[6] Zervas D, Tsiaoussi V, Kallimanis A S, et al. Exploring the relationships between aquatic macrophyte functional traits and anthropogenic pressures in freshwater lakes [J]. Acta Oecologica, 2019(99): 103443. doi: 10.1016/j.actao.2019.103443
[7] Harley M T, Findlay S. Photosynthesis-irradiance relationships for three species of submersed macrophytes in the tidal freshwater Hudson River [J]. Estuaries, 1994, 17(1): 200-205. doi: 10.2307/1352569
[8] Henley W J. Measurement and interpretation of photosynthetic light-response curves in algae in the context of photoinhibition and diel changes [J]. Journal of Phycology, 1993, 29(6): 729-739. doi: 10.1111/j.0022-3646.1993.00729.x
[9] Valladares F, Niinemets Ü. Shade tolerance, a key plant feature of complex nature and consequences [J]. Annual Review of Ecology, Evolution, and Systematics, 2008(39): 237-257. doi: 10.1146/annurev.ecolsys.39.110707.173506
[10] Phillips G L, Eminson D, Moss B. A mechanism to account for macrophyte decline in progressively eutrophicated freshwaters [J]. Aquatic Botany, 1978(4): 103-126. doi: 10.1016/0304-3770(78)90012-8
[11] Cao T, Ni L, Xie P, et al. Effects of moderate ammonium enrichment on three submersed macrophytes under contrasting light availability [J]. Freshwater Biology, 2011, 56(8): 1620-1629. doi: 10.1111/j.1365-2427.2011.02601.x
[12] 郭雅倩, 薛建辉, 吴永波, 等. 沉水植物对富营养化水体的净化作用及修复技术研究进展 [J]. 植物资源与环境学报, 2020, 29(3): 58-68. doi: 10.3969/j.issn.1674-7895.2020.03.08 Guo Y Q, Xue J H, Wu Y B, et al. Research progress on purification effects and restoration technologies of submerged macrophytes on eutrophic water [J]. Journal of Plant Resources and Environment, 2020, 29(3): 58-68. doi: 10.3969/j.issn.1674-7895.2020.03.08
[13] Liu Y, Li Y, Li W, et al. Is there a maximum length of strap-like leaves for submerged angiosperms [J]? Aquatic Botany, 2019(161): 103184.
[14] 鄢文皓, 王会会, 李前正, 等. 影响沉水植物恢复的环境阈值研究进展 [J]. 生态科学, 2020, 39(5): 240-247. doi: 10.14108/j.cnki.1008-8873.2020.05.029 Yan W H, Wang H H, Li Q Z, et al. Research progress on environmental thresholds affecting the restoration of submerged macrophytes [J]. Ecological Science, 2020, 39(5): 240-247. doi: 10.14108/j.cnki.1008-8873.2020.05.029
[15] 梁雪, 贺锋, 徐栋, 等. 人工湿地植物的功能与选择 [J]. 水生态学杂志, 2012, 33(1): 131-138. doi: 10.15928/j.1674-3075.2012.01.009 Liang X, He F, Xu D, et al. Plant function and selection for constructed wetlands [J]. Journal of Hydroecology, 2012, 33(1): 131-138. doi: 10.15928/j.1674-3075.2012.01.009
[16] 王圣瑞, 年跃刚, 侯文华, 等. 人工湿地植物的选择 [J]. 湖泊科学, 2004, 16(1): 91-96. doi: 10.3321/j.issn:1003-5427.2004.01.015 Wang S R, Nian Y G, Hou W H, et al. Macrophyte selection in artificial wetlands [J]. Journal of Lake Sciences, 2004, 16(1): 91-96. doi: 10.3321/j.issn:1003-5427.2004.01.015
[17] Van T K, Haller W T, Bowes G. Comparison of the photosynthetic characteristics of three submersed aquatic plants [J]. Plant Physiology, 1976, 58(6): 761-768. doi: 10.1104/pp.58.6.761
[18] Li P, Liao Z, Zhou J, et al. Bicarbonate-use by aquatic macrophytes allows a reduction in photorespiration at low CO2 concentrations [J]. Environmental And Experimental Botany, 2021(188): 104520. doi: 10.1016/j.envexpbot.2021.104520
[19] Murchie E H, Horton P. Acclimation of photosynthesis to irradiance and spectral quality in British plant species: chlorophyll content, photosynthetic capacity and habitat preference [J]. Plant, Cell and Environment, 1997, 20(4): 438-448. doi: 10.1046/j.1365-3040.1997.d01-95.x
[20] Morales A, Kaiser E. Photosynthetic Acclimation to Fluctuating Irradiance in Plants [J]. Frontiers in Plant Science, 2020, 11(268): 1-12.
[21] Johnson G N, Scholes J D, Horton P, et al. Relationships between carotenoid composition and growth habit in British plant species [J]. Plant, Cell and Environment, 1993, 16(6): 681-686. doi: 10.1111/j.1365-3040.1993.tb00486.x
[22] Nielsen S L, Sand-jensen K. Regulation of photosynthetic rates of submerged rooted macrophytes [J]. Oecologia, 1989, 81(3): 364-368. doi: 10.1007/BF00377085
[23] 何亮, 陈晓希, 李威, 等. 洱海4种沉水植物叶片的光合色素组成及C、N、P化学计量特征对水深的响应 [J]. 湖泊科学, 2018, 30(5): 1413-1419. doi: 10.18307/2018.0522 He L, Chen X X, Li W, et al. Leaf carbon, nitrogen and phosphorus stoichiometric characteristics and photosynthetic pigments composition of four submerged macrophytes in response to various water depth in Lake Erhai, China [J]. Journal of Lake Sciences, 2018, 30(5): 1413-1419. doi: 10.18307/2018.0522
[24] 苏睿丽, 李伟. 沉水植物光合作用的特点与研究进展 [J]. 植物学通报, 2005, 40(S1): 128-138. Su R L, Li W. Advances in research on photosynthesis of submerged macrophytes [J]. Chinese Bulletin of Botany, 2005, 40(S1): 128-138.
[25] 孙小玲, 许岳飞, 马鲁沂, 等. 植株叶片的光合色素构成对遮阴的响应 [J]. 植物生态学报, 2010, 34(8): 989-999. doi: 10.3773/j.issn.1005-264x.2010.08.012 Sun X L, Xu Y F, Ma L Y, et al. A review of acclimation of photosynthetic pigment composition in plant leaves to shade environment [J]. Chinese Journal of Plant Ecology, 2010, 34(8): 989-999. doi: 10.3773/j.issn.1005-264x.2010.08.012
[26] Chen J, Cao T, Zhang X, et al. Differential photosynthetic and morphological adaptations to low light affect depth distribution of two submersed macrophytes in lakes [J]. Scientific Reports, 2016(6): 1-9. doi: 10.1038/s41598-016-0001-8
[27] 李强. 环境因子对沉水植物生长发育的影响机制 [D]. 南京: 南京师范大学, 2007. Li Q. Influence mechanism of environment factors on the growth and development of submerged macrophytes [D]. Nanjing: Nanjing Normal University, 2007.
[28] Liu H, Zhou W, Li X, et al. How many submerged macrophyte species are needed to improve water clarity and quality in Yangtze floodplain lakes [J]? Science of The Total Environment, 2020, 724(138267): 1-10.
[29] Wang Y, Chen X, Liu J, et al. Greater performance of exotic elodea nuttallii in response to water level may make it a better invader than exotic egeria densa during winter and spring [J]. Frontiers in Plant Science, 2019, 10(144): 1-9.
[30] Ersoy Z, Scharfenberger U, Baho D L, et al. Impact of nutrients and water level changes on submerged macrophytes along a temperature gradient: A pan-European mesocosm experiment [J]. Global Change Biology, 2020, 26(12): 6831-6851. doi: 10.1111/gcb.15338
[31] 潘国权. 水下光质对菹草和苦草生长的影响 [D]. 南京: 南京师范大学, 2008. Pan G Q. Effect of underwater light quality on growth of Potamageton crispus and Vallisneria natans [D]. Nanjing: Nanjing Normal University, 2008.
[32] 任南, 严国安, 马剑敏, 等. 环境因子对东湖几种沉水植物生理的影响研究 [J]. 武汉大学学报(自然科学版), 1996, 42(2): 213-218. Ren N, Yan G A, Ma J M, et al. The study on the influence of environmental factors of the sumberged macrophytes in the east lake [J]. Wuhan University Journal (Natural Science Edition), 1996, 42(2): 213-218.
[33] 周红, 任久长, 蔡晓明. 沉水植物昼夜光补偿点及其测定 [J]. 环境科学学报, 1997, 17(2): 256-258. doi: 10.3321/j.issn:0253-2468.1997.02.023 Zhou H, Ren J C, Cai X M. The concept and measurement of diurnal light compensation point of submerged macrophyte [J]. Acta Scientiae Circumstantiae, 1997, 17(2): 256-258. doi: 10.3321/j.issn:0253-2468.1997.02.023
[34] Madsen J D, Adams M S. The light and temperature dependence of photosynthesis and respiration in Potamogeton pectinatus L [J]. Aquatic Botany, 1989, 36(1): 23-31. doi: 10.1016/0304-3770(89)90088-0
[35] Barko J W, Smart R M. Comparative influences of light and temperature on the growth and metabolism of selected submersed freshwater macrophytes [J]. Ecological Monographs, 1981, 51(2): 219-236. doi: 10.2307/2937264
[36] 张忠海, 杨桐, 王昊, 等. 洱海四种沉水植物对弱光环境的适应性比较 [J]. 湖泊科学, 2021, 33(4): 1196-1208. doi: 10.18307/2021.0418 Zhang Z H, Yang T, Wang H, et al. Comparative study on the adaptability of four submerged macrophytes to low light environment in Lake Erhai [J]. Journal of Lake Sciences, 2021, 33(4): 1196-1208. doi: 10.18307/2021.0418
[37] Arthaud F, Toury J, Romestaing C, et al. Photosynthetic and morphological traits control aquatic plant distribution according to light stress [J]. Evolutionary Ecology, 2021, 35(5-6): 739-760. doi: 10.1007/s10682-021-10134-9
[38] Binzer T, Middelboe S. Community photosynthesis of aquatic macrophytes [J]. Limnology & Oceanography, 2006, 51(6): 2722-2733.
[39] 王韶华, 赵德锋, 廖日红. 关于北京后海水体光照强度及沉水植物光补偿深度的研究 [J]. 水处理技术, 2006, 32(6): 31-33. doi: 10.3969/j.issn.1000-3770.2006.06.008 Wang S H, Zhao D F, Liao R H. Research on water body illuminance and compensation depth of submerged macrophyte in lake [J]. Technology of Water Treatment, 2006, 32(6): 31-33. doi: 10.3969/j.issn.1000-3770.2006.06.008
[40] 王书航, 李佳璐, 姜霞, 等. 基于光补偿深度的蠡湖沉水植物恢复区划分 [J]. 环境科学研究, 2015, 28(9): 1389-1396. doi: 10.13198/j.issn.1001-6929.2015.09.08 Wang S H, Li J L, Jiang X, et al. Division of submerged aquatic vegetation restoration region in Lihu Lake based on light compensation depth [J]. Research of Environmental Sciences, 2015, 28(9): 1389-1396. doi: 10.13198/j.issn.1001-6929.2015.09.08
[41] 严俊, 王颖, 王一博, 等. 基于光补偿深度的白洋淀沉水植物修复技术 [J]. 环境工程学报, 2020, 14(10): 2853-2865. doi: 10.12030/j.cjee.201911096 Yan J, Wang Y, Wang Y B, et al. Remediation technology of submerged plants in Baiyangdian Lake based on light compensation depth [J]. Chinese Journal of Environmental Engineering, 2020, 14(10): 2853-2865. doi: 10.12030/j.cjee.201911096
[42] 欧阳坤. 沉水植物逆境生理及其净化作用研究 [D]. 长沙: 中南林业科技大学, 2007. Ouyang K. Studies on physiological reactions in adverse circumstances of submerged plants and their purifying functions [D]. Changsha: Central South University of Forestry & Technology, 2007.
[43] 苏文华, 张光飞, 张云孙, 等. 5种沉水植物的光合特征 [J]. 水生生物学报, 2004, 28(4): 391-395. doi: 10.3321/j.issn:1000-3207.2004.04.010 Su W H, Zhang G F, Zhang Y S, et al. The photosynthetic characteristics of five submerged aquatic plants [J]. Acta Hydrobiologica Sinica, 2004, 28(4): 391-395. doi: 10.3321/j.issn:1000-3207.2004.04.010
[44] 陈开宁, 强胜, 李文朝. 蓖齿眼子菜的光合速率及影响因素 [J]. 湖泊科学, 2002, 14(4): 357-362. doi: 10.3321/j.issn:1003-5427.2002.04.010 Chen K N, Qang S, Li W C. Photosynthetic rate in Potamogeton pectinatus L. and factors of influence [J]. Journal of Lake Science, 2002, 14(4): 357-362. doi: 10.3321/j.issn:1003-5427.2002.04.010
[45] Madsen J D, Hartleb C F, Boylen C W. Photosynthetic characteristics of Myriophyllum spicatum and six submersed aquatic macrophyte species native to Lake George, New York [J]. Freshwater Biology, 1991, 26(2): 233-240. doi: 10.1111/j.1365-2427.1991.tb01732.x
-
期刊类型引用(5)
1. 贺诗文,张运林,李娜,罗菊花. 中营养湖泊(四川邛海)偶发性藻类水华遥感提取及原因初探. 湖泊科学. 2025(02): 389-400 .  百度学术
百度学术
2. 李华歆,殷春雨,杨国梁,蔡颖,黄晓龙,李宽意,关保华. 不同功能型沉水植物对溶解氧影响及环境效应. 水生生物学报. 2024(02): 232-241 .  本站查看
本站查看
3. 倪子怡,许海,詹旭,程新良,王裕成,朱广伟,朱梦圆,邹伟,孙起亮. 东南丘陵山区深水水库两种浮床植物脱氮效率对比研究. 湖泊科学. 2024(01): 123-136 .  百度学术
百度学术
4. 邓素炎,郭雯,温雯雯,王明果,黄林培,陈子栋,陈光杰,赵帅营. 水体富营养化及物种入侵对星云湖食物网的影响. 中国环境科学. 2024(02): 932-943 .  百度学术
百度学术
5. 陈金友,吴雪,顾东清,杨晨,许桂俊,李国峰,鲍恩财. 光伏渔业系统中水产光照偏好性与遮阴对生态渔业影响的研究进展与展望. 新能源科技. 2023(01): 61-66 .  百度学术
百度学术
其他类型引用(4)



 下载:
下载: