FEEDING LIVE BAIT AND FEED ON THE PEPTIDASE ACTIVITY, TRANSPORT AND ABSORPTION OF SMALL PEPTIDES IN JUVENILE MANDARIN FISH
-
摘要:
以初始体重(6.77±0.64) g的鳜(Siniperca chuatsi)为实验对象, 从消化道肠肽酶活力和小肽转运吸收方面比较研究鳜对活饵与饲料消化吸收能力的差异。实验采用3种分组投食策略, 将鳜分活饵组(仅投喂活饵鱼)、饲料组(仅投喂饲料)、复投活饵组(以下简称复投组, 先投喂饲料后活饵鱼)。活饵组、饲料组分别饲养22d, 复投组经5d驯饲、15d饲料和2d活饵喂养。饲养结束时在各组进食0.5h、1h、2h、3h、6h、12h、16h时分别取样肠和幽门盲囊, 测定氨肽酶和羧肽酶含量与活力, 小肽转运载体基因Pept1a、Pept1b和Pept2 mRNA表达水平, 及进食12h后肠内容物及粪便中残余小肽含量。结果表明: 各组羧肽酶、氨肽酶含量变化无显著性规律, 酶活力总体呈先升后降趋势; 活饵组肽酶活力峰值显著高于复投组高于饲料组(P<0.01), 复投组由饲料转喂活饵后, 肠道肠肽酶活力显著上升; 各组前肠、中肠及幽门盲囊Pept1a、Pept1b mRNA表达显著高于后肠(P<0.01), 后肠则以Pept2 mRNA高表达(P<0.01)。在复投组摄食活饵后, 小肽转运载体基因表达水平较饲料组迅速回升(P<0.01); 摄食12h, 复投组肠内容物小肽含量显著高于活饵组和饲料组, 小肽吸收效率随消化时间延长而上升。饲料组粪便中小肽含量显著高于活饵组与复投组, 未转运的小肽中含必需氨基酸居高。综上所述, 投喂鳜配合饲料, 对肠肽酶活力、小肽转运载体基因表达和小肽吸收速率均产生不利影响, 鳜对饲料蛋白的分解和小肽转运吸收效率显著低于活饵鱼。
Abstract:In this study, we examined Siniperca chuatsi with an initial weight of (6.77±0.64) g to explore the difference of digestive and absorption ability between live bait and feed from the aspects of digestive tract peptidase activity and small peptide transport and absorption. Overall, fish were divided into three groups by random: live bait group (the following group was fed with live bait only for 22d), feeding group (the following group was fed with feed only for 22d) and re-feeding group (the following group was fed with 5d of domestication, 15d of feed and 2d of live bait). At 22d post feeding, the isolated intestinal and pyloric caecum sampled at 0.5h, 1h, 2h, 3h, 6h, 12h and 16h after eating were used to measure activities of aminopeptidase and carboxypeptidase and gene expression of mall peptide transport vector genes: Pept1a, Pept1b and Pept2. Besides, the content of residual small peptides in intestinal contents and feces 12h after eating were measured. The results showed that there was no significant change in the contents of carboxypeptidase and aminopeptidase in each group, and the enzyme activity increased first and then decreased; The peak value of peptidase activity in the live bait group was significantly higher than that in the re-feeding group (P<0.01); In foregut, midgut and pyloric caecum, the mRNA expression of Pept1a and Pept1b was significantly higher while that of Pept2 was comparatively lower than those in hindgut (P<0.01); After feeding live bait, the gene expression level of small peptide transport vector in the re-feeding group increased rapidly compared with that in the feed group (P<0.01); At 12h post feeding, the content of small peptides in intestinal contents in the re-feeding group was significantly higher than that in the live bait group and feed group, and the absorption efficiency of small peptides increased with the extension of digestion time. However, the content of small peptides in feces of feed group was significantly higher than that of live bait group and re-feeding group, and the content of essential amino acids in small peptides not transported was higher. In conclusion, feeding S. chuatsi compound feed has adverse effects on the activity of intestinal peptidase, small peptide transporter gene expression and small peptide absorption rate. The decomposition of protein and the efficiency of small peptide transport and absorption of mandarin fish which intake artificial feed are significantly lower than those that intake live bait.
-
Keywords:
- Live bait /
- Feedstuff feeding /
- Intestinal peptidase /
- Small peptide /
- Transport and absorption /
- Siniperca chuatsi
-
在消化过程中, 膳食蛋白经胃蛋白酶、胰蛋白酶等初步分解后, 再经肠肽酶水解, 使肠腔产生高水平的短链肽(二肽和三肽)。部分短肽继续水解为游离氨基酸被吸收, 部分短肽则以完整的形式通过基底外侧转运系统直接转运吸收到肠上皮细胞中[1], 相比游离氨基酸的吸收, 小肽转运具有速度快、低耗能、逆浓度吸收、不易饱和和无吸收位点竞争等特点[2]; 鱼类小肽的转运过程与哺乳动物基本相似: (1)通过低亲和力、高容量的转运载体(Pept1)识别、结合肽; (2)通过高亲和力、低容量的基底膜转运载体(Pept2)把完整的肽转运进入血液[3]。目前在鱼类中已发现Pept1的两类功能相似的亚型Pept1a与Pept1b[4]。
鳜( Siniperca chuatsi )作为典型肉食性鱼类, 对饵料蛋白需求较高, 特具适宜高蛋白饵料消化的消化道与消化酶[5]。在自然条件下, 鳜以摄食活饵鱼为主, 目前经人工驯食, 可成功摄食配合饲料。在养殖过程中发现, 投喂高营养价值配合饲料的鳜其生长速率仍显著低于投喂活饵鱼。前期研究认为, 使用配合饲料替换活饵, 对鳜消化道结构、消化酶活力等均有不利影响, 如消化道肌层和黏膜下层厚度减小, 胰蛋白酶活力下降等[6], 这一不利影响可随鳜对摄食配合饲料时间的延长而产生适应[7]。鳜对配合饲料的消化不同于活饵, 活饵需在鳜胃部多种消化酶作用下, 逐步分解为流汁状底物继而被肠吸收, 而配合饲料在胃中并未完全消化, 且停留时间短, 排空快[8], 饵料微粒可随底物分解一并排入肠腔或幽门盲囊中。配合饲料替代活饵, 使鳜面临不同蛋白底物消化吸收的适应性挑战, 其肠消化酶功能、转运和吸收速率上有何种变化, 目前还未有相关研究。相较于游离氨基酸, 以肽键结合成小肽的转运形式更具吸收特征和优势, 因此, 本研究从小肽的酶解、转运及肠内容物与粪便中的小肽含量等方面, 探究了配合饲料替换活饵对鳜蛋白质营养吸收作用的影响。
1. 材料与方法
1.1 实验材料
鳜苗(6.77±0.64) g和饵料鱼(麦鲮)购自广东番禺某养殖场, 至实验室循环水玻璃箱中暂养2d。饲料组鳜按饥饿→活饵加死饵→死饵加软颗粒饲料→软颗粒饲料的方式驯化[9]。死饵为当场处死的鲮苗; 鳜专用饲料(粉状料)购自浙江某生物科技有限公司。
1.2 实验方法
分组饲喂与取样 实验分组为饲料组、活饵组和复投组, 每组分3个玻璃箱(50 cm×40 cm×40 cm)喂养, 每箱50尾。水体为曝气自来水, 水温保持28℃, 溶氧保持8 mg/L, pH保持8.0。饲料组投喂前0.5h, 取粉料和水(按7﹕3比例)使用制粒机均匀混合挤压成粒(粒径0.5 cm×2 cm)后待投喂; 活饵组投喂鲮鱼苗; 复投组为鳜完成饲料驯食、正常摄食配合饲料15d后再换投活饵鱼2d, 复投组转食取样时间以摄食活饵后粪便具有包膜包裹为标准。各组每天于6:30和18:30饱食投喂。饲喂周期为22d。第22天上午饱食投喂结束后计时, 于0.5h、1h、2h、3h、6h、12h和16h时间点各组随机取样, 取幽门盲囊、肠于–80℃保存。
肽酶含量与活力测定 每组各时间段随机挑选3尾, 取肠、幽门盲囊, 利用冷冻PBS缓冲液(pH 7.4)洗净消化道内容物, 吸水纸吸干水分。取50 mg样本, 加入样本量1﹕9的冷冻PBS, 在冰浴中充分匀浆后液冷冻离心15min(4℃, 3000 r/min), 取上清液, 氨肽酶和羧肽酶消化酶含量、活力采用上海酶联生物科技有公司试剂盒测定, 在酶标仪(Synergy H1, BioTek, 美国)450 nm下分别测定吸光度值, 通过标准曲线计算消化酶含量与活力。
小肽含量检测 在投喂12h后, 采集酶活组织样品同时, 吸取饲料组、活饵组与复投组3尾鱼中段肠道内容物, 分别制作混合样本于1.5 mL离心管中, –80℃保存。投喂完毕后, 立即虹吸去除残余饵饲料、余留粪便, 同时开启循环水泵过滤水质。待饲料组、活饵组与复投组鳜排便后, 分组收集粪便→滤纸过滤→1.5 mL离心管、–80℃速冻→冷冻干燥机干燥→ –80℃保存。样品委托上海交通大学分析检测中心检测, 采用LC-MS法, 在正负离子模式下进行非靶向代谢物质检测, 利用图谱信息对比metlin数据库进行短肽类型鉴定。
小肽转运载体表达定量 小肽转运载体Pept1a、Pept1b和Pept2 cDNA序列来自本实验室鳜基因组数据, 内参基因引物根据GenBank中鳜β-actin cDNA序列(登录号: FJ436084.1), 由软件Primer 5.0进行合成引物设计, 并委托上海金唯智生物科技有限公司合成(表 1)。
表 1 引物序列Table 1. Primer sequence引物名称
Primer引物序列
Primer sequence
(5′—3′)扩增产物大小
Amplification
product
size (bp)退火温度
Annealing
temperature (℃)Pept1a-F AAGACATCGAGCCCAACTCG 235 64 Pept1a-R ATGTACTCTGCCCACCGTTC Pept1b-F GGCAGACAAAGGCGAGAT 193 56 Pept1b-R ATGGTAGATAGTGGTGGC Pept2-F GACGCTCTACTTCCTCAC 199 58 Pept2-R AATGGCTCCAACCGACTT β-actin-F GCGTGACATCAAGGAGAA 181 β-actin-R CATACCGAGGAAGGAAGG 每组各时间段随机挑选3尾鳜, 取肠、幽门盲囊, 用冷冻去离子水洗净肠道内容物后分为前肠、中肠和后肠。采用TaKaRa试剂盒提取样品总RNA和去除基因组DNA杂质、反转录合成cDNA, 使用OD仪检测浓度和纯度, 使用1.0%琼脂糖凝胶电泳检测其完整性。实时荧光定量PCR反应体系20.0 μL: TB Green Premix TapⅡ10 μL, 正反引物各0.8 μL, cDNA模板1.6 μL, ddH2O 6.8 μL。扩增程序: 95℃ 预变性3min; 95℃ 3s, 60℃ 25s, 进行40个循环; 每个样本设置3个重复, 以Ct (2–ΔΔCt)值计算目的基因的相对表达数据。
1.3 数据处理
使用Excel汇总数据; 使用SPSS 21.0进行统计分析, 采用Independent-samples t Test, 比较活饵组、饲料组和复投组各指标间的差异。使用Origin 18和Excel绘图。
2. 结果
2.1 投喂活饵与饲料对鳜肠和幽门盲囊中氨肽酶、羧肽酶含量的影响
由表 2可知, 饲料组肠氨肽酶含量在鳜摄食后2h、3h和6h时具显著差异(P<0.05), 呈依次递减趋势, 12h恢复至进食后2h水平。活饵组肠氨肽酶含量在鳜进食后6h时, 显著低于各时间点(P<0.05)。复投组肠氨肽酶含量在各时间点无显著差异(P<0.05); 饲料组幽门盲囊氨肽酶在鳜摄食0.5h和6h时, 含量显著低于各时间点(P<0.05)。活饵组幽门盲囊在摄食6h时, 含量显著降低(P<0.05)。复投组幽门盲囊氨肽酶含量于摄食0.5h时含量最高, 显著高于各时间点(P<0.05)。各组鳜摄食后0.5h至16h, 肠与幽门盲囊氨肽酶含量增减呈无规律性变化, 3种投食策略对鳜消化过程中氨肽酶含量的变化无显著影响。
表 2 活饵组、饲料组和复投组的肠道与幽门盲囊的氨肽酶含量Table 2. The content of aminopeptidase in the intestine and pyloric caeca of live bait group, feed group and re-injection group (ng/mL)时间
Time
(h)肠氨肽酶含量
Content of aminopeptidase in the intestine幽门盲囊氨肽酶含量
Content of aminopeptidase in thepyloric caeca饲料组 活饵组 复投组 饲料组 活饵组 复投组 0.5 10.28±0.23bc 10.39±0.19a 10.11±0.13 6.53±0.79b 10.72±0.25a 10.03±0.62a 1 10.44±0.45b 10.42±0.71a 8.29±1.88 9.87±0.19a 9.76±0.17ab 7.47±0.06b 2 11.70±0.16a 10.23±0.15ab 10.09±0.32 8.57±0.11a 9.70±0.89ab 8.60±0.15ab 3 10.47±0.43b 10.17±0.03ab 10.89±0.16 9.82±0.18a 10.22±0.21a 8.37±0.47ab 6 9.52±0.29c 8.96±0.31b 9.67±0.71 5.65±0.32b 8.35±0.32b 7.70±0.38b 12 10.75±0.38ab 10.22±0.50ab 10.33±0.18 8.74±0.30a 9.81±0.56ab 7.27±0.03b 16 9.58±0.23c 10.16±0.04ab 9.73±0.15 9.65±0.42a 9.28±0.07ab 7.82±1.14b 注: 同一列数据上标注不同小写字母表示差异显著(P<0.05), 标注不同大写字母表示差异极显著(P<0.05), 下同Note: Different lowercase letters marked on the same row indicate significant difference (P<0.05). Different uppercase letters indicate extremely significant difference (P<0.05). The same applies below 由表 3可知, 饲料组肠羧肽酶含量在鳜摄食后3h、6h和12h时具显著差异(P<0.05), 呈先增后减趋势, 其中含量最高为摄食6h时。活饵组与复投组分别在摄食1h和2h时, 肠羧肽酶含量具显著差异, 均在摄食1h时含量达最高值; 饲料组幽门盲囊羧肽酶含量于摄食0.5h时显著低于各时间点(P<0.05), 摄食3h时含量达最高值。活饵组幽门盲囊羧肽酶含量于摄食3h和6h时具显著差异(P<0.05), 摄食6h时含量达最高值。复投组幽门盲囊羧肽酶含量于摄食0.5h时最高, 于摄食16h时最低。与氨肽酶含量类似, 三种投食策略下羧肽酶含量增减呈无规律性变化。
表 3 活饵组、饲料组和复投组的肠道与幽门盲囊的羧肽酶含量Table 3. The content of carboxypeptidase in the intestine and pyloric caeca of the live bait group, feed group and re-injection group (ng/mL)时间
Time
(h)肠羧肽酶含量
Content of carboxypeptidase in the intestine幽门盲囊羧肽酶含量
Content of carboxypeptidase in the pyloric caeca饲料组 活饵组 复投组 饲料组 活饵组 复投组 0.5 130.26±3.54bc 128.74±1.01bc 141.09±4.25a 72.87±6.88c 130.77±2.83ab 138.06±1.42a 1 126.32±0.61bc 152.94±13.46a 152.02±9.72a 112.75±6.68ab 123.08±0.61ab 104.55±2.73bc 2 124.29±1.62bc 124.19±0.71c 97.67±16.30b 107.69±2.02ab 124.70±2.02ab 111.54±7.89ab 3 117.31±3.74c 120.55±1.52c 123.12±0.56ab 127.83±3.74a 113.77±4.45b 104.55±18.52bc 6 152.13±8.00a 145.65±6.17ab 141.19±0.51a 109.62±6.17ab 141.80±11.03a 128.14±2.43ab 12 131.38±0.81b 128.24±0.91bc 123.68±10.53ab 104.25±10.53b 122.47±1.62ab 94.13±12.75b 16 127.83±0.30bc 119.03±0.20c 125.81±6.58ab 116.19±2.43ab 124.70±13.16ab 60.22±0.71c 2.2 投喂活饵与饲料对鳜肠与幽门盲囊中氨肽酶、羧肽酶含量的影响
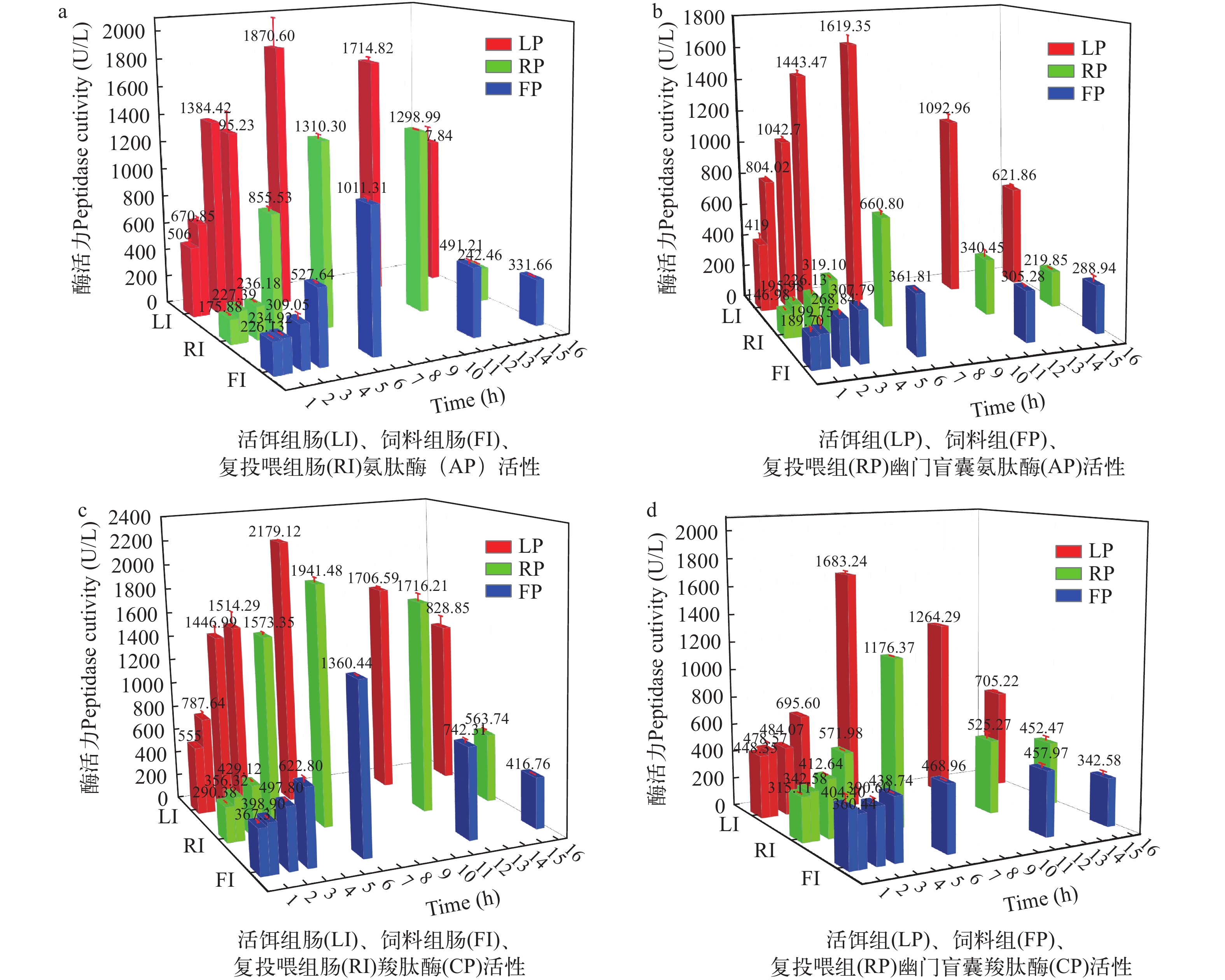
如图 1所示, 活饵组、饲料组和复投组鳜的肠和幽门盲囊氨肽酶与羧肽酶活力在进食后0.5h至6h时间段酶活力呈逐步上升, 6h之后逐步下降趋势。
摄食后0.5h至2h活饵组肠氨肽酶、羧肽酶高于复投组和饲料组(P<0.01); 摄食后3h, 肠氨肽酶活力分别为活饵组>复投组>饲料组; 活饵组与复投组肠羧肽酶活力显著高于饲料组(P<0.01), 活饵组与复投组无差异(P>0.05); 摄食后6h, 肠中两种肽酶活力依次为活饵组>复投组>饲料组; 摄食后12h, 活饵组与复投组肠中两种肽酶活力显著高于饲料组(P<0.01)。摄食后16h, 活饵组肠中两种肽酶仍保持较高活力, 显著高于复投组和饲料组(P<0.01)。
活饵组幽门盲囊中氨肽酶和羧肽酶在各时间点, 酶活力显著高于复投组与饲料组(P<0.01)。活饵组幽门盲囊中两种肽酶在各时段活力增长趋势与肠类似, 饲料组增长趋势则较为平缓。
2.3 小肽转运载体表达量
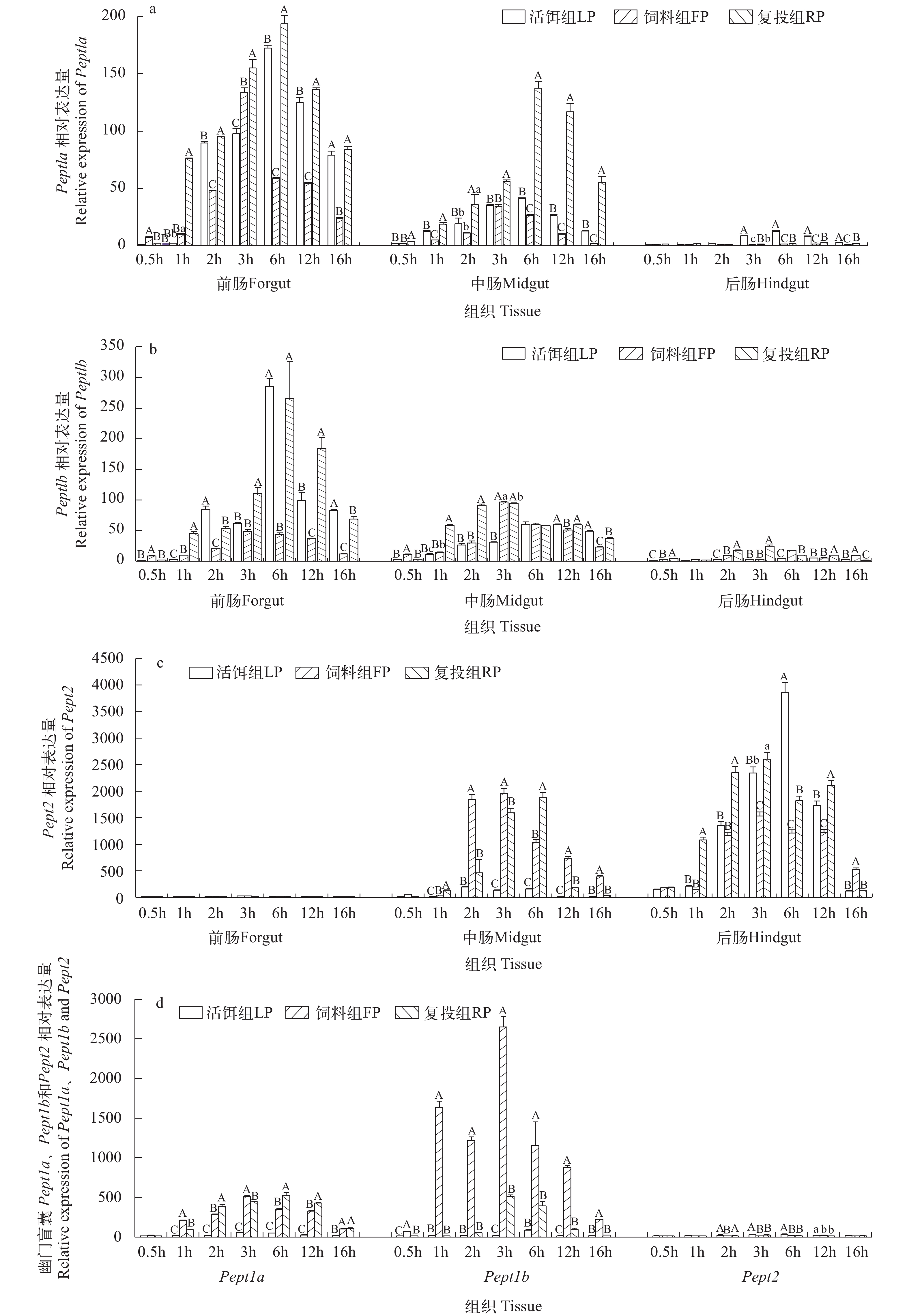
如图 2所示, 活饵组、饲料组和复投组鳜肠Pept1a、Pept1b mRNA相对表达量从前肠至后肠依次降低, 后肠仅微量表达。Pept2 mRNA相对表达量则从前肠至后肠依次上升, 前肠仅微量表达。活饵组与复投组前、中肠Pept1a和Pept1b mRNA相对表达量分别于进食后6h达最高水平, 饲料组于进食3h后达最高水平(图 2a—c)。
在幽门盲囊中, 活饵组各时间点Pept1a、Pept1b和Pept2 mRNA表达量均为较低水平。饲料组、复投组各时间点Pept1a mRNA相对表达量显著高于活饵组(P<0.01)。饲料组各时间点Pept1b mRNA相对表达量显著高于活饵组和复投组(P<0.01)。
2.4 肠内容物与粪便中小肽含量
如表 4所示, 各组鳜摄食12h后, 肠中段内容物中短肽及小肽含量由高到低依次为复投组>饲料组>活饵组; 短肽中小肽含量占比由高到低依次为饲料组>复投组>活饵组; 小肽中含必需氨基酸小肽含量及占比由高到低依次为复投组>饲料组>活饵组。
表 4 鳜肠道内容物与粪便中肽含量Table 4. Peptide content of intestinal contents and excrement of S. chuatsi (μg/mL)项目Item 分类
Category活饵组
Live bait group饲料组
Feed group复投组
Repeat
feeding group肠内容物
Intestinal contents短肽 1567.21 2767.05 16581.92 小肽 1001.70 2106.22 11234.14 小肽占比 (%) 63.92 76.12 67.75 含必需AA小肽 404.93 1295.08 8347.72 含必需AA小肽占比 (%) 40.42 61.49 74.31 粪便
Excrement短肽 19209.10 40013.89 16311.32 小肽 13401.33 20383.24 11287.71 小肽占比 (%) 69.77 50.94 69.20 含必需AA小肽 9329.88 17583.97 8188.71 含必需AA小肽占比 (%) 69.62 86.27 72.55 注: 本试验短肽特指由2—5个AA缩合组成的肽链; 小肽特指由2—3个AA缩合组成的肽链; 含必需AA小肽特指由2或3个NEAA组成的肽链Note: The short peptide refers to the peptide chain composed of 2—5 AA condensation in this test; Small peptide refers to the peptide chain composed of 2—3 AA condensation; Small peptides containing essential AA are especially those containing 2 or 3 NEAA chains 粪便中短肽及小肽含量由高到低依次为饲料组>活饵组>复投组; 短肽中小肽含量占比由高到低依次为活饵组>复投组>饲料组; 小肽中含必需氨基酸的小肽含量占比由高到低依次为饲料组>复投组>活饵组。
3. 讨论
3.1 投喂活饵与饲料对鳜肽酶含量与活力的影响
在动物摄食蛋白质后, 需先经胃蛋白酶、胰蛋白酶和糜蛋白酶等初级水解消化, 再经肠腔肽酶降解为单个游离氨基酸、二肽或三肽才能被最终吸收[10]。氨肽酶和羧肽酶分别是从蛋白质多肽链N-末端或C-末端顺序催化降解出游离氨基酸的外切蛋白酶。研究表明, 酶活力的高低与食性[11]、个体发育[12]、饵料组成[13]和消化道部位[14]等有关。酶含量则与鱼的不同种属、日龄及食性有关, 常受到自身酶基因和遗传物质的调控, 以最为“经济”、稳定的状态发挥最大的效率[15]。本研究表明, 随鳜摄食不同饵料后, 肠肽酶含量在肠与幽门盲囊间具有明显差异, 但同一组织内酶含量未见有规律变化(表 2和表 3), 推测鳜肠肽酶具有种属稳定性和自身调控性, 肠道与幽门盲囊不同组织间酶含量的差异受摄食饵料类型影响较小。此外, 鳜摄食配合饲料对肠肽酶含量未造成显著影响, 其变化趋势与摄食活饵类似, 不具规律性变化, 表明配合饲料对肠肽酶合成含量水平上影响较小, 且消化过程中酶含量的变化对鳜分解饵料小肽的影响较小。
一般鱼类的食性与消化道结构、消化机能及酶的活性和分布是相适应的[16]。肉食性鱼类消化道短, 作为食物消化吸收的主要场所[17], 若摄食饵料发生改变, 消化道内消化酶活力将随之改变。点带石斑鱼(Epinephelus coioides)[18]和乌鳢(Channa argus)[19]消化酶研究表明, 在投喂鱼类配合饲料后, 消化道除淀粉酶外, 其他消化酶活力显著低于活饵组。本试验中在投喂鳜配合饲料后, 消化道中氨肽酶、羧肽酶活力具有类似变化, 饲料组肠肽酶活力显著低于活饵组。而经先饲料后活饵投喂的复投组, 其肠肽酶活力在各时段较饲料组有所上升, 然均未恢复到活饵组水平。由图 1表明, 鳜消化道肽酶对于活饵蛋白分解产物的酶解反应动力强于配合饲料。肽酶活力是随饵料改变而发生改变的, 配合饲料蛋白对肽酶结构活力水平上的调节显著低于活饵。鳜在摄食配合饲料后, 消化道结构和机能受损, 消化酶活力降低[6], 显示鳜对配合饲料消化适应性差, 肠肽酶活力的降低也将直接影响饲料蛋白水解成小肽的效率。在复投活饵2d后肠肽酶活力仍未达到先前摄食活饵水平, 说明转食后酶活力需较长时间恢复, 配合饲料对鳜肠肽酶活力高低影响显著强于酶含量。
不同食性鱼类消化酶活力变化虽存在显著差异, 随着进食时间延长一致均表现先升后降的趋势[17, 20, 21]。试验中各组鳜随着进食后时间延长, 肠与幽门盲囊中氨肽酶和羧肽酶活力均呈先升后降的变化规律(图 1), 说明鳜消化道肠肽酶对分解活饵和饲料产生的多肽具有类似的酶解过程。不同实验组鳜的氨肽酶与羧肽酶活力同在6h时达最高水平, 之后逐渐降低。不同的是, 鳜进食后0.5—3h, 活饵组氨肽酶及肠道中的羧肽酶酶活力增幅显著高于饲料组和复投组(图 1a、1b和1c), 表明鳜摄食活饵时, 肽酶活力效应时间显著高于饲料。相关研究认为, 鳜消化酶活力与其食性相适应外[11], 摄食的活饵可作为酶源或通过自身含有的活性物质促进鳜消化道饵料蛋白的消化分解[7]。鳜进食后3—6h, 饲料组和复投组肠道中氨肽酶与羧肽酶活力显著升高, 升高增幅仍较活饵组迟缓, 其中以饲料组酶活力最低。研究表明, 怀头鲇(Silurus soldatovi)摄食前, 肠道中已具有一定蛋白酶活力, 摄食后3h即到高峰, 并推论肠道中存在消化酶的基础性分泌活性[20]。图 1a和1c显示, 活饵组在进食后0.5—3h肽酶活力较饲料组与复投组快速上升, 表明鳜在持续投喂活饵鱼条件下, 肠道肽酶在摄食前可能同样存在一定活性, 待摄食后, 肽酶能以较高活力进入对活饵鱼蛋白多肽的酶解状态。活饵组与复投组肠肽酶在整个消化分解过程中持续高活力, 而饲料组酶活力在进食6h后则快速下降, 这可能与饲料组鳜胃快速排空[8]有关。饲料组胃部初级消化产物较活饵组与复投组可提前进入肠道, 与活力较低的肽酶接触。摄食6h酶活力达最高水平时, 胃排空速率[17]减小, 持续向肠道移动消化产物量下降, 随后肽酶活力快速下降。
由于饵料的不同, 产生酶活力差异已在多种水产动物中报道。从食物中获得足量小肽能促使消化酶活力的提升[22—24], 若投喂鱼类更益于消化吸收的饵料, 消化酶活力上升的同时, 还可获得更多种类与含量的小分子肽[25]。在试验中使用配合饲料替换活饵鱼后, 对鳜消化道内参与初级蛋白产物分解的肠肽酶活力产生显著不利影响。
3.2 小肽转运载体在活饵组、饲料组及复投组肠与幽门盲囊中表达量
前期研究发现, 使用饲料替代活饵鱼喂养鳜30d后, 饲料组Pept1 mRNA在前肠表达显著低于活饵组, 以配合饲料为饵料产生的底物对Pept1表达具下调作用[6]。本实验结果进一步显示, 在时间分布上, 各组Pept1a、Pept1b和Pept2 mRNA表达与进食后肽酶的活力不具相似性; 在表达丰度上, 与投喂不同饵料后, 各组间肽酶活力高低具相似性。
活饵组与复投组鳜在摄食后, 需在胃部多种消化酶参与下将活饵鱼蠕动液化分解为多肽蛋白底物, 底物再经肠和幽门盲囊进一步分解吸收。而鳜摄食的配合饲料形态易于消化分解, 在胃和肠等消化道中停留的时间较活饵鱼短[8], 饲料组前、中肠提前获得可转运小肽, 活饵组与复投组则有滞后。研究表明, 小肽转运载体转运活性增强的主要原因是小肽或游离氨基酸活化了小肽转运载体启动子, 使得在肠细胞膜上表达增多[26]。 如图 2所示, 活饵组、复投组肠Pept1a、 Pept1b和Pept2的mRNA相对表达量在进食后6h达最高水平, 饲料组在进食后3h达最高水平。饲料组肠小肽转运载体基因表达峰值较活饵组提前, 表明鳜对饲料的消化分解过程较活饵鱼快, 配合饲料中蛋白底物分解产生小肽的速度快, 继而加速激活小肽转运载体启动子, 使Pept1a和Pept1b mRNA的表达上调。表 1显示, 饲料组3—6h肠肽酶活力快速上升, 并达最高水平, 而饲料组Pept1a、Pept1b和Pept2 mRNA表达则从3h时最高水平逐渐下降。这一结果可能与饲料组肠蛋白酶解产物排入量减少有关, 小肽获得量较少, 转运载体活性随之下降。
在进食后6—12h, 活饵组、复投组Pept1a和Pept1b mRNA表达快速下降, 饲料组保持缓慢下降, 且低于活饵组和复投组, 这一状态可视为饲料组鳜肠道可转运小肽的分解趋于结束。由各组不同时间段转运趋势说明, 鳜同其他鱼类相似, 饵料属性差异显著影响小肽的消化吸收[27]。
Pept1a和Pept1b基因在各组前、中肠部位具高水平表达(图 2a和2b), 与莫桑比克罗非鱼(Tilapia mossambica)表达一致, 符合前、中肠是转运小肽的高水平位置[28]。在幽门盲囊中, 复投组和饲料组Pept1a和Pept1b在进食后1h基因表达水平远高于活饵组(图 2c), 推测可能由于鳜摄食人工饲料后, 肠道小肽转运活性下降, 使幽门盲囊对小肽的转运发生功能延伸补偿作用[29]。复投组幽门盲囊各时段均高于饲料组, 与是否因先投喂饲料、后投喂活饵后, 产生的修复作用有关, 目前还未有更深入的研究。
Pept2与肽重吸收有关[30], 有利于鱼类肠道中蛋白质吸收的最大化[31]。Ostaszewska等[32]报道, 与鲤(Cyprinus carpio)肠道中大量的Pept1基因转录物不同, Pept2基因的表达非常低, 几乎不受不同饮食的调节。而在大菱鲆(Scophthalmus maximus)[33]中, Pept2在肠后段高表达, 与鳜类似, 并受不同饵料的调节。如图 2c所示, Pept2 mRNA在各组鳜后肠高度表达, 活饵组与饲料组Pept2 mRNA各时间点相对表达量与Pept1a和Pept1b一致。这说明肉食性鱼类在摄食高蛋白食物后, 后肠小肽转运及重吸收功能相应强于其他食性鱼类, 而因鳜对饲料与活饵在肠胃消化分解有差异, 活饵组Pept2 mRNA表达最高值位于6h, 并显著高于饲料组3h最高值。
3.3 活饵组、饲料组及复投组肠内容物与粪便中小肽含量
目前鱼类关于小肽转运的研究主要集中于分子特征上, 或以某类小肽作为日粮添加物来评价其营养价值, 鲜有涉及不同饵料蛋白分解物(小肽)在肠道中的吸收效率的相关研究[34]。本试验直观检测了鳜进食12h后, 小肽在肠道中吸收及粪便中剩余情况。
研究表明, 超过60%—70%鱼类的胃在摄食后9—15h内完全排空, 例如杂交石斑鱼(Epinephelus moara ♀ × E. lanceolatus ♂)进食后9h胃基本排空, 12h左右产生再进食食欲[35]。故选择鳜进食后12h, 在各组胃趋近排空、肠道仍有残余物时作为观测点。复投组肠内容物短肽含量(16581.92 μg/mL)显著高于饲料组(2767.05 μg/mL)与活饵组(1567.21 μg/mL; 表 4); 继而推测, 复投组因摄食饵料两次转变, 随之形成短肽的底物发生变化, 消化道形态和消化酶等需适宜应对, 消化过程延长使短肽的产生、累积及转运时间延长。活饵组与复投组短肽中小肽占比(63.92%和67.75%)显著低于饲料组(76.12%)。这表明鳜摄食从饲料转为活饵后, 肠对小肽的吸收时间延长的同时, 吸收小肽的效率并未下降。
理论上认为, 小肽能被完整转运, 优于单个游离氨基酸吸收[36]。从各组粪便短肽或小肽残余量表明, 肉食性鱼类对小肽的转运吸收能力不仅受氨基酸结合形式(游离氨基酸或二肽、三肽、四肽和五肽)影响, 还受到饵料组成的影响。实验结果显示, 饲料组粪便短肽和小肽含量显著高于活饵组和复投组, 小肽占短肽含量虽为最低, 但含必需氨基酸小肽含量为最高(86.27%)。由各组粪便残余小肽可知, 在投喂鳜活饵鱼后, 消化道转运小肽的速度高于复投组、转运能力或转运强度则高于饲料组, 即在相同时间点, 肠内容物中高水平(含必需氨基酸)小肽剩余量及粪便中的含量均低于饲料组。
以上可见, 由于饵料的改变, 鳜对饲料蛋白水解为小肽的转运吸收能力下降, 部分小肽营养未被吸收, 造成营养浪费, 机体在生长发育中可利用的氨基酸相应减少。
4. 结论
实验结果表明, 鳜对饲料蛋白的消化吸收, 尤其在小肽营养转运吸收方面, 效率显著低于活饵鱼。投喂鳜配合饲料使肠道与幽门盲囊中的氨肽酶和羧肽酶酶活力降低、小肽转运载体基因mRNA表达降低、肠道小肽吸收减少及粪便中未吸收小肽含量增加; 饲料驯化后复投活饵, 对鳜肠肽酶活力、小肽转运载体基因相对表达量及小肽吸收量均得到提升与恢复。通过3种分组投喂策略, 比较当前鳜对饲料蛋白营养的消化吸收仍存在不足。因此, 在鳜饲料驯化养殖中可结合鳜对小肽的转运、吸收特点, 进一步探究适宜鳜消化吸收、利用的配合饲料。
-
表 1 引物序列
Table 1 Primer sequence
引物名称
Primer引物序列
Primer sequence
(5′—3′)扩增产物大小
Amplification
product
size (bp)退火温度
Annealing
temperature (℃)Pept1a-F AAGACATCGAGCCCAACTCG 235 64 Pept1a-R ATGTACTCTGCCCACCGTTC Pept1b-F GGCAGACAAAGGCGAGAT 193 56 Pept1b-R ATGGTAGATAGTGGTGGC Pept2-F GACGCTCTACTTCCTCAC 199 58 Pept2-R AATGGCTCCAACCGACTT β-actin-F GCGTGACATCAAGGAGAA 181 β-actin-R CATACCGAGGAAGGAAGG 表 2 活饵组、饲料组和复投组的肠道与幽门盲囊的氨肽酶含量
Table 2 The content of aminopeptidase in the intestine and pyloric caeca of live bait group, feed group and re-injection group (ng/mL)
时间
Time
(h)肠氨肽酶含量
Content of aminopeptidase in the intestine幽门盲囊氨肽酶含量
Content of aminopeptidase in thepyloric caeca饲料组 活饵组 复投组 饲料组 活饵组 复投组 0.5 10.28±0.23bc 10.39±0.19a 10.11±0.13 6.53±0.79b 10.72±0.25a 10.03±0.62a 1 10.44±0.45b 10.42±0.71a 8.29±1.88 9.87±0.19a 9.76±0.17ab 7.47±0.06b 2 11.70±0.16a 10.23±0.15ab 10.09±0.32 8.57±0.11a 9.70±0.89ab 8.60±0.15ab 3 10.47±0.43b 10.17±0.03ab 10.89±0.16 9.82±0.18a 10.22±0.21a 8.37±0.47ab 6 9.52±0.29c 8.96±0.31b 9.67±0.71 5.65±0.32b 8.35±0.32b 7.70±0.38b 12 10.75±0.38ab 10.22±0.50ab 10.33±0.18 8.74±0.30a 9.81±0.56ab 7.27±0.03b 16 9.58±0.23c 10.16±0.04ab 9.73±0.15 9.65±0.42a 9.28±0.07ab 7.82±1.14b 注: 同一列数据上标注不同小写字母表示差异显著(P<0.05), 标注不同大写字母表示差异极显著(P<0.05), 下同Note: Different lowercase letters marked on the same row indicate significant difference (P<0.05). Different uppercase letters indicate extremely significant difference (P<0.05). The same applies below 表 3 活饵组、饲料组和复投组的肠道与幽门盲囊的羧肽酶含量
Table 3 The content of carboxypeptidase in the intestine and pyloric caeca of the live bait group, feed group and re-injection group (ng/mL)
时间
Time
(h)肠羧肽酶含量
Content of carboxypeptidase in the intestine幽门盲囊羧肽酶含量
Content of carboxypeptidase in the pyloric caeca饲料组 活饵组 复投组 饲料组 活饵组 复投组 0.5 130.26±3.54bc 128.74±1.01bc 141.09±4.25a 72.87±6.88c 130.77±2.83ab 138.06±1.42a 1 126.32±0.61bc 152.94±13.46a 152.02±9.72a 112.75±6.68ab 123.08±0.61ab 104.55±2.73bc 2 124.29±1.62bc 124.19±0.71c 97.67±16.30b 107.69±2.02ab 124.70±2.02ab 111.54±7.89ab 3 117.31±3.74c 120.55±1.52c 123.12±0.56ab 127.83±3.74a 113.77±4.45b 104.55±18.52bc 6 152.13±8.00a 145.65±6.17ab 141.19±0.51a 109.62±6.17ab 141.80±11.03a 128.14±2.43ab 12 131.38±0.81b 128.24±0.91bc 123.68±10.53ab 104.25±10.53b 122.47±1.62ab 94.13±12.75b 16 127.83±0.30bc 119.03±0.20c 125.81±6.58ab 116.19±2.43ab 124.70±13.16ab 60.22±0.71c 表 4 鳜肠道内容物与粪便中肽含量
Table 4 Peptide content of intestinal contents and excrement of S. chuatsi (μg/mL)
项目Item 分类
Category活饵组
Live bait group饲料组
Feed group复投组
Repeat
feeding group肠内容物
Intestinal contents短肽 1567.21 2767.05 16581.92 小肽 1001.70 2106.22 11234.14 小肽占比 (%) 63.92 76.12 67.75 含必需AA小肽 404.93 1295.08 8347.72 含必需AA小肽占比 (%) 40.42 61.49 74.31 粪便
Excrement短肽 19209.10 40013.89 16311.32 小肽 13401.33 20383.24 11287.71 小肽占比 (%) 69.77 50.94 69.20 含必需AA小肽 9329.88 17583.97 8188.71 含必需AA小肽占比 (%) 69.62 86.27 72.55 注: 本试验短肽特指由2—5个AA缩合组成的肽链; 小肽特指由2—3个AA缩合组成的肽链; 含必需AA小肽特指由2或3个NEAA组成的肽链Note: The short peptide refers to the peptide chain composed of 2—5 AA condensation in this test; Small peptide refers to the peptide chain composed of 2—3 AA condensation; Small peptides containing essential AA are especially those containing 2 or 3 NEAA chains -
[1] Daniel H, Kottra G. The proton oligopeptide cotransporter family SLC15 in physiology and pharmacology [J]. Pflugers Archiv: European Journal of Physiology, 2004, 447(5): 610-618. doi: 10.1007/s00424-003-1101-4
[2] Wang J L, Yan X, Lu R H, et al. Peptide transporter 1 (PepT1) in fish: a review [J]. Aquaculture and Fisheries, 2017, 2(5): 193-206. doi: 10.1016/j.aaf.2017.06.007
[3] Maffia M, Rizzello A, Acierno R, et al. Characterisation of intestinal peptide transporter of the Antarctic haemoglobinless teleost Chionodraco hamatus [J]. Journal of Experimental Biology, 2003, 206(Pt4): 705-714.
[4] Con P, Nitzan T, Slosman T, et al. Peptide transporters in the primary gastrointestinal tract of pre-feeding Mozambique tilapia larva [J]. Frontiers in Physiology, 2019(10): 808. doi: 10.3389/fphys.2019.00808
[5] 马燕梅, 梅景良, 林树根. 鳜胃肠道和肝脏主要消化酶活性的研究 [J]. 江西农业大学学报, 2004, 26(4): 584-588. Ma Y M, Mei J L, Ling S G. Studies on the main digestive enzyme activities in stomach Intestine and Liver of Siniperca chautsi [J]. Acta Agriculturae Universitatis Jiangxiensis, 2004, 26(4): 584-588.
[6] 曾萌冬, 徐俊, 宋银都, 等. 饲料替代活饵对鳜生长、消化及小肽转运载体基因表达的影响 [J]. 南方农业学报, 2021, 52(1): 228-237. Zeng M D, Xu J, Song Y D, et al. Effects of replacing live bait with compound feed on growth, digestion and expression of small peptide transporter (PepT1) gene of Siniperca chuatsi [J]. Journal of Southern Agriculture, 2021, 52(1): 228-237.
[7] 李燕, 李永强, 李建忠, 等. 配合饲料完全替代鲜活饵料对翘嘴鳜生长、体成分及消化能力的影响 [J]. 水产科技情报, 2016, 43(3): 164-168. Li Y, Li Y Q, Li J Z, et al. Effects of replacing fresh bait with compound feed completely on growth, body composition and digestion ability of Siniperca chuatsi [J]. Fisheries Science & Technology Information, 2016, 43(3): 164-168.
[8] 梁旭方, 何珊. 鳜鱼遗传育种与饲料养殖 [M]. 北京: 科学出版社, 2018. Liang X F, He S. Genetic Breeding and Feed Breeding of Mandarin Fish [M]. Beijing: Science Press, 2018.
[9] 曾萌冬, 宋银都, 吴红岩, 等. 鳜不同驯食方式的效果比较 [J]. 渔业研究, 2020, 42(2): 160-166. Zeng M D, Song Y D, Wu H Y, et al. Comparison on the effects of different domestication methods of Mandarin fish Siniperca chuatsi [J]. Journal of Fisheries Research, 2020, 42(2): 160-166.
[10] Nakanishi K, Yaoi K, Nagino Y, et al. Aminopeptidase N isoforms from the midgut of Bombyx mori and Plutella xylostella-their classification and the factors that determine their binding specificity to Bacillus thuringiensis Cry1A toxin [J]. Federation of European Biochemical Societies letter, 2002, 519(1-3): 215-220. doi: 10.1016/S0014-5793(02)02708-4
[11] 吴婷婷, 朱晓鸣. 鳜鱼、青鱼、草鱼、鲤、鲫、鲢消化酶活性的研究 [J]. 中国水产科学, 1994, 1(2): 10-17. Wu T T, Zhu X M. Studies on the activity of digestive enzymes in mandarin fish, black carp, grass carp, common carp, crucian carp and silver carp [J]. Journal of Fishery Sciences of China, 1994, 1(2): 10-17.
[12] Zambonino Infante J L, Cahu C L. Ontogeny of the gastrointestinal tract of marine fish larvae [J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2001, 130(4): 477-487.
[13] Srichanun M, Tantikitti C, Kortner T M, et al. Effects of different protein hydrolysate products and levels on growth, survival rate and digestive capacity in Asian seabass (Lates calcarifer Bloch) larvae [J]. Aquaculture, 2014(428-429): 195-202. doi: 10.1016/j.aquaculture.2014.03.004
[14] Tlak Gajger I, Nejedli S, Kozarić Z. Histochemical distribution of digestive enzymes in the intestine of the common two-banded SeaBream, Diplodus vulgaris, geoffroy st-hilaire 1817 [J]. Anatomia, Histologia, Embryologia, 2013, 42(3): 161-167. doi: 10.1111/j.1439-0264.2012.01179.x
[15] 李武辉. 鲂鲌品系和鲌鲂品系遗传特性及食性研究 [D]. 长沙: 湖南师范大学, 2018: 13. Li W H. Genetics and diet traits of reciprocal hybrids lineage derived from hybridization between Megalobrama amblycephala and Culter alburnus [D]. Changsha: Hunan Normal University, 2018: 13.
[16] 周景祥, 余涛, 黄权, 等. 鲤鱼、黄颡鱼和大眼鰤鲈消化酶活性的比较研究 [J]. 吉林农业大学学报, 2001, 23(1): 94-96. Zhou J X, Yu T, Huang Q, et al. Comparison studies on the activities of the digestive enzymes of common carp, Huangsang cat-fish and walleye [J]. Journal of Jilin Agricultural University, 2001, 23(1): 94-96.
[17] 高云红, 景琦琦, 黄滨, 等. 云龙石斑鱼胃排空特征和摄食消化特性研究 [J]. 渔业科学进展, 2021, 42(1): 92-99. Gao Y H, Jing Q Q, Huang B, et al. Characteristics of gastric evacuation and feeding digestion in “Yunlong” groupers (Epinephelus moara ♀ × E. lanceolatus ♂) [J]. Progress in Fishery Sciences, 2021, 42(1): 92-99.
[18] 逯尚尉, 刘兆普, 余燕. 不同饵料对点带石斑鱼幼鱼生长、营养成分及组织消化酶活性的影响 [J]. 上海海洋大学学报, 2010, 19(5): 648-653. Lu S W, Liu Z P, Yu Y. Effect of different diets on growth, nutritive composition and digestive enzyme activities of juvenile Epinephelus malabaricus [J]. Journal of Shanghai Ocean University, 2010, 19(5): 648-653.
[19] 曹崇海. 乌鳢饲喂冰鲜鱼和配合饲料消化道组织及消化酶差异的研究 [D]. 浙江: 浙江大学, 2011. Cao C H. Study on the differences of digestive tract tissues and digestive enzymes of snakehead fed chilled fish and compound feed [J]. Zhejiang: Zhejiang University: 2011.
[20] 王立波, 刘伟, 陈军, 等. 怀头鲇幼鱼摄食前后消化酶活性的变化 [J]. 水产学杂志, 2007, 20(1): 36-41. Wang L B, Liu W, Chen J, et al. Changes in digestive enzyme activities of northern sheatfish after feeding [J]. Chinese Journal of Fisheries, 2007, 20(1): 36-41.
[21] 翁祖桐. 2个养殖水温下罗非鱼食后肠道消化酶活性的动态变化 [J]. 渔业研究, 2018, 40(5): 374-379. Weng Z T. The variations of digestive enzyme activities after feeding in intestinal canal of tilapia at two water temperatures [J]. Journal of Fisheries Research, 2018, 40(5): 374-379.
[22] Kamaszewski M, Ostaszewska T, Napora-Rutkowski L, et al. The role of dipeptide on fish growth and digestive enzyme activity modulation in common carp (Cyprinus carpio L.) [J]. Animal Science Papers and Reports, 2019, 37(1): 75-85.
[23] 姜柯君, 王际英, 张利民, 等. 饲料中添加小肽对星斑川鲽幼鱼生长性能、体组成及血清生化指标的影响 [J]. 动物营养学报, 2013, 25(1): 222-230. Jiang K J, Wang J Y, Zhang L M, et al. Effects of small peptides supplementation on growth performance, body composition and serum biochemical indices of juvenile starry flounder (Platichthys stellatus) [J]. Chinese Journal of Animal Nutrition, 2013, 25(1): 222-230.
[24] 许培玉, 周洪琪. 小肽制品对凡纳滨对虾蛋白酶和淀粉酶活力的影响 [J]. 上海水产大学学报, 2005, 14(2): 133-137. Xu P Y, Zhou H Q. Effects of small peptides on the protease and amylase activities of Litopenaeus vannamei [J]. Journal of Shanghai Fisheries University, 2005, 14(2): 133-137.
[25] 夏薇, 刘文斌, 乔秋实, 等. 棉粕酶解蛋白肽对建鲤生产性能和生化指标的影响 [J]. 淡水渔业, 2012, 42(1): 46-51. Xia W, Liu W B, Qiao Q S, et al. Effects of cottonseed meal hydrolysate on growth performance and biochemical indices of Cyprinus carpio var. Jian [J]. Freshwater Fisheries, 2012, 42(1): 46-51.
[26] 邓敦, 李铁军, 黄瑞林, 等. 小肽转运蛋白(PepT1)及其活性调控 [J]. 广西农业生物科学, 2005, 24(4): 352-358. Deng D, Li T J, Huang R L, et al. Peptide-transporters (PepT1) and it’s activity regulation [J]. Journal of Guangxi Agricultural and Biological Science, 2005, 24(4): 352-358.
[27] Amberg J J, Myr C, Kamisaka Y, et al. Expression of the oligopeptide transporter, PepT1, in larval Atlantic cod (Gadus morhua) [J]. Comparative Biochemistry and Physiology Part B, 2008, 150(2): 177-182. doi: 10.1016/j.cbpb.2008.02.011
[28] Con P, Nitzan T, Cnaani A. Salinity-dependent shift in the localization of three peptide transporters along the intestine of the Mozambique tilapia (Oreochromis mossambicus) [J]. Frontiers in Physiology, 2017(8): 8. doi: 10.3389/fphys.2017.00008
[29] 汪建华, 李玉珑, 陈敦学, 等. 饥饿再投喂对鳜肌FSRP-1、FSRP-3和肠道PepT1基因表达的影响 [J]. 广西师范大学学报(自然科学版), 2016, 34(1): 144-149. doi: 10.16088/j.issn.1001-6600.2016.01.023 Wang J H, Li Y L, Chen D X, et al. Effect of starvating and refeeding on relative expression of FSRP-1, FSRP-3 and PepT1 gene in mandarin fish (Siniperca chuatsi) [J]. Journal of Guangxi Normal University (Natural Science Edition), 2016, 34(1): 144-149. doi: 10.16088/j.issn.1001-6600.2016.01.023
[30] Rubio-Aliaga I, Frey I, Boll M, et al. Targeted disruption of the peptide transporter Pept2 gene in mice defines its physiological role in the kidney [J]. Molecular and Cellular Biology, 2003, 23(9): 3247-3252. doi: 10.1128/MCB.23.9.3247-3252.2003
[31] Ahmed M, Liang H L, Kasiya H C, et al. Complete replacement of fish meal by plant protein ingredients with dietary essential amino acids supplementation for juvenile blunt snout bream (Megalobrama amblycephala) [J]. Aquaculture Nutrition, 2019, 25(1): 205-214. doi: 10.1111/anu.12844
[32] Ostaszewska T, Dabrowski K, Kamaszewski M, et al. The effect of plant protein-based diet supplemented with dipeptide or free amino acids on digestive tract morphology and Pept1 and PepT2 expressions in common carp (Cyprinus carpio L.) [J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2010, 157(2): 158-169.
[33] Xu D, He G, Mai K, et al. Expression pattern of peptide and amino acid genes in digestive tract of transporter juvenile turbot (Scophthalmus maximus L.) [J]. Journal of Ocean University of China, 2016, 15(2): 334-340. doi: 10.1007/s11802-016-2768-4
[34] Bogé G, Rigal A, Pérès G. Rates of in vivo intestinal absorption of glycine and glycylglycine by rainbow trout (Salmo gairdneri R.) [J]. Comparative Biochemistry and Physiology. Part A: Physiology, 1981, 69(3): 455-459. doi: 10.1016/0300-9629(81)93004-8
[35] Jia Y D, Gao Y H, Jing Q Q, et al. Gastric evacuation and changes in postprandial blood biochemistry, digestive enzymes, and appetite-related genes in juvenile hybrid grouper (Epinephelus moara ♀ × E. lanceolatus ♂) [J]. Aquaculture, 2021(530): 735721. doi: 10.1016/j.aquaculture.2020.735721
[36] 乐国伟, 施用晖, 杨凤. 肽在动物蛋白质营养中的作用——小肽在动物氨基酸吸收中的作用 [J]. 四川农业大学学报, 1996, 14(S1): 19-26. Yue G W, Shi Y H, Yang F. The role of small peptides in the intestinal absorption of amino acids [J]. Journal of Sichuan Agricultural University, 1996, 14(S1): 19-26.
-
期刊类型引用(1)
1. 赖铭勇. 投喂不同饵料对斑鳜生长及消化性能的影响. 南方农业学报. 2024(08): 2523-2534 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: