CLONING OF CDNA OF BCL-2 GENE OF MARSUPENAEUS JAPONICUS AND ITS ROLE IN COLD RESISTANCE
-
摘要: 为研究B 淋巴细胞瘤-2 (B-cell lymphoma, Bcl-2) 基因在内源性细胞凋亡通路中发挥的重要调控作用, 实验利用cDNA末端快速扩增(RACE) 技术克隆获得日本对虾(Marsupenaeus japonicus)MjBcl-2 基因cDNA全长序列, 并对其序列进行生物信息学分析; 利用实时定量PCR (qPCR) 技术分析了MjBcl-2在不同组织、不同水温胁迫及RNA干扰后的表达水平; 同时利用TUNEL技术, 检测MjBcl-2 干扰后的细胞凋亡情况。结果显示: 日本对虾MjBcl-2 cDNA全长为2432 bp, 开放阅读框长度为726 bp, 共编码241个氨基酸, 分子量为26.80 kD; 结构域预测分析表明MjBcl-2 含有Bcl-2家族典型的保守结构域; 多序列比对以及进化树构建结果表明, MjBcl-2与其他物种的相似度较高, 保守性较强。定量PCR结果显示, MjBcl-2在日本对虾各个组织中均有表达, 肌肉中表达量最高, 鳃次之, 心脏中表达量最低。低温(10℃和16℃)胁迫下日本对虾鳃和肝胰腺Bcl-2基因的表达量逐渐上升, 在72h到达最高点; 在干扰Bcl-2基因后, 各个温度Bcl-2基因的表达量均下调, 细胞凋亡基因Caspase-3的表达量显著上调(P<0.05) 。TUNEL检测结果表明, RNAi组和NC组(对照组) 随着温度的降低, 凋亡细胞数量不断增加, 在28℃处理组中有少量凋亡细胞, RNAi组与NC组凋亡细胞的数量没有明显的变化, 在10℃低温处理组中, RNAi组凋亡细胞的数量明显高于NC组; 12h后, 28℃ NC组、28℃ RNAi组、10℃ NC组和10℃ RNAi组中鳃组织的细胞凋亡率分别为1.73%、2.35%、21.59%和33.70%。研究表明, MjBcl-2在日本对虾应对低温胁迫中发挥重要作用。Abstract: As an important apoptosis regulatory gene, Bcl-2 gene plays an important role in the endogenous apoptosis pathway. In this study, the full-length cDNA sequence of MjBcl-2 gene was cloned by rapid amplification of cDNA ends (RACE) and analyzed by bioinformatics; Real time quantitative PCR (qPCR) was used to analyze the expression level of MjBcl-2 in different tissues of Marsupenaeus japonicus after different temperature stresses and RNA interferences; TUNEL technique was used to detect the apoptosis after the interference of MjBcl-2. The results showed that the full length of MjBcl-2 cDNA was 2432 bp, the open reading frame was 726 bp, encoding 241 amino acids with a molecular weight of 26.80 kD; Domain prediction analysis showed that MjBcl-2 contained typical conserved domains of Bcl-2 family. The results of multiple sequence alignment and phylogenetic tree construction showed that MjBcl-2 was highly conserved and similar to other species. Quantitative PCR results showed that MjBcl-2 was expressed in all tissues of M. japonicus, with the highest expression in muscle, the second in gill and the lowest in heart. Under the stress of low temperature (10℃ and 16℃), the expression of Bcl-2 gene in gill and hepatopancreas of M. japonicus increased gradually, and reached the highest point at 72h; After interference with Bcl-2 gene, the expression of Bcl-2 gene was down-regulated and Caspase-3 gene was up-regulated at all temperatures (P<0.05); There were only a few apoptotic cells in the 28℃ treatment group. TUNEL results showed that the number of apoptotic cells increased with the decrease of temperature in RNAi group and NC group (control group). There were a small number of apoptotic cells in 28℃ treatment group, but there was no significant change in the number of apoptotic cells in RNAi group and NC group. The number of apoptotic cells in 10℃ hypothermia treatment group was significantly higher than that in NC group; After 12h, the apoptosis rates of gill tissue in 28℃ NC group, 28℃ RNAi group, 10℃ NC group and 10℃ RNAi group were 1.73%, 2.35%, 21.59% and 33.70% respectively. The results showed that MjBcl-2 may play an important role in the immune defense response of M. japonicus to low temperature stress.
-
Keywords:
- Bcl-2 /
- Low temperature stress /
- Tissue expression /
- RNA interference /
- Apoptosis /
- Marsupenaeus japonicus
-
日本对虾(Marsupenaeus japonicus)俗称车虾、斑节虾、花虾, 隶属于节肢动物门(Arthropoda)、甲壳纲(Crustacea)、十足目(Decapoda)、对虾科(Penaeidae)、囊对虾属(Marsupenaeus), 在中国沿海地区广泛分布[1], 其中, 福建、台湾和广东沿海地区资源丰富[2]。日本对虾属亚热带物种, 适宜生存温度为25—29℃, 水温高于32℃时生长受到限制, 8—10℃时摄食减少, 5℃以下开始死亡[3]。北方池塘一般一年两季养殖日本对虾, 第 1 季4月底投放虾苗, 在 7 月中下旬收获; 第 2 季在6月底投放虾苗, 在 11 月初收获, 养殖周期为6个月, 低温成为影响日本对虾养殖周期的重要因素。
内源性细胞凋亡(Intrinsic apoptotic) 又被称为细胞凋亡的线粒体途径, 通常由细胞毒性刺激物或环境胁迫因子等刺激激活[4]。在哺乳动物体内, Bcl-2 家族 (B-cell lymphoma 2 family) 在内源性细胞凋亡通路中发挥着重要的作用, 其调控线粒体外膜通透性 (Mitochondrial outer membrane permeabilization, MOMP) 的上升, 导致一系列的线粒体蛋白 (例如细胞色素 C、Endo G、SMAC/Diablo 和 AIF 等) 向细胞质中释放[5, 6], 细胞质中的细胞色素 C 在ATP的帮助下和凋亡酶激活因子 1 (Apoptotic proease activating factor 1, Apaf-1) 结合, 形成多聚体, 该多聚体与 Caspase-9 前体结合形成凋亡复合体 (Apoptosome), 进而激活 Caspase-9 [7], 被激活的 Caspase-9 通过自我剪切活化过程, 在 dATP和ATP 的帮助下成功激活 Caspase-3, 从而导致内源性凋亡通路被激活[8]。
Bcl-2 家族由凋亡调节因子 Bcl-X 及其同系物组成[9], 目前已发现25 个成员[10]。Bcl-2 家族的显著特征是具有BCL同源结构域[11]。Bcl-2 家族基因根据其结构和功能的不同可分为两类: 一类为抑凋亡基因(例如Bcl-2、Bcl-xl和Bcl-W), 另一类为促凋亡基因(例如Bax、Bok、Bad和Bid) [12]。Bcl-2 家族抑凋亡基因和促凋亡基因的表达平衡是细胞发生正常凋亡现象最重要的原因[13]。Guo等[14]发现刺参 (Apostichopus japonicus) Bcl-2基因通过阻止体腔细胞中细胞色素C的释放来抑制细胞凋亡, 从而介导海参中的病菌感染。Cao等[15]研究表明慢性氟暴露下, Bcl-2 家族基因参与鲤(Cyprinus carpio) 肝脏的免疫应答过程。Xue等[16]研究称氨胁迫下鲤肝胰腺的凋亡可能是由氧化应激通过p53-Bax/Bcl-2凋亡信号通路介导的。大量研究表明, Bcl-2 家族基因对维持水生动物机体内环境稳态发挥着重要作用。而在甲壳动物中, 对于Bcl-2 家族基因的研究较少。因此, 探究日本对虾凋亡通路相关基因很有必要。
本实验以线粒体凋亡通路中的Bcl-2基因作为研究对象, 通过探究凋亡通路上的相关基因在低温胁迫环境条件下的表达规律及其产物间的相互作用, 进而阐述其主要功能, 为培育日本对虾耐低温新品种, 推动产业健康可持续发展奠定基础。
1. 材料与方法
1.1 实验材料
实验所用健康日本对虾[体重: (14.24±1.12 g)]取自山东省昌邑市海丰水产养殖有限责任公司。对虾在200 L的PVC桶中经7d适应性暂养, 暂养水温28℃、盐度28、pH 8.0。暂养期间持续充氧, 每天早晚定时投喂2次并更换1/3的海水, 以保持水质良好。
1.2 日本对虾Bcl-2基因cDNA全长的克隆
从日本对虾转录组数据库里查找、筛选得到Bcl-2基因的序列, 使用Primer Premier5.0设计引物(表 1)。利用巢氏PCR扩增法对Bcl-2基因进行克隆。将获得的 PCR 产物切胶回收、载体连接并转化、菌落 PCR鉴定、送样测序。
表 1 本实验所用引物序列Table 1. Primers used in this study引物 Primer 序列 Sequence (5′—3′) 用途 Usage MjBcl-2 F1 AGAACGCACTTTGCTACGCTG 3′ RACE MjBcl-2 F2 GTGGCACCATTTGTCAGAAGAG 3′ RACE MjBcl-2 R1 CAGCGTAGCAAAGTGCGTTCT 5′ RACE MjBcl-2 R2 CCTTATCCCTTGGCGACCTTC 5′ RACE UPM(short) CTAATACGACTCACTATAGGGC RACE UPM(long) CTAATACGACTCACTATAGGGCAAGCAGTGGTATCAACGCAGAGT RACE NUP AAGCAGTGGTATCAACGCAGAGT RACE MjBcl-2 F TCTCAAAATGGCTCCCG qRT-PCR MjBcl-2 R GTCACTGTCGCTCACACTAC qRT-PCR MjCaspase-3 F TACCCTGGAGCTTTGGGTGAA qRT-PCR MjCaspase-3 R GTTCACGCCCTTATCCACGTC qRT-PCR β-actin-F TCCACGAGACCACATACAAC qRT-PCR β-actin-R CACTTCCTGAACGATTGA qRT-PCR 1.3 日本对虾Bcl-2基因的生物信息学分析
对日本对虾Bcl-2基因进行序列分析(表 2)。
表 2 生物信息学所用网址及软件Table 2. URLs and software for bioinformatics analysis网址/软件URLs/Software 用途Purpose DNAMAN 氨基酸序列比对 MEGA7 构建物种NJ进化树 https://www.ncbi.nlm.nih.gov/
Blast.cgi分析物种同源性 https://www.ncbi.nlm.nih.gov/
orffinder查找目的基因开放阅读框区域 http://smart.embl-heidelberg.de/ 预测蛋白质结构域 http://www.cbs.dtu.dk/services/
TMHMM/预测蛋白质跨膜情况 http://web.expasy.org/computepi/ 分析蛋白质特性 http://www.cbs.dtu.dk/services/
SignalP/预测信号肽 1.4 低温胁迫
本实验设置4个温度梯度: 10℃、16℃、22℃和28℃。降温实验在200 mm×300 mm×170 mm的水族缸中进行, 水体体积为9 L。使用冷凝机(GRTE- HXB10N, 格瑞特节能设备有限公司)调节水温, 各个温度组经过12h, 由28℃同时降至所设置的温度, 每组3个平行, 每个平行20尾虾。在低温胁迫前(0)和低温胁迫 3h、24h和72h后取日本对虾的鳃和肝胰腺置于液氮中速冻, 用于基因的表达分析。
1.5 siRNA干扰
本实验所用到的siRNA均由上海生工用化学方法进行合成, 为确保合成siRNA具有较好的干扰效果, 用Bcl-2基因设计合成3对siRNA, 设计的双链siRNA有以下特征: 正向链 21碱基是在19个碱基的靶序列加上3′端2悬头TT的碱基; 反向链21碱基是19个与正向链互补的碱基, 3′端加2个碱基的悬头TT。合成的RNA oligo剂型为冻干粉。
本研究在siRNA干扰后在10℃ 和28℃两个温度梯度中进行温度实验, 每个温度梯度分为两组, 分别为RNAi组和NC处理组。将日本对虾按量均匀分组, 在对虾的第四尾节处按照1 µg/g虾的量进行siRNA的注射, 对照组注射NC阴性对照(无意义的双链) , 分别在胁迫后的3h、12h和48h(取48h时要在24h再注射一次) 取9尾日本对虾鳃组织并编号保存于液氮中用于RNA提取。
1.6 日本对虾Bcl-2基因的表达分析
参照TransZol Up Plus RNA Kit试剂盒(全式金公司)说明书提取总RNA, 经1%琼脂糖凝胶电泳检测RNA的完整性。使用Evo M-MLV RT Mix Kit (艾科瑞公司)进行模板制备, 具体步骤参照说明书, 反转录后的cDNA用于日本对虾Bcl-2基因的表达特征分析。本实验通过实时荧光定量PCR对Bcl-2基因进行组织表达分析, 检测不同温度、不同时间下的日本对虾鳃和肝胰腺中Bcl-2基因的表达量, 实验所用引物见表 1。实时荧光定量PCR通过使用Applied BiosystemsTM 7500 Real Time PCR instrumen定量仪完成。具体实验步骤参照SYBR® Green Pro TaqHS 预混型qPCR试剂盒Ⅱ(艾科瑞公司)。反应完成后, 采用 Excel[17]进行统计, 并用2−∆∆Ct法计算目的基因的相对表达量, 使用SPSS 19.0 软件进行差异显著性分析, P<0.05 表示差异显著。
1.7 TUNEL检测
本实验所用TUNEL试剂盒购自罗氏公司, 具体方法参照试剂盒说明书。实验步骤如图 1所示。
2. 结果
2.1 Bcl-2基因的cDNA全长及序列同源性分析
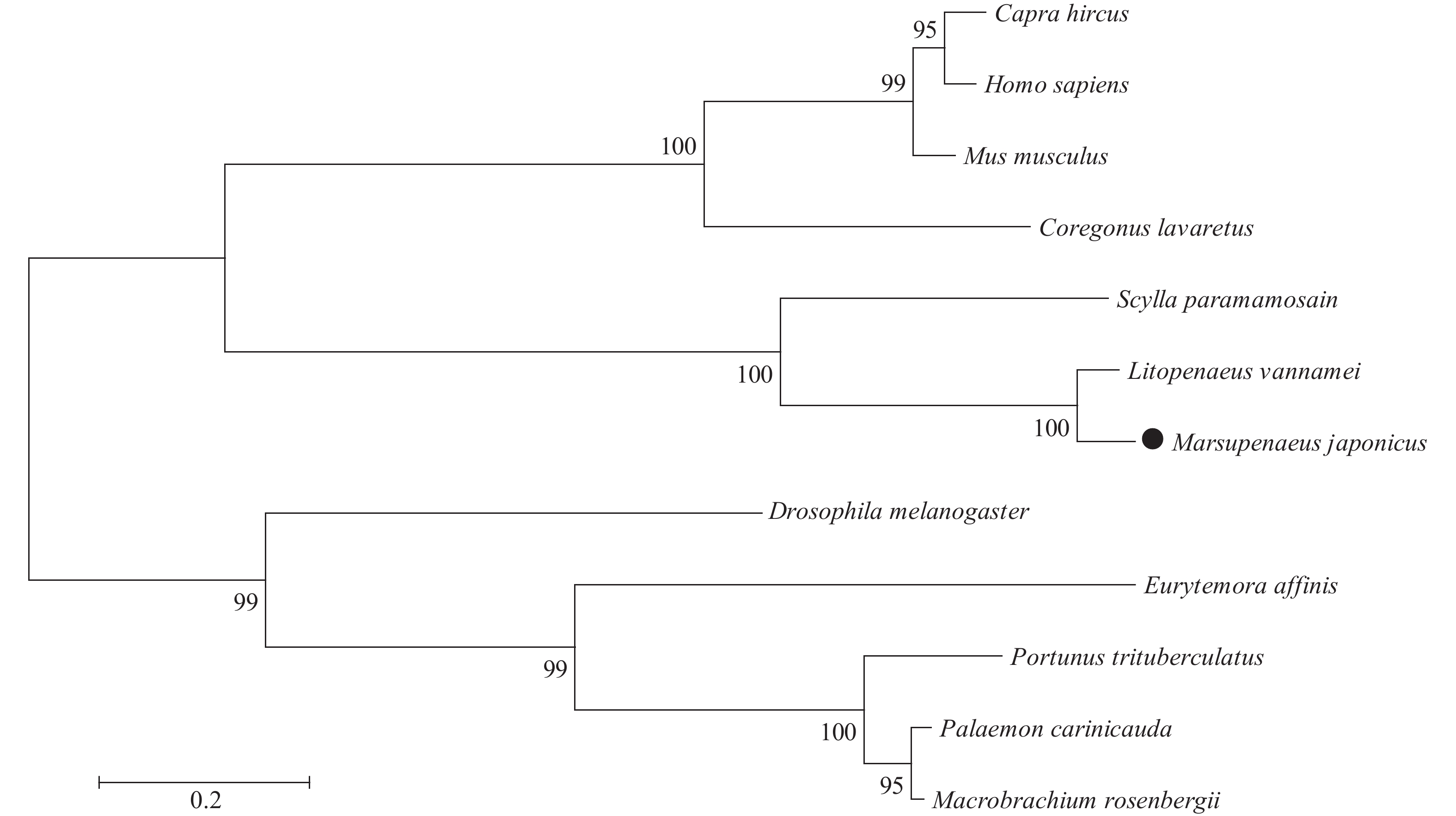
实验获得的日本对虾Bcl-2基因(GenBank登录号MW000345) cDNA全长为2432 bp, 其中ORF为726 bp, 共编码241个氨基酸, 5′UTR长度为269 bp, 3′UTR长度为1437 bp, 并且含有典型的加尾信号aataaa。3′UTR包含一个30 bp的polyA序列。预测理论等电点为5.90, 分子量为26.80 kD, 且不稳定系数为63.87, 推测为不稳定蛋白质。SMART和Signal4.1 在线软件预测结果显示, MjBcl-2基因具有Bcl-2 基因家族的典型特征, 即存在BCL 结构域, 并且在 C 端有一个跨膜结构域。Blast在线软件比对结果显示, 日本对虾Bcl-2氨基酸序列与凡纳滨对虾 (Litopenaeus vannamei) 的同源性最高为76%。使用MEGA 6.0 软件对日本对虾Bcl-2基因进行系统进化分析(图 1), 与凡纳滨对虾和斑节对虾 (Penaeus monodon) 聚为一支, 亲缘关系较近, 而与其他脊椎动物等进化关系较远(图 2)。
2.2 日本对虾Bcl-2基因的组织表达分析
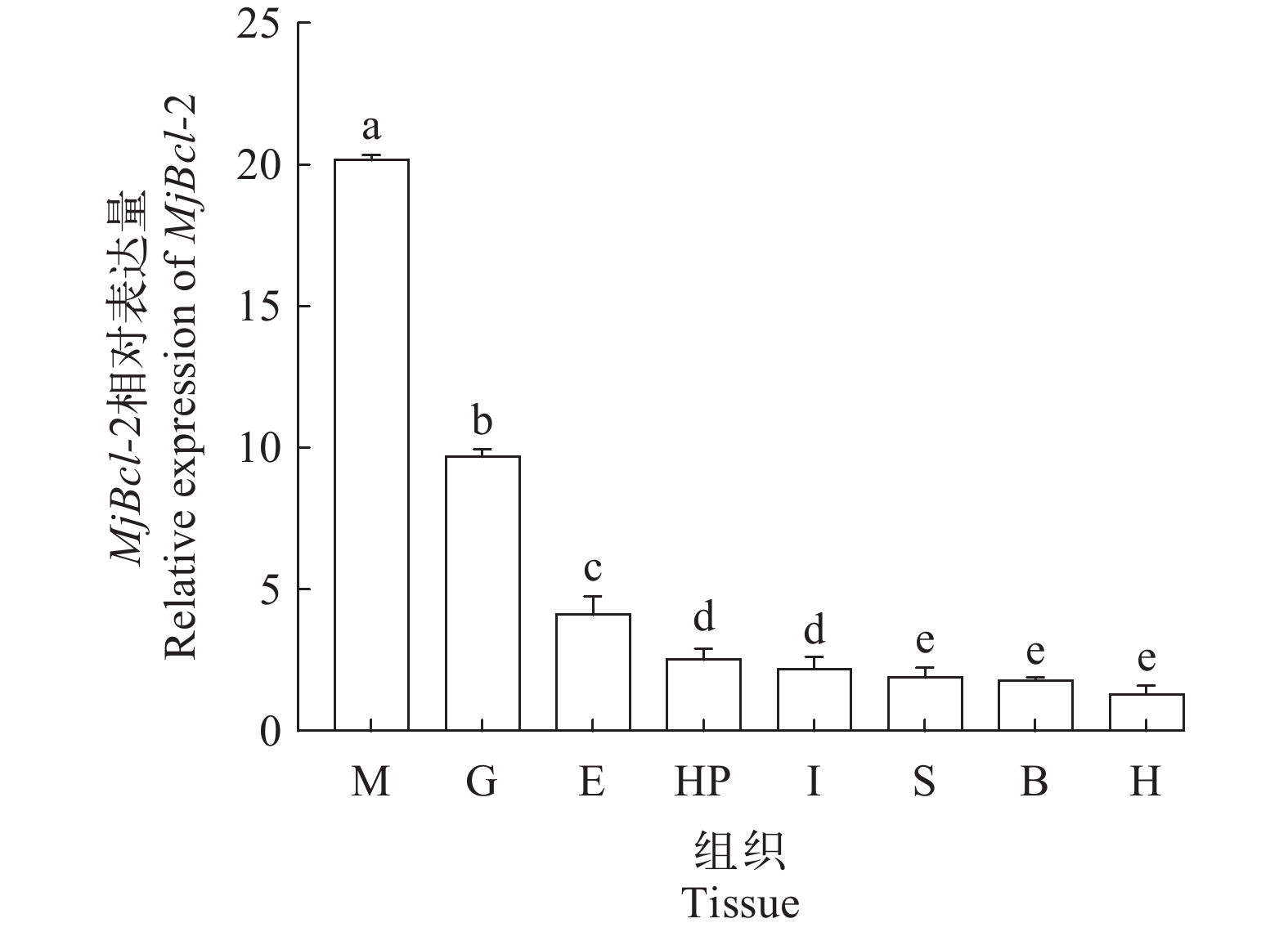
对日本对虾眼柄、鳃、肌肉、肝胰腺、心脏、胃、肠和血细胞组织, 进行Bcl-2基因的荧光定量检测, 结果表明, Bcl-2基因在所检测8个组织中均有不同水平的表达, 其中在肌肉中表达量最高, 然后依次是鳃、眼柄、肝胰腺、肠、胃、血细胞和心脏中表达量最低。
2.3 日本对虾Bcl-2基因在低温胁迫下的表达分析
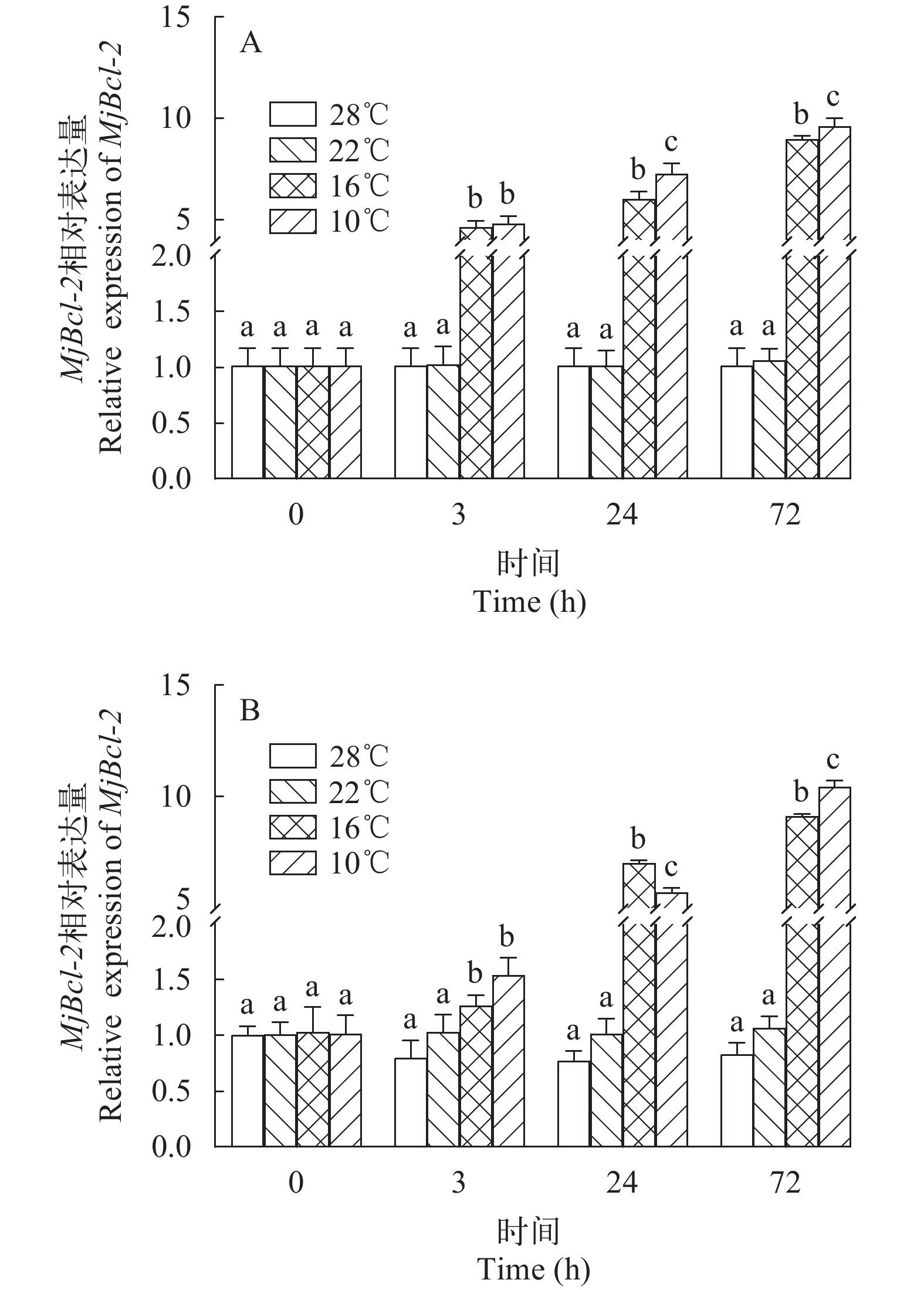
日本对虾在低温胁迫后Bcl-2基因表达情况如图 3所示, 不同温度胁迫后, Bcl-2基因的表达发生了明显变化。在10℃和16℃胁迫下, 鳃和肝胰腺中的Bcl-2基因的表达水平呈上升趋势, 72h时到达峰值, 在各时间点均显著高于对照组(P<0.05); 22℃胁迫下Bcl-2基因表达水平与对照组比无显著差异。
![]() 图 3 日本对虾Bcl-2基因在各组织中的表达M. 肌肉; G. 鳃; E. 眼柄; HP. 肝胰腺; I. 肠; S. 胃; B. 血细胞; H. 心脏. 柱上不同字母代表不同组织中差异显著(P<0.05)Figure 3. Distribution of Bcl-2 gene expression in different tissues of M. japonicusM. muscle; G. gill; E. eyestalk; HP. hepatopancreas; I. intestines; S. stomach; B. blood; H. heart. Different letters on the column represent significant differences in different tissues (P<0.05)
图 3 日本对虾Bcl-2基因在各组织中的表达M. 肌肉; G. 鳃; E. 眼柄; HP. 肝胰腺; I. 肠; S. 胃; B. 血细胞; H. 心脏. 柱上不同字母代表不同组织中差异显著(P<0.05)Figure 3. Distribution of Bcl-2 gene expression in different tissues of M. japonicusM. muscle; G. gill; E. eyestalk; HP. hepatopancreas; I. intestines; S. stomach; B. blood; H. heart. Different letters on the column represent significant differences in different tissues (P<0.05)2.4 siRNA干扰后的低温胁迫实验
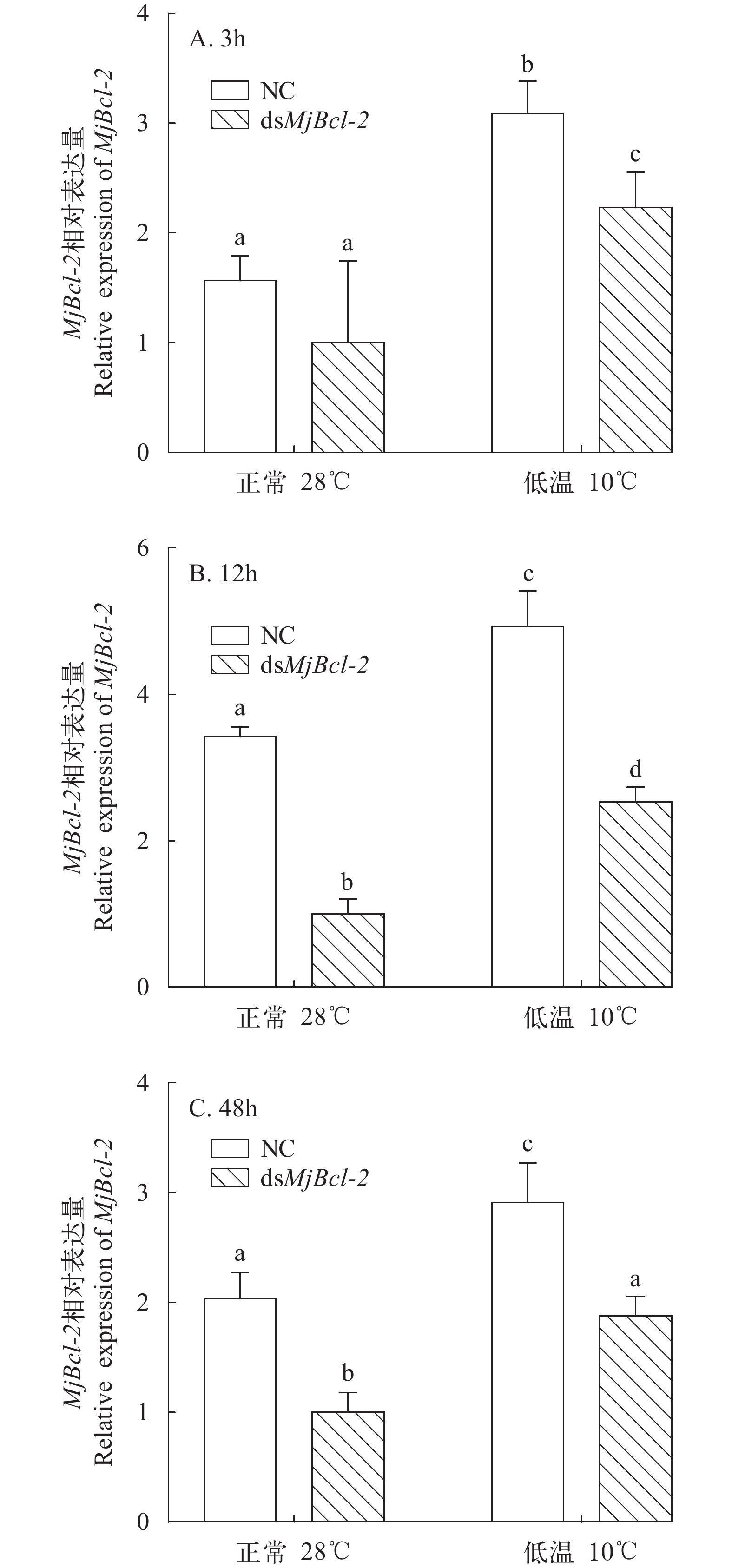
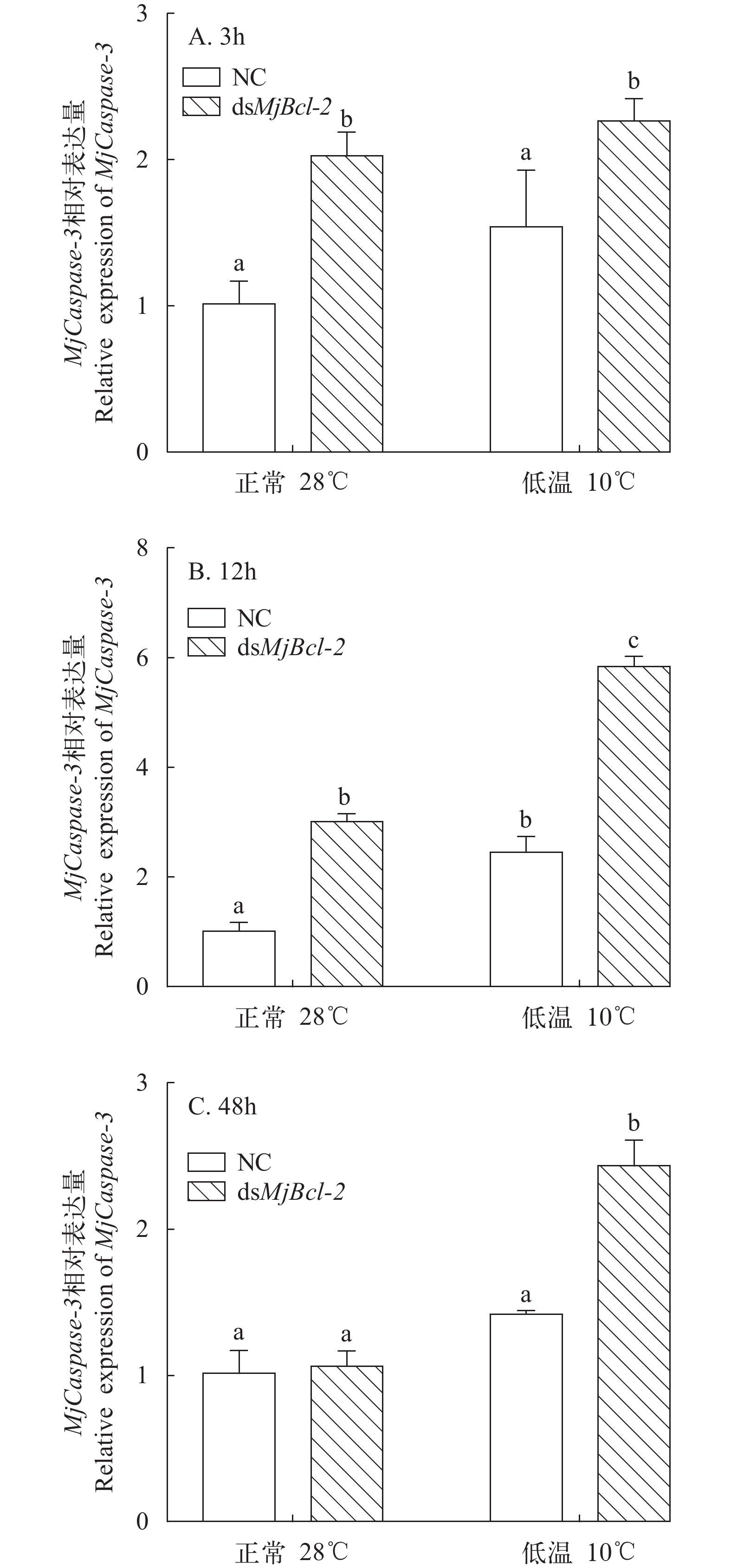
对Bcl-2基因进行干扰, 在低温胁迫后, Bcl-2基因和Caspase-3基因的表达在鳃组织中均发生了明显变化(图 4)。在Bcl-2基因被干扰后下调表达时, Caspase-3基因的表达量显著上调(P<0.05; 图 5)。由此推测, Bcl-2基因对Caspase-3基因有调控作用, 为负反馈调节的作用。
![]() 图 4 日本对虾鳃和肝胰腺Bcl-2基因相对表达量随低温胁迫时间的变化A. 鳃; B. 肝胰腺. 不同字母间表示差异显著(P<0.05), 下同Figure 4. Relative expression of Bcl-2 gene in gill and hepatopancreas of M. japonicus under low temperature stressA. gills; B. hepatopancreas. Different superscripts indicate significant difference (P<0.05). The same applies below
图 4 日本对虾鳃和肝胰腺Bcl-2基因相对表达量随低温胁迫时间的变化A. 鳃; B. 肝胰腺. 不同字母间表示差异显著(P<0.05), 下同Figure 4. Relative expression of Bcl-2 gene in gill and hepatopancreas of M. japonicus under low temperature stressA. gills; B. hepatopancreas. Different superscripts indicate significant difference (P<0.05). The same applies below2.5 TUNEL检测结果
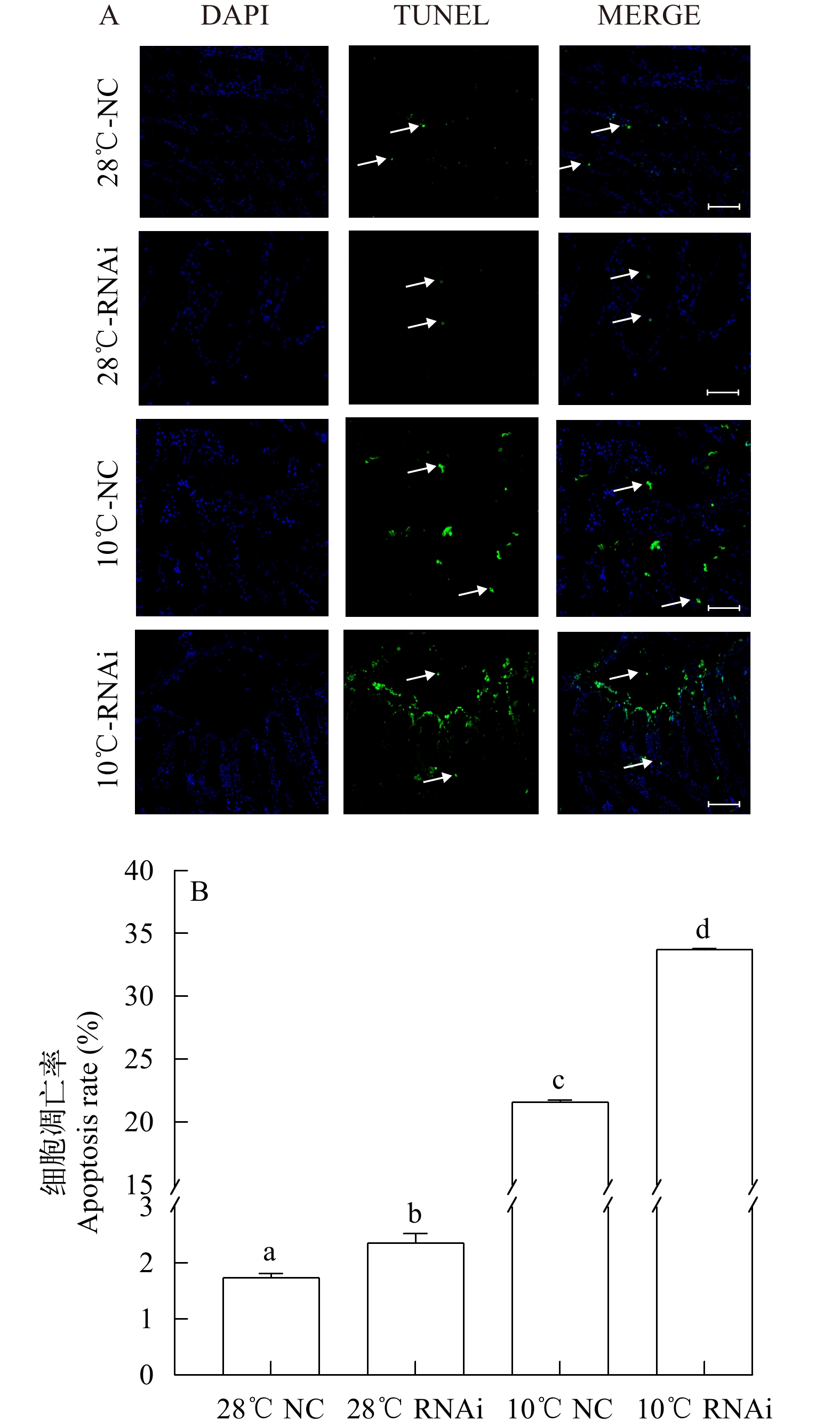
TUNEL结果显示, 在28℃处理组中只有少量凋亡细胞, RNAi组和NC组随着温度的降低, 凋亡细胞数量不断增加。28℃ RNAi组与NC组凋亡细胞的数量没有明显的数量变化, 而在10℃低温处理组中, 可以看到, RNAi组凋亡细胞的数量明显高于NC处理组(图 6A)。图 6B为鳃细胞凋亡率(凋亡细胞数/总细胞数) 统计结果, 在12h后, 28℃ NC组、28℃ RNAi组、10℃ NC组和10℃ RNAi组细胞凋亡率分别为1.73%、2.35%、21.59%和33.70%(图 7)。
3. 讨论
内源性细胞凋亡通路作为调控细胞凋亡的重要通路, 在维持机体正常生命活动中发挥着重要的作用, 哺乳动物的内源性细胞凋亡通路调控机体的免疫应答[18, 19]。本研究通过RACE技术成功克隆得到了日本对虾MjBcl-2 cDNA序列全长2432 bp, 其中, ORF为726 bp, 共编码241个氨基酸。多序列比对结果表明, MjBcl-2具有与其他无脊椎动物高度相似的保守的 Bcl 结构域。MjBcl-2氨基酸序列与凡纳滨对虾的同源性最高为76%。构建系统进化树显示, 日本对虾MjBcl-2基因与凡纳滨对虾和斑节对虾聚为一支, 与拟穴青蟹 (Scylla paramamosain)聚为一类, 说明日本对虾MjBcl-2基因在进化上是一个高度保守的基因, 与王磊等[20]对三疣梭子蟹 (Portunus trituberculatus) Bcl-2基因研究的结果一致。
研究某基因功能的基本手段之一是了解该基因在不同组织器官中的表达模式[21]。荧光定量PCR结果显示, MjBcl-2基因在日本对虾各个组织中均有表达, 肌肉中表达量最高, 其次为鳃, 心脏中表达量最低。在甲壳动物中, 鳃作为重要的免疫器官, 在非特异性免疫过程中发挥着重要的作用[22]。MjBcl-2在鳃组织中高表达, 表明其参与了日本对虾的免疫调控过程。为验证MjBcl-2是否参与了日本对虾温度胁迫过程, 进行了低温胁迫实验, 并检测了日本对虾在低温胁迫后不同时间点在鳃和肝胰腺组织中mRNA的表达情况。实验结果显示: 低温胁迫后, Bcl-2基因的表达发生了明显变化。在10℃和16℃胁迫下, 鳃和肝胰腺中的Bcl-2基因的表达水平逐渐上升, 在72h到达峰值, 在各时间点均显著高于对照组(P<0.05); 22℃胁迫下Bcl-2基因表达水平与对照组无显著差异。因此, 推断MjBcl-2基因参与了日本对虾温度胁迫过程。该结果与细菌感染后, 暗纹东方鲀 (Takifugu obscurus) 肝脏中Bcl-2 mRNA呈先上升后下降趋势[23]; 草鱼 (Ctenopharyngodon idella) Bcl-2基因在应对镉胁迫的过程中表达量显著上调 (P<0.05) [24]的结果相似。凡纳滨对虾在低温应激1.5h后, 抗凋亡基因LvBcl-2上调 (0.69倍, P<0.01) [25], 与MjBcl-2在受到低温胁迫后的结果较相似。因为其与日本对虾在进化关系上聚为一支, 推测在甲壳动物中Bcl-2 基因在受到相同刺激后的表达模式具有相似性。
为进一步验证日本对虾MjBcl-2基因的功能机制, 利用 RNA 干扰技术对MjBcl-2基因进行沉默, 在低温胁迫后, 分别检测了日本对虾Bcl-2和caspase-3基因的表达情况发现, 当对Bcl-2基因进行干扰时, 日本对虾鳃组织中的Bcl-2基因呈下调表达, 而caspase-3基因呈上调表达, 与张云滨等[12]在三疣梭子蟹中的干扰Bcl-2基因, 进而影响凋亡通路相关基因的结果一致。有研究表明, 在氨胁迫下鲤肝胰腺的凋亡可能是由氧化应激通过p53-Bax/Bcl-2凋亡信号通路介导的[16]。推测日本对虾Bcl-2基因也可能调控caspase-3基因, 但还需要进一步验证。
利用TUNEL技术, 检测了MjBcl-2基因被干扰后, 日本对虾鳃组织中细胞凋亡的变化。结果显示, 在日本对虾MjBcl-2基因被干扰后, 鳃组织中细胞凋亡的数量明显增加, 与刺参Bcl-2基因在被敲除后体腔细胞凋亡率显著增加[14]的结果相同。这说明, 日本对虾MjBcl-2基因参与了细胞凋亡过程。在本研究中, 与正常温度相比, 低温胁迫下的干扰组凋亡细胞要远远高于对照组, 猜测MjBcl-2基因被干扰后, 鳃组织中的识别机制遭到破坏, 凋亡细胞无法及时清除, 在鳃组织内逐渐积累。
4. 结论
细胞凋亡是由一系列基因的激活、表达以及调控所控制的自主死亡过程, 其在机体免疫和维持内环境稳定中起着非常重要的作用[26-28]。Bcl-2 家族基因是影响线粒体凋亡途径的重要因素之一, 其中 Bcl-2基因极其重要, 作用主要是抑制细胞凋亡的发生[29]。Caspase 蛋白酶家族在细胞凋亡过程中发挥着重要作用, 它们是细胞凋亡过程中的具体执行者, 通过接受外界信号,以此来完成对特定蛋白底物的水解, 从而使细胞凋亡[30]。本实验表明日本对虾MjBcl-2基因可能参与了温度胁迫下的细胞凋亡过程, 至于具体的调控过程, 目前尚不完全清楚。推测当日本对虾受到温度胁迫时, 其体内的神经内分泌系统通过传导信号, 引起相关信号通路的变化, 对外界刺激进行应对。在今后的工作当中, 通过对相关信号通路的研究, 探究日本对虾Bcl-2具体功能, 为培育日本对虾耐低温新品种提供理论基础。
-
图 3 日本对虾Bcl-2基因在各组织中的表达
M. 肌肉; G. 鳃; E. 眼柄; HP. 肝胰腺; I. 肠; S. 胃; B. 血细胞; H. 心脏. 柱上不同字母代表不同组织中差异显著(P<0.05)
Figure 3. Distribution of Bcl-2 gene expression in different tissues of M. japonicus
M. muscle; G. gill; E. eyestalk; HP. hepatopancreas; I. intestines; S. stomach; B. blood; H. heart. Different letters on the column represent significant differences in different tissues (P<0.05)
图 4 日本对虾鳃和肝胰腺Bcl-2基因相对表达量随低温胁迫时间的变化
A. 鳃; B. 肝胰腺. 不同字母间表示差异显著(P<0.05), 下同
Figure 4. Relative expression of Bcl-2 gene in gill and hepatopancreas of M. japonicus under low temperature stress
A. gills; B. hepatopancreas. Different superscripts indicate significant difference (P<0.05). The same applies below
表 1 本实验所用引物序列
Table 1 Primers used in this study
引物 Primer 序列 Sequence (5′—3′) 用途 Usage MjBcl-2 F1 AGAACGCACTTTGCTACGCTG 3′ RACE MjBcl-2 F2 GTGGCACCATTTGTCAGAAGAG 3′ RACE MjBcl-2 R1 CAGCGTAGCAAAGTGCGTTCT 5′ RACE MjBcl-2 R2 CCTTATCCCTTGGCGACCTTC 5′ RACE UPM(short) CTAATACGACTCACTATAGGGC RACE UPM(long) CTAATACGACTCACTATAGGGCAAGCAGTGGTATCAACGCAGAGT RACE NUP AAGCAGTGGTATCAACGCAGAGT RACE MjBcl-2 F TCTCAAAATGGCTCCCG qRT-PCR MjBcl-2 R GTCACTGTCGCTCACACTAC qRT-PCR MjCaspase-3 F TACCCTGGAGCTTTGGGTGAA qRT-PCR MjCaspase-3 R GTTCACGCCCTTATCCACGTC qRT-PCR β-actin-F TCCACGAGACCACATACAAC qRT-PCR β-actin-R CACTTCCTGAACGATTGA qRT-PCR 表 2 生物信息学所用网址及软件
Table 2 URLs and software for bioinformatics analysis
网址/软件URLs/Software 用途Purpose DNAMAN 氨基酸序列比对 MEGA7 构建物种NJ进化树 https://www.ncbi.nlm.nih.gov/
Blast.cgi分析物种同源性 https://www.ncbi.nlm.nih.gov/
orffinder查找目的基因开放阅读框区域 http://smart.embl-heidelberg.de/ 预测蛋白质结构域 http://www.cbs.dtu.dk/services/
TMHMM/预测蛋白质跨膜情况 http://web.expasy.org/computepi/ 分析蛋白质特性 http://www.cbs.dtu.dk/services/
SignalP/预测信号肽 -
[1] 麦贤杰, 黄伟健, 叶富良. 对虾健康养殖学 [M]. 北京: 海洋出版社, 2009. Mai X J, Huang W J, Ye F L. Healthy Shrimp Culture [M]. Beijing: Ocean Press, 2009.
[2] 宋盛宪, 翁雄. 日本对虾健康养殖 [M]. 北京: 海洋出版社, 2004. Song S X, Weng X. Healthy Culture of Marsupenaeus japonicus [M]. Beijing: Ocean Press, 2004.
[3] 李丽君, 宋晓红, 林瑶琼, 等. 日本囊对虾耐热性状及其与凡纳滨对虾、脊尾白虾的比较 [J]. 中国水产科学, 2015, 22(3): 8. Li L J, Song X H, Lin Y Q, et al. Heat tolerance of Marsupenaeus japonicus and its comparison with Litopenaeus vannamei and white shrimp with ridge tail [J]. China Fisheries Science, 2015, 22(3): 8.
[4] 李颖翔. 长牡蛎内源性细胞凋亡通路及VDAC2基因功能的研究 [D]. 青岛: 中国科学院海洋研究所, 2016: 4-7. Li Y X. Elucidation of mitochondrial apoptosis pathway and functional characterization of voltage-dependent anion channel 2(VDAC2) in Pacific oyster [D]. Qingdao: Institute of Oceanography, Chinese Academy of Sciences, 2016: 4-7.
[5] Brunelle J K, Letai A. Control of mitochondrial apoptosis by the bcl-2 family [J]. Journal of Cell Science, 2009, 122(4): 437-441. doi: 10.1242/jcs.031682
[6] Liu X, Kim C N, Yang J, et al. Induction of apoptotic program in cell-free extracts: requirement for dATP and cytochrome C [J]. Cell, 1996, 86(1): 147-157. doi: 10.1016/S0092-8674(00)80085-9
[7] Acehan D, Jiang X, Morgan D G, et al. Three-dimensional structure of the apoptosome: implications for assembly, procaspase-9 binding, and activation [J]. Molecular Cell, 2002, 9(2): 423-432. doi: 10.1016/S1097-2765(02)00442-2
[8] Raff M. Cell suicide for beginners [J]. Nature, 1998, 396(6707): 119. doi: 10.1038/24055
[9] Adams J M, Cory S. The Bcl-2 protein family: arbiters of cell survival [J]. Science, 1998, 281(5381): 1322-1326. doi: 10.1126/science.281.5381.1322
[10] Burlacu A. Regulation of apoptosis by Bcl-2 family proteins [J]. Journal of Cellular and Molecular Medicine, 2003, 7(3): 249-257. doi: 10.1111/j.1582-4934.2003.tb00225.x
[11] Griffiths G J, Dubrez L, Morgan C P, et al. Cell damage-induced conformational changes of the pro-apoptotic protein Bak in vivo precede the onset of apoptosis [J]. The Journal of Cell Biology, 1999, 144(5): 903-914. doi: 10.1083/jcb.144.5.903
[12] 张云滨. 三疣梭子蟹JNK/Bcl-2通路中相关凋亡基因的功能研究 [D]. 上海: 上海海洋大学, 2020: 49-50. Zhang Y B. The function of apoptosis genes in JNK/bcl-2 pathway of Portunus trituberculatus [D]. Shanghai: Shanghai Ocean University, 2020: 49-50.
[13] Chipuk J E, Green D R. How do BCL-2 proteins induce mitochondrial outer membrane permeabilization [J]? Trends in Cell Biology, 2008, 18(4): 157-164. doi: 10.1016/j.tcb.2008.01.007
[14] Guo M, Chen K, Lv Z, et al. Bcl-2 mediates coelomocytes apoptosis by suppressing cytochrome c release in Vibrio splendidus challenged Apostichopus japonicus [J]. Developmental & Comparative Immunology, 2020(103): 103533.
[15] Cao J, Chen J, Wang J, et al. Effects of fluoride on liver apoptosis and Bcl-2, Bax protein expression in freshwater teleost, Cyprinus carpio [J]. Chemosphere, 2013, 91(8): 1203-1212. doi: 10.1016/j.chemosphere.2013.01.037
[16] Xue S, Lin J, Han Y, et al. Ammonia stress–induced apoptosis by p53–BAX/BCL-2 signal pathway in hepatopancreas of common carp (Cyprinus carpio) [J]. Aquaculture International, 2021, 29(4): 1895-1907. doi: 10.1007/s10499-021-00724-3
[17] Somboonna N, Mangkalanan S, Udompetcharaporn A, et al. Mud crab susceptibility to disease from white spot syndrome virus is species-dependent [J]. BMC Research Notes, 2010, 3(1): 315. doi: 10.1186/1756-0500-3-315
[18] Fulda S, Debatin K M. Extrinsic versus intrinsic apoptosis pathways in anticancer chemotherapy [J]. Oncogene, 2006, 25(34): 4798-4811. doi: 10.1038/sj.onc.1209608
[19] Lindsten T, Ross A J, King A, et al. The combined functions of proapoptotic bcl-2 family members bak and bax are essential for normal development of multiple tissues [J]. Molecular Cell, 2000, 6(6): 1389-1399. doi: 10.1016/S1097-2765(00)00136-2
[20] 王磊. 三疣梭子蟹在低盐和病原胁迫后相关凋亡基因的功能研究 [D]. 上海: 上海海洋大学, 2019: 20-22. Wang L. Function of apoptotic genes in Portunus trituberculatus under low salt and pathogenic stress [D]. Shanghai: Shanghai Ocean University, 2019: 20-22.
[21] 房晓宸, 卢金昭, 梁海鹰, 等. 马氏珠母贝Bcl-2-like基因克隆及其功能初探 [J]. 水产学报, 2021, 45(5): 661-671. Fang X C, Lu J Z, Liang H Y, et al. Cloning and preliminary study on the function of Bcl-2-like gene in Pinctada fucata martensii [J]. Journal of Fisheries of China, 2021, 45(5): 661-671.
[22] 李光, 樊景凤, 林凤翱, 等. 对虾的免疫机制及其疾病免疫预防的研究进展 [J]. 水产科学, 2007, 26(1): 56-60. doi: 10.3969/j.issn.1003-1111.2007.01.013 Li G, Fan J F, Lin F G, et al. Research progress on immune mechanism and immunoprophylaxis of diseases in shrimp [J]. Fisheries Science, 2007, 26(1): 56-60. doi: 10.3969/j.issn.1003-1111.2007.01.013
[23] 程长洪. 暗纹东方鲀对温度、氨氮胁迫的生理响应及其营养调控研究 [D]. 广州: 华南师范大学, 2016: 28-30. Cheng C H. Physiological response and nutritional regulation of Takifugu obscurus to temperature and ammonia stress [D]. Guangzhou: South China Normal University, 2016: 28-30.
[24] 李海军. 草鱼凋亡相关基因Caspase-9和Bcl-2克隆、原核表达及其在镉胁迫下表达分析 [D]. 南昌: 江西师范大学, 2016: 36-37. Li H J. Cloning, prokaryotic expression and expression analysis of apoptosis related genes Caspase-9 and Bcl-2 from Ctenopharyngodon idellus exposed to cadmium [D]. Nanchang: Jiangxi Normal University, 2016: 36-37.
[25] Hu R, Dong W, Liang Q, et al. A Litopenaeus vannamei p70S6K gene is involved in the antioxidative and apoptosis under low temperature [J]. Fish & Shellfish Immunology, 2020, 106: 656-665.
[26] Ameisen J C. On the origin, evolution, and nature of programmed cell death: a timeline of four billion years [J]. Cell Death & Differentiation, 2002, 9(4): 367-393.
[27] Elmore S. Apoptosis: a review of programmed cell death [J]. Toxicologic Pathology, 2007, 35(4): 495-516. doi: 10.1080/01926230701320337
[28] Krakauer D C, Payne R J. The evolution of virus-induced apoptosis [J]. Proceedings Biological Sciences, 1997, 264(1389): 1757-1762. doi: 10.1098/rspb.1997.0243
[29] Münz C. Viral evasion of autophagy [J]. Cell Host & Microbe, 2007, 1(1): 9-11.
[30] 宋光年, 金松君, 张继泉, 等. 中国明对虾caspase基因的克隆与表达分析 [J]. 海洋科学, 2010, 34(12): 1-7. Song G N, Jin S J, Zhang J Q, et al. Cloning and expression of a caspase gene in Chinese shrimp Fenneropenaeus chinensis [J]. Marine Sciences, 2010, 34(12): 1-7.
-
期刊类型引用(0)
其他类型引用(1)



 下载:
下载: