THERMAL TOLERANCES AND COLLECTIVE BEHAVIOR DURING WATER TEMPERATURE RISING IN JUVENILE GRASS CARP (CTENOPHARYNGODON IDELLUS)
-
摘要: 为考察个体大小对升温过程中草鱼的耐高温能力和群体行为的影响, 研究以草鱼(Ctenopharyngodon idellus)幼鱼为实验对象, 结果显示: 大个体群体的个体游泳速度明显大于小个体群体(P=0.039), 个体间距离和最近邻距离显著高于小个体群体(P<0.001); 大个体鱼群的极性与小个体群体并无差异。虽然大个体群体的致死高温与小个体群体无差异, 但前者的临界高温显著大于小个体群体(P<0.001)。升温过程会使鱼群个体游泳速度变快, 个体间距离和最近邻距离也相应增加, 但游泳速度同步性和群体极性维持不变。研究表明: 个体大小的增加可增强草鱼幼鱼对环境水温的耐高温能力; 升温不会影响不同个体大小草鱼幼鱼群体的协调性, 但会降低草鱼幼鱼的群体凝聚力。Abstract: Global warming affects the survival, reproduction, collective behavior, and population dynamics of the fish. To examine thermal tolerance and collective behavior during the heating in the Cyprinidae fish, our study selected the juvenile grass carp (Ctenopharyngodon idellus) as the experimental fish. The thermal tolerance, individual swimming speed, synchronization of speed, inter-individual distance, and other behavioral parameters were obtained in both the large and small body size juvenile grass carp groups. Compared with the small body size group, the large body size group has higher swimming speed (P=0.039), higher inter-individual distance (P<0.001), higher nearest neighbor distance (P<0.001), and higher critical thermal maximum (P<0.001). There is no difference in the group polarization and lethal thermal maximum between the two groups. During the process of water temperature rising, individual swimming speed of the juvenile grass carp increased profoundly, while the inter-individual distance and nearest neighbor distance are also increased, but the synchronization of speed and the group polarization remained unchanged. These results showed that increase of individual body size can enhance the thermal tolerance of the juvenile grass carp. Water temperature rising do not affect the coordination of the juvenile grass carp group, but reduce the cohesion of the juvenile grass carp group.
-
Keywords:
- Body size /
- Water heating /
- Thermal tolerance /
- Collective behaviour /
- Cohesion /
- Coordination
-
水温是水生生态系统中影响鱼类生长、繁殖、生存与分布等方面的重要生态因子之一[1, 2]。随着全球气候变暖的加剧, 迫切需要研究者对鱼类的热耐受性和温度适应性等问题进行更加全面的研究[3]。热耐受能力是鱼类在面对环境水温变化时生存能力的重要体现, 在鱼类的温度适应能力及其可塑性、种群的地理分布及在热排水的热耐受能力评估等方面具有重要的研究价值[4-6]。鱼类热耐受的前期相关研究主要集中于升降温模式和性别对鱼类热耐受能力的影响[7-9]。这些前期研究主要是以个体大小相近的鱼类个体为观测对象, 有助于排除个体大小(或体重)对热耐受能力评估的影响。然而, 目前有关个体大小对鱼类热耐受影响的研究仍然较少[10,11]。此外, 在全球气候整体变暖的大环境下, 水温升高必将是大部分鱼类所面临的严峻考验与挑战, 影响个体生存与繁衍以及种群动态。因此, 本研究第一个目标是考察个体大小对鱼类耐高温能力的影响。
群体行为在动物界中是广泛存在的, 据估计有多达万种以上的鱼类在其整个生活史或生活史的某个阶段会出现群体行为[12, 13]。群体行为一方面有助于提高鱼类个体获取的生态收益, 如降低被捕食风险、提高觅食效率和繁殖成功率等[14-16]; 另一方面也会带来风险代价, 如增强食物和配偶资源的竞争程度, 提高寄生虫的传染概率等[17]。鱼类个体间如何交互作用形成群体水平的行为特征是研究群体行为的核心问题[18, 19], 主要的群体行为特征包括凝聚力(Cohesion)和协调性(Coordination)。凝聚力主要通过个体间距离(Inter-individual distance, IID)和最近邻距离(Nearest neighbor distance, NND)来衡量[20, 21], 而协调性通常通过不同个体间的游泳速度同步性和鱼群排列的极性(Polarization)等来衡量[22, 23]。理论上分析, 自然界鱼群是由不同个体大小的群体成员所组成, 该个体大小的差异在群体生活中的生态收益和风险代价可能不尽相同, 由此在群体行为中发挥的作用及生态结果可能存在差异[24]。例如, 鳊(Parabramis pekinensis)和中华倒刺鲃(Spinibarbus sinensis)在鱼群中的个体偏好位置与个体大小有关, 大个体成员更偏好占据领头鱼的位置, 并且个体大小的差异会降低该两种鱼对环境刺激的反应率[24]。此外, 鱼类热耐受的早期研究主要是对单尾鱼进行热耐受观察实验, 但以多尾鱼组成的鱼群为观测单元的热耐受研究极为匮乏, 尤其是在升温过程中鱼类群体行为如何变化的研究尚未见报道。因此, 本研究第二个目标是考察升温过程中鱼类群体行为的变化规律。
草鱼(Ctenopharyngodon idellus)是一种典型的草食性鱼类, 也是我国常见的经济养殖鱼类, 常栖息于平原地区的江河湖泊, 偏好水体中下层和近岸多水草区域。该鱼种分布广泛, 性情活泼, 游泳迅速且具有明显的集群觅食行为。草鱼的生理生态学研究集中于该种鱼的低氧耐受、持续游泳能力、流速偏好、易钓性及糖代谢酶活性等方面[25-28]。为考察不同个体大小对鲤科鱼类的热耐受能力和升温过程中群体行为的影响, 本研究以草鱼幼鱼为实验对象, 设定个体大小(不同大小或相同大小, 以体重为衡量大小的指标)和升温模式(升温或恒温)的4个处理组, 每种处理的所有组均是以4尾组成的草鱼鱼群为观察单元, 比较并分析4个处理组的鱼群在升温前后群体行为的变化规律, 为鱼类热耐受、群体行为和生理保护等相关研究提供重要资料。
1. 材料与方法
1.1 实验鱼及其驯化
草鱼幼鱼购于重庆市北碚区人工养殖基地, 运回后在重庆师范大学进化生理与行为学实验室2个循环控温水槽中(约250 L)驯化2个月。在每个水槽底部安置一定数量的30 cm高的不同类型的人工水草, 以模拟该种鱼在自然水体的隐蔽场所并提高驯化水体的环境丰富度。在驯化期间, 于每天10:00用鲤科鱼类颗粒饲料(中国通威公司)对鱼饱足投喂1次。为减少充氧和循环水流动对鱼群摄食的影响, 在每次投喂前10min 关闭充气泵以使水面平静。投喂1h后, 用虹吸管清除水中残饵、残渣和粪便以维持驯化水体清洁。驯化用水为曝气4d的自来水, 日换水量约为水体总量的10%。溶氧水平维持在 7.0 mg/L以上, 光周期设定为14 L﹕10 D, 水体温度维持在室温(20.0±0.1)℃。
1.2 实验设计
在驯化结束后, 本研究挑选机体健康的大个体草鱼和小个体草鱼各80尾, 大个体的体重约小个体的3倍(表 1)。根据个体大小和升温模式, 本研究设定4个处理组: 大个体恒温组(保持室温20℃)、大个体升温组(1℃/min)、小个体恒温组(保持室温20℃)和小个体升温组(1℃/min)。由于4尾个体组成的鱼群可展现明显的集群行为[29], 所以本研究每个处理组的鱼群组成数量设定为4尾, 每个处理组含有10个鱼群。两个升温组的所有鱼群均执行以下步骤: 将禁食24h的单个鱼群转移至恒温水浴加热装置中适应10min, 随后按设定的升温速率(1℃/min)开始升温, 直至致死温度为止。两个恒温组的所有鱼群均执行以下步骤: 将禁食24h的单个鱼群转移至恒温水浴加热装置中适应10min, 然后将鱼群在水体中继续维持25min, 这个时间与升温组的所需时间相近。恒温水浴加热装置内的水温维持室温(20℃)。对于4个处理组而言, 在鱼群适应结束后, 位于升温设备正上方的摄像设备开始全程拍摄鱼群的群体行为。
表 1 草鱼幼鱼的形态学参数Table 1. The morphology of juvenile grass carp温度处理
Temperature
treatment个体大小
Body size体重
Body
weight
(g)体长
Body
length
(cm)肥满度
Condition
factor (g/cm3)恒温组
Constant
temperature group大个体 10.95±1.18 8.72±0.33 1.65±0.08 小个体 3.59±0.51 6.28±0.32 1.44±0.11 升温组
Heating group大个体 10.98±1.76 8.76±0.46 1.62±0.10 小个体 3.55±0.63 6.22±0.34 1.47±0.14 1.3 热耐受与群体行为
本研究采用2台恒温水浴加热装置(方形, 边长为32.0 cm)考察个体大小对草鱼幼鱼的耐高温能力和升温过程中群体行为的影响。实验装置的内壁和底部均为白色, 以增加鱼与环境之间的色差, 有助于提高视频分析软件的准确率。实验装置的水深为10 cm, 在离其底部5 cm处安置一块无毒的白色塑料底板, 故鱼群游泳的实际水深为5 cm, 以减少实验鱼个体在纵向空间的重叠概率。在每台装置的正上方50 cm处安置一个连接电脑的高清广角摄像头(Logitech Webcam Pro9000, 1080×720 p, 25帧/s, 中国罗技有限公司)用于拍摄鱼群的群体行为。在恒温水浴加热装置的四周安装有2.0 m高的白色布帘, 以获得稳定的拍摄环境并减少外部干扰。实验期间, 室内保持安静以减少声音对鱼的行为产生影响, 所有环境条件(如室温、水体溶氧、光照强度、光周期)的控制与驯化期间保持一致。
对于升温组而言, 将每个鱼群从养殖水槽的单元格转移至恒温水浴加热装置中适应10min, 随后按设定的升温速率(1℃/min)开始升温, 直至鱼群中最后一尾实验鱼鳃盖静止张闭为止。对于恒温组而言, 除升温外其他所步骤与升温组的实验步骤保持一致。本研究采用数字温度计(精度为0.1℃)监测恒温水浴加热装置的水温, 该温度计的数字显示器位于水浴加热装置边缘, 以垂直朝向摄像头方式固定安置, 处在拍摄视野范围之中。对视频中的每尾实验鱼进行行为的人工分析, 获取每尾实验鱼的临界高温和致死高温。为减少昼夜节律对群体行为的潜在影响, 每天实验时间安排于9: 00—16: 30。在每组实验结束后对实验水体进行更换, 以防止上一个鱼群在实验中产生的化学预警信息(Chemical alarm cues, CAC)对下一个鱼群的测试产生影响。此外, 更换用水用充氧泵充分充氧, 使实验水体的溶氧维持在较高的水平。水浴水体的溶氧水平从开始升温时9.04 mg/L下降至升温结束时的8.07 mg/L。因此实验结束时水体的溶氧水平仍属正常水平, 不会对实验鱼造成轻度胁迫而影响个体活动和群体行为。
1.4 实验参数及其计算
对于热耐受而言, 本研究临界高温和致死高温的判定标准: 在升温过程中, 将实验鱼开始出现机体失去平衡时的水温度作为临界高温(Critical thermal maximum, CTmax), 而将鳃盖停止活动10s以上所对应的水温作为致死高温(Lethal thermal maximum, LTmax)。对于群体行为而言, 本研究获取个体游泳速度(Velocity, V)、个体游泳速度同步性(Synchronization of speed, Sv)、个体间距离(Inter-individual distance, IID)、最近邻距离(Nearest neighbor distance, NND)和群体极性(Group polarization, P)5个行为参数。实验鱼肥满度的计算公式: CF=体重/体长3×100。
本研究先采用格式工厂将所有拍摄视频WMV格式转码成AVI格式, 然后再采用软件idTracker对转码后的视频进行分析, 获取每尾实验鱼在每帧(1/25s)的二维坐标数据(x, y轴像素值)。预备实验显示, 升温会使鱼群群体行为发生较大变化, 因此本研究分别截取每个实验视频升温前10min和开始升温后的10—20min来进行研究。根据像素将坐标数据与行为装置的实际大小(实际物体大小与像素的转换率为19.86像素/cm)换算成单尾实验鱼个体空间位置的实际坐标数据(cm), 再通过坐标数据计算群体行为实验参数。上述5个行为参数的计算公式如下所示:
(1)个体游泳速度(V)
$ V(t) = \frac{{\sqrt {{{[x(t) - x(t - 1)]}^2} + {{[y(t) - y(t - 1)]}^2}} }}{{{d_t}}} $
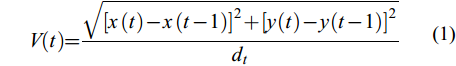
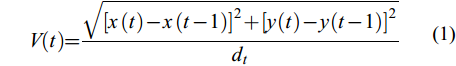
(1) 式中, V为个体游泳速度(cm/s), x(t)和x(t–1)分别为单尾鱼在t、t–1时刻的横坐标值; y(t)和y(t–1)分别为单尾鱼在t、t–1时刻的纵坐标值; dt为单尾鱼在紧邻两个坐标点的时间间隔(本研究设定为1/25s)。
(2)个体游泳速度同步性(Sv)
Sv评价个体游泳速度的同步性, 介于0—1。若该数值越大, 则个体游泳速度的同步性就越高。
$ {S_v} = 1 - \left| {\frac{{{v_i} - {v_j}}}{{{v_i} + {v_j}}}} \right| $
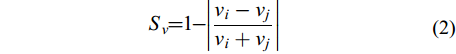
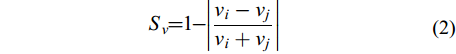
(2) 式中, Sv为个体游泳速度同步性(无单位), vi和vj为鱼群中第i、j尾鱼的瞬时个体游泳速度。
(3)个体间距离(IID)
IID表示鱼群中所有个体之间的平均距离(cm), 评价群体凝聚力。若该数值越小, 鱼群的群体凝聚力则越强。
$ {\text{IID }} (t) = \frac{1}{n} \sum\limits_{i \ne j}^n {\sqrt {{{[{x_i}(t) - {x_j}(t)]}^2} + {{[{y_i}(t) - {y_j}(t)]}^2}} } $
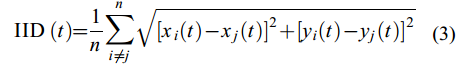
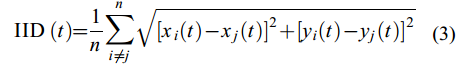
(3) 式中, IID为个体间距离(cm), xi和xj为鱼群中第i、j尾鱼在t时刻的横坐标值, yi和yj为鱼群中第i、j尾鱼在t时刻的纵坐标值, n为鱼群的成员数量(本研究为n=4)。
(4)最近邻距离(NND)
NND表示鱼群内某一尾鱼与其他所有鱼的距离中的最短距离(cm), 用以衡量群体凝聚力。
$ {\text{NND }} (t) = {\min _{i \ne j}}\sqrt {{{[{x_i}(t) - {x_j}(t)]}^2} + {{[{y_i}(t) - {y_j}(t)]}^2}} $
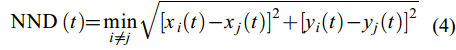
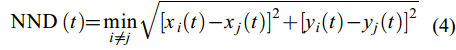
(4) 式中, NND为最近邻距离(cm), xi和xj为鱼群中第i、j尾鱼在t时刻的横坐标值, yi和yj为鱼群中第i、j尾鱼在t时刻的纵坐标值。
(5)极性(P)
极性评价鱼群个体排列的整齐程度, 介于0—1之间。当鱼群中所有个体以朝向绝对一致方向排列时, P值为1; 当鱼群中所有个体以方向相反且完全抵消的方式而排列时, P值为0。若极性的数值越高, 鱼群的协调能力则越强。
$ P(t) = \frac{1}{n}\left| {\sum\limits_{i = 1}^n {{v_i}(t)} } \right| $
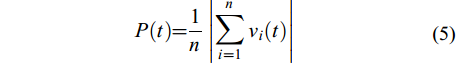
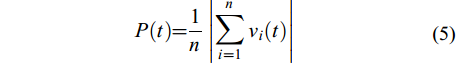
(5) 式中, vi (t)为单尾鱼i的单位时间内的运动向量, 运动方向是从t–1时刻的坐标点指向t时刻的位置坐标点。n表示群体成员数量, 本研究中n=4。
1.5 数据统计与分析
所有数据先用Excel(2010)进行计算并制图, 以平均值±标准差(Mean ± SD)表示, 然后再采用统计软件SPSS(19.0)进行统计分析, 显著性水平定为P<0.05。本研究采用独立T-检验考察大个体的临界高温和致死高温与小个体的差异。本研究采用三因素方差分析(Three-ways analysis of variance)的线性模型考察升温模式、个体大小和测定时间对草鱼个体游泳速度、个体游泳速度同步性、个体间距离、最近邻距离和极性的影响。若该线性模型发现组间存在显著差异, 则再采用T-检验分析个体大小处理或升温时间的统计学差异。
2. 结果
2.1 草鱼幼鱼的热耐受
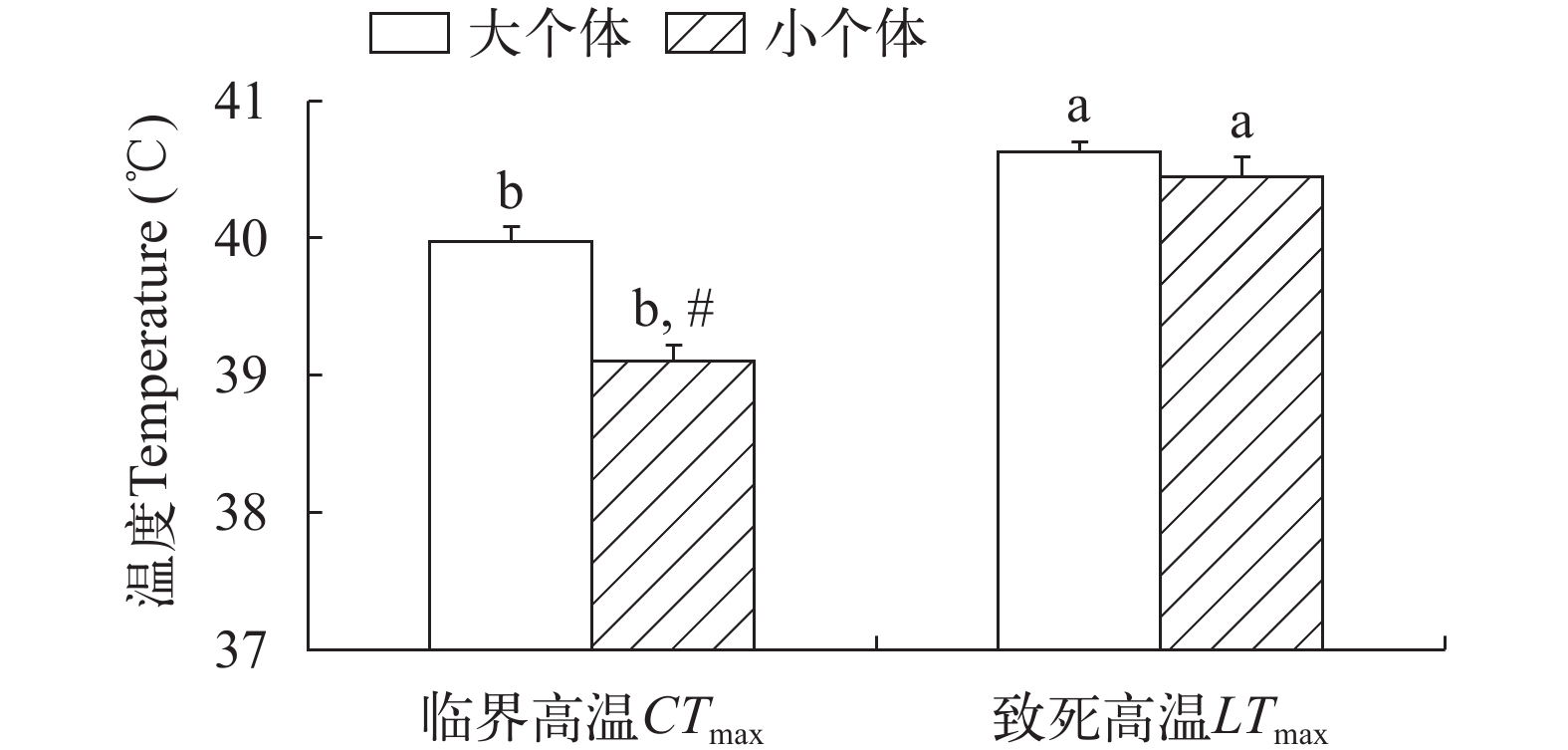
大个体草鱼幼鱼的临界高温显著高于小个体(P<0.001), 而大个体草鱼幼鱼的致死高温与小个体无显著差异(图 1)。不论对于大个体还是小个体草鱼幼鱼, 二者的致死高温均明显高于临界高温(图 1, P<0.001)。
![]() 图 1 个体大小对草鱼幼鱼热耐受的影响a, b表示同一个体大小、同一温度处理下不同时间差异显著(P<0.05);#表示同一温度处理同一时间不同个体大小间差异显著(P<0.05);下同Figure 1. The effect of body size on upper thermal tolerance of juvenile Ctenopharyngodon idellusLowercase letters (a and b) indicate significant differences in different times under the same individual size and temperature treatment (P<0.05). # indicates significant difference between different individual sizes at the same temperature and at the same time (P<0.05). The same applies below
图 1 个体大小对草鱼幼鱼热耐受的影响a, b表示同一个体大小、同一温度处理下不同时间差异显著(P<0.05);#表示同一温度处理同一时间不同个体大小间差异显著(P<0.05);下同Figure 1. The effect of body size on upper thermal tolerance of juvenile Ctenopharyngodon idellusLowercase letters (a and b) indicate significant differences in different times under the same individual size and temperature treatment (P<0.05). # indicates significant difference between different individual sizes at the same temperature and at the same time (P<0.05). The same applies below2.2 草鱼幼鱼的个体行为
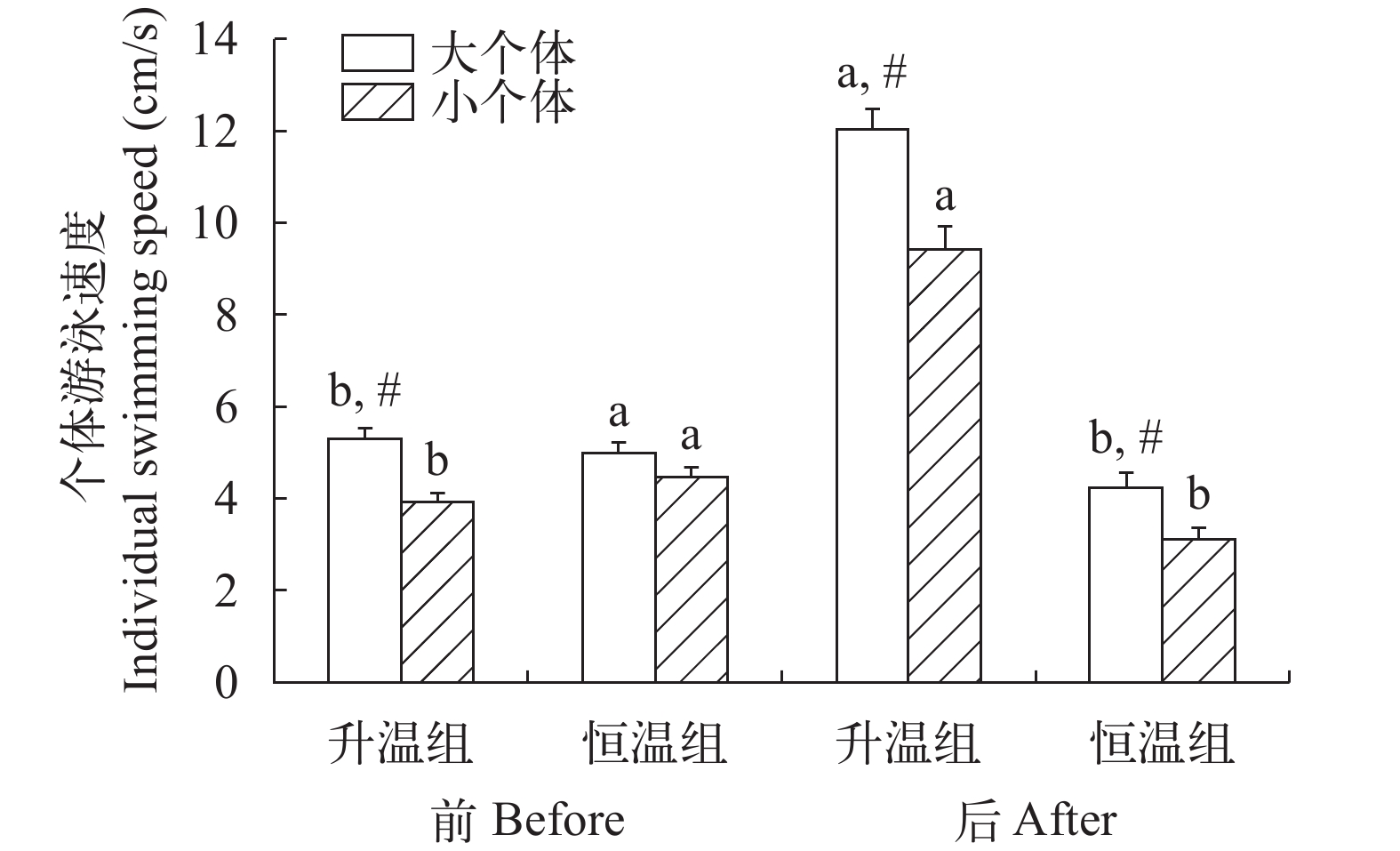
个体大小、升温模式和测定时间对草鱼幼鱼个体游泳速度产生影响(图 2和表 2)。在两个升温组中, 大个体在升温前后的个体游泳速度皆高于小个体(P<0.001, P=0.016), 但两个恒温组在实验开始时的个体游泳速度并无差异。在升温后, 不论大个体还是小个体, 二者的个体游泳速度明显比升温前的更快(P<0.001, P<0.001), 而两个恒温组中大个体和小个体在实验结束时的个体游泳速度均比实验开始时的更慢(P=0.046, P<0.001)。
![]() 图 2 个体大小、升温模式和测定时间对草鱼幼鱼个体游泳速度的影响a, b表示同一个体大小、同一温度处理下不同时间差异显著(P<0.05);#表示同一温度处理同一时间不同个体大小间差异显著(P<0.05);下同Figure 2. Effects of heating pattern, body size and measurement time on individual swimming speed of juvenile Ctenopharyngodon idellusLowercase letters (a and b) indicate significant differences in different times under the same individual size and temperature treatment (P<0.05). # indicates significant difference between different individual sizes at the same temperature and at the same time (P<0.05). The same applies below表 2 升温模式、个体大小和测定时间对群体行为影响的三因素方差分析结果Table 2. Three-way ANOVA results for the effects of heating pattern, body size and measurement time on group behavior
图 2 个体大小、升温模式和测定时间对草鱼幼鱼个体游泳速度的影响a, b表示同一个体大小、同一温度处理下不同时间差异显著(P<0.05);#表示同一温度处理同一时间不同个体大小间差异显著(P<0.05);下同Figure 2. Effects of heating pattern, body size and measurement time on individual swimming speed of juvenile Ctenopharyngodon idellusLowercase letters (a and b) indicate significant differences in different times under the same individual size and temperature treatment (P<0.05). # indicates significant difference between different individual sizes at the same temperature and at the same time (P<0.05). The same applies below表 2 升温模式、个体大小和测定时间对群体行为影响的三因素方差分析结果Table 2. Three-way ANOVA results for the effects of heating pattern, body size and measurement time on group behavior行为参数
Behavioral parameters测定时间
Measuring time升温模式
Heating pattern个体大小
Body size测定时间×升温模式
Measuring time×
Heating pattern测定时间×个体大小
Measuring time×
Body size升温模式×个体大小
Heating pattern×
Body size个体游泳速度
VelocityF1,79=112.964, F1,79=215.389, F1,79=35.921, F1,79=230.51, F1,79=3.723, F1,79=6.251, P<0.001 P<0.001 P<0.001 P<0.001 P=0.058 P=0.015 游泳速度同步性
Synchronization of speedF1,79=2.289, F1,79=0.064, F1,79=3.756, F1,79=1.314, F1,79=0.083, F1,79=0.186, P=0.135 P=0.801 PP=0.057 P=0.255 P=0.774 P=0.667 个体间距离
Inter-individual distanceF1,79=11.222, F1,79=0.613, F1,79=50.722, F1,79=12.959, F1,79=0.132, F1,79=0.009, P=0.001 P=0.436 P<0.001 P=0.001 P=0.717 P=0.926 最近邻距离
Nearest neighbor distanceF1,79=19.087, F1,79=0.049, F1,79=87.627, F1,79=17.335, F1,79=0.272, F1,79=0.610, P<0.001 P=0.826 P<0.001 P<0.001 P=0.604 P=0.437 极性
PolarizationF1,79=9.362, F1,79=2.628, F1,79=39.854, F1,79=0.081, F1,79=0.337, F1,79=11.181, P=0.003 P=0.109 P<0.001 P=0.777 P=0.563 P=0.001 2.3 草鱼幼鱼的群体行为
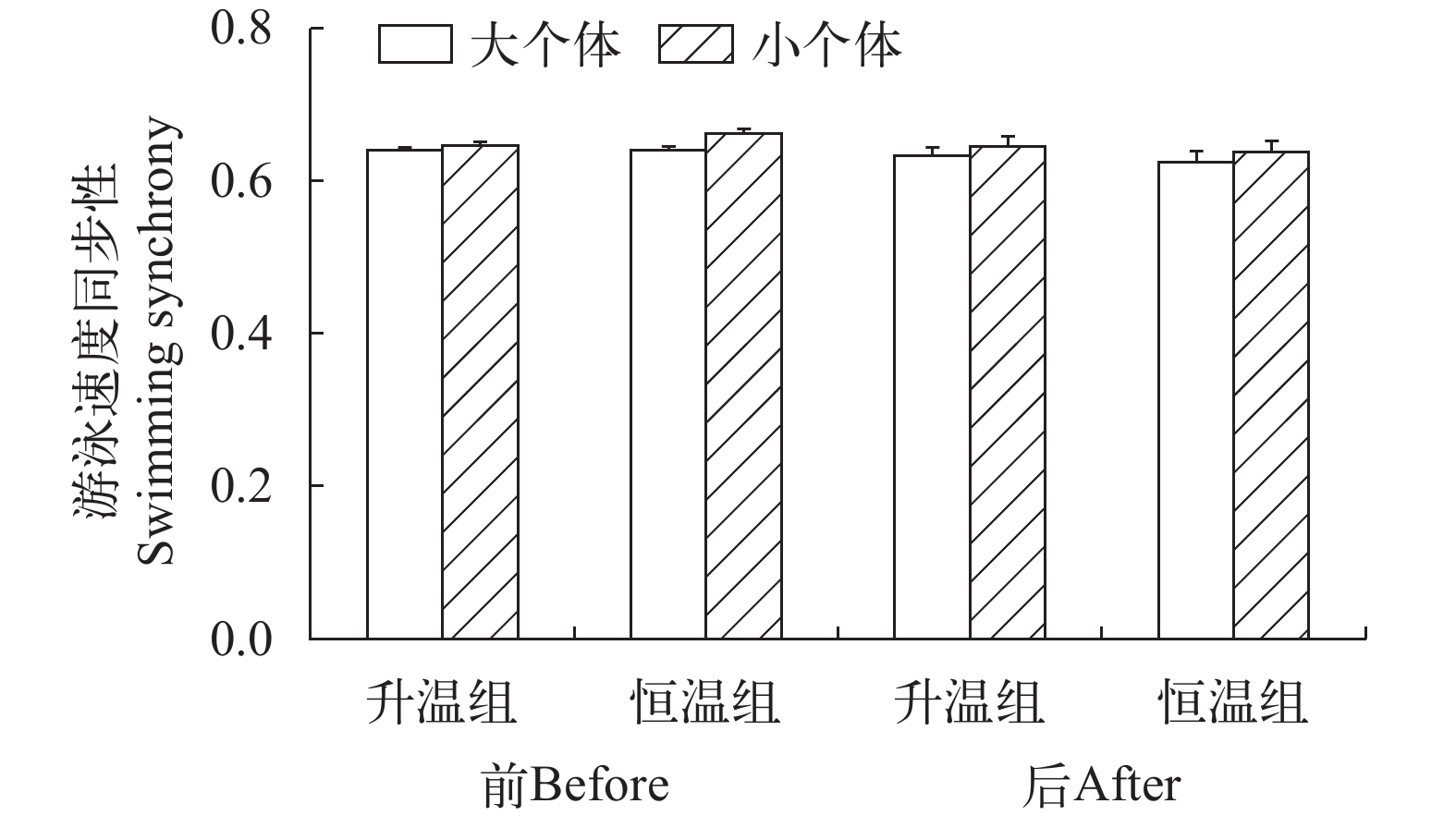
个体大小、升温模式和测定时间对草鱼幼鱼个体游泳速度同步性均无影响(图 3和表 2)。
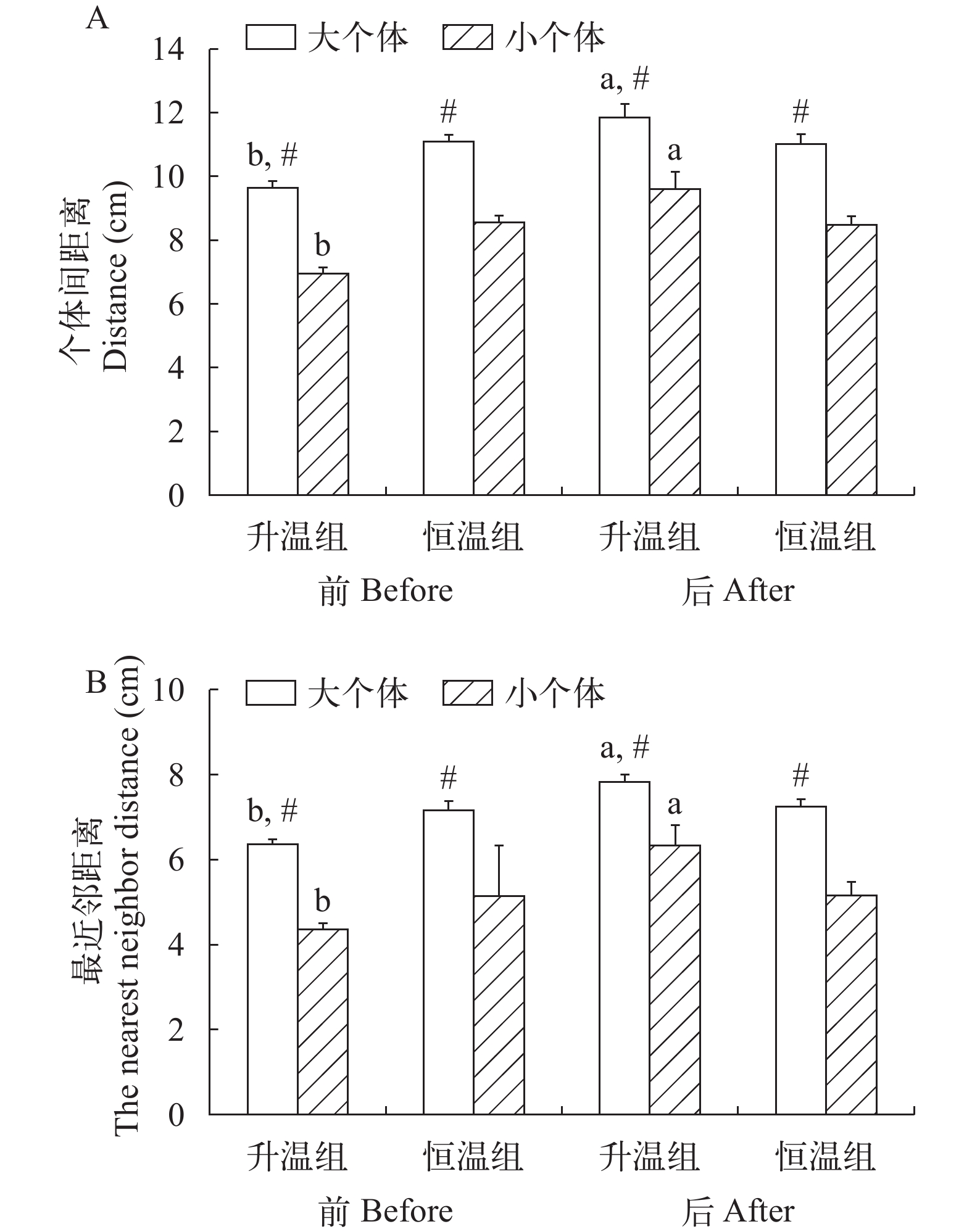
个体大小、升温模式和测定时间对草鱼幼鱼个体间距离和最近邻距离均有影响(图 4和表 2)。不论升温前还是升温后, 升温组和恒温组的大个体群体的个体间距离和最近邻距离均大于小个体群体(P<0.001, P<0.001)。升温导致大个体群体和小个体群体的个体间距离和最近邻距离均明显增加(P<0.001, P=0.018), 而恒温组在实验前后的个体间距离和最近邻距离并无明显变化。
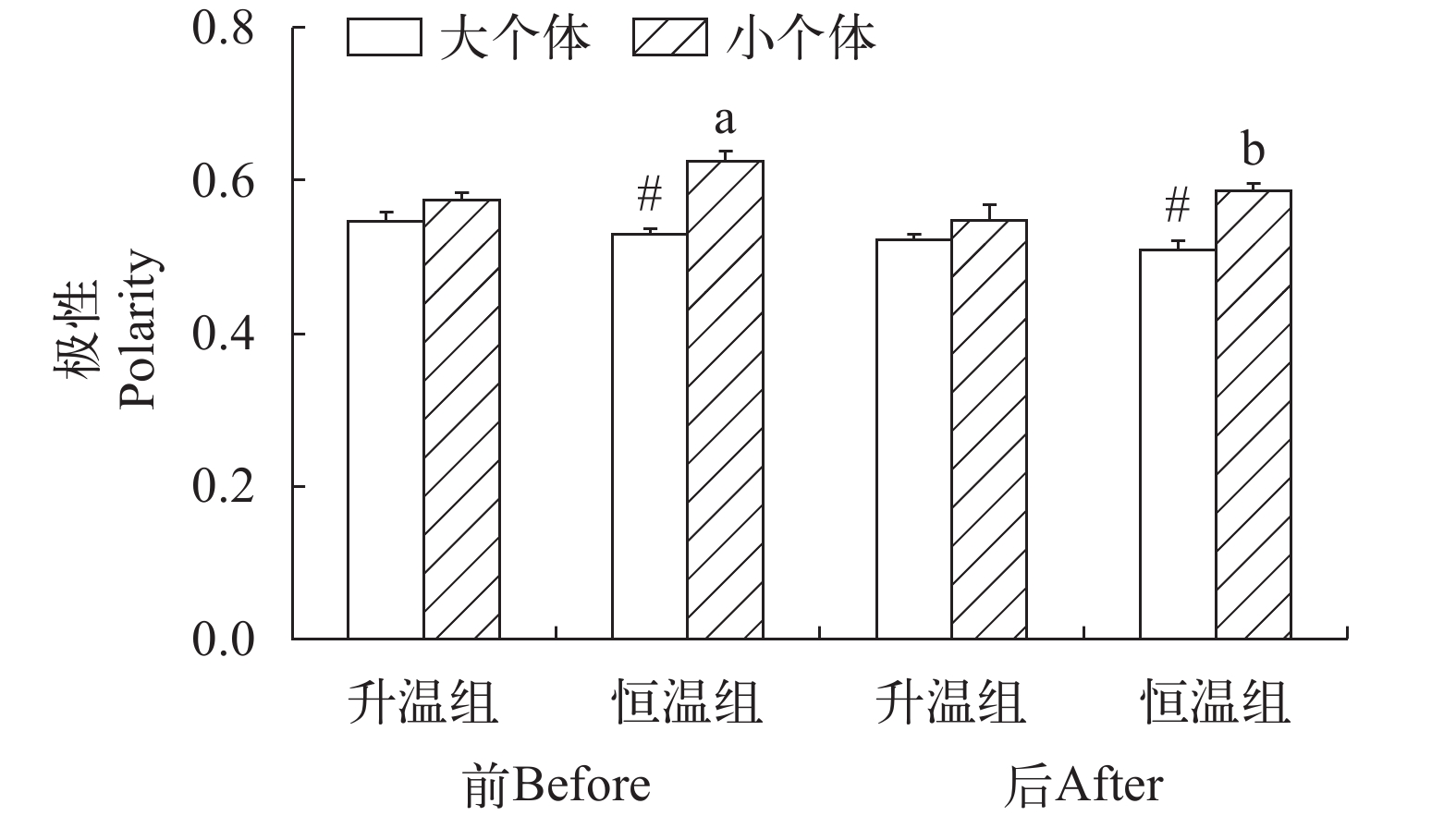
升温对草鱼幼鱼的群体极性并无影响, 但个体大小和测量时间对极性产生影响(图 5和表 2)。升温组大个体群体和小个体群体在升温前后的极性无变化, 恒温组的大个体群体在实验始末的极性也无差异, 但恒温组小个体群体在实验开始时的极性高于实验结束时(P=0.010)。不论实验开始时还是实验结束时, 恒温组的大个体群体的极性都低于小个体群体(P<0.001), 说明小个体群体具有更强的协调性。
3. 讨论
3.1 个体大小对草鱼幼鱼耐高温能力的影响
前期研究对动物的热耐受和个体大小之间的相关性进行了分析, 发现水生动物的个体大小与热耐受指标之间存在负相关, 并提出了氧气供应、热耐受和体重具有交互作用的学术观点[30, 31]。在本研究中实验水浴水体的溶氧水平从实验开始时9.04 mg/L下降至实验结束时的8.07 mg/L, 在实验结束时水体的溶氧仍属正常水平, 不会对实验鱼造成低氧胁迫而影响个体活动和群体行为, 可排除溶氧对实验鱼的影响, 故本文中主要探讨热耐受与个体大小的交互作用。例如, 小个体加勒比虾虎鱼(Elacatinus oceanops)的热耐受能力明显强于大个体[32]; 格兰德河鳟(Oncorhynchus clarkii virginalis)的临界高温与个体大小呈负相关[33]。研究报道, 500种变温动物的热耐受性能取决于其体重和基因组; 相比较于小体型水生动物, 大体型水生动物在长期驯化实验中的临界高温出现明显下降, 可能和氧气的限制有关[11]。较小的基因组常与较小的细胞有关[34], 由于膜表面积与细胞体积的比率增加和扩散距离缩短, 有利于促进氧进入线粒体内部的扩散效率[35, 36], 因此小体型变温动物具备更强的氧运动和扩散能力, 使其获得较强的热耐受性能。然而, 也有研究发现, 五种热带鱼类的临界高温与个体大小(如体长)并不相关[37]。此外, 虹鳟(Oncorhynchus mykiss)、大口黑鲈(Micropterus salmoides)、尼罗罗非鱼(Oreochromis niloticus)和斑点叉尾鮰(Ictalurus punctatus)的临界高温与个体大小无关[33]。本研究发现, 大个体的致死温度与小个体并无差异, 但大个体的临界高温大于小个体, 该结果与前期研究并不一致。然而, 也有研究报道某些变温动物在幼体阶段的热耐受随着体重的增加而提高, 但成体阶段的热耐受却降低[11]。由于本研究使用的实验材料处于幼鱼阶段, 表现出大个体的临界高温高于小个体的临界高温, 与Leiva等[11]的研究结果相符合。
3.2 个体大小对草鱼幼鱼群体行为的影响
鱼类的游泳速度与其个体大小(如体长)密切相关[38]。例如, 大西洋鲑(Salmo salar)、大西洋鳕(Gadus morhua)和太平洋蓝鳍金枪鱼(Thunnus orientalis)的绝对游泳速度随着体长的增加而增加[39, 40]; 草鱼、赤眼鳟(Squaliobarbus curriculus)、翘嘴鲌(Culter alburnus)和多鳞白甲鱼(Onychostoma macrolepis)等7种鱼类的相对游泳速度与体长呈负相关[41]。本研究发现, 草鱼的大个体的个体游泳速度明显大于小个体, 与前期研究一致。对于上述两种截然不同的相关性, 这种现象的可能原因是[41]: 在鱼类游泳运动过程中, 水体阻力的大小与鱼类表面积的关系是以体长的平方增加的, 而由肌肉推进鱼类游泳运动与鱼类体积的关系是以体长的立方增加的。这种肌肉重量与水体阻力的特定关系在不同体型和大小的鱼类中并非固定不变的。当鱼类的个体大小增加时, 鱼体表面积与肌肉重量的关系指数发生变化, 导致即绝对游泳速度与体长呈正相关, 而相对游泳速度与体长呈负相关。然而, 也有研究发现在中华倒刺鲃和鳊群体游泳过程中, 两种鱼类个体的自发游泳速度与个体大小并不相关[24]。这种现象的可能原因是个体的自发游泳速度明显低于其最大持续游泳速度或爆发游泳速度造成的。
本研究发现, 大个体草鱼群体的个体间距离和最近邻距离均明显大于小个体鱼群, 这与前期有关中华倒刺鲃的研究结果一致[24]。营养状态影响鱼群的群体行为, 群体成员为了竞争食物资源, 会造成群体游泳活动增加, 个体间距离加大[42]。本研究的草鱼幼鱼已被禁食24h而具备一定的食欲强度, 大个体群体为获取满足自身需求的食物, 需要增加觅食活动和扩大觅食空间, 进而导致个体间距离加大。此外, 中华倒刺鲃的自发游泳速度更快, 根据个体交互的平行与对齐规则, 为了避免个体间的碰撞, 进而扩大了个体间距离。本研究中大个体群体的自发游泳速度和体长都显著高于小个体群体, 这也可能也是造成上述现象的重要原因。
对于群体的游泳速度同步性和极性, 本研究发现大个体群体和小个体群体游泳同步性只有在恒温组实验开始时表现出差异, 在其他升温模式和测定时间中大个体群体和小个体群体的游泳同步性未表现出明显差异。大个体群体和小个体群体的极性也只有恒温组存有显著差异, 其他组均无明显差异, 这些结果表明草鱼群体成员的个体大小差异并不影响鱼群的协调性。研究发现, 中华倒刺鲃和鳊的大个体群体的游泳速度异质性与小个体群体并无差异, 并且排列极性不受鱼群成员大小差异的影响[24], 与本研究结果类似。另外, 无论是大个体群体还是小个体群体, 群体成员都会通过改变个体的特性与群体保持一致, 从而保持群体运动的协调性[23], 这种机制也可能是造成升温组游泳同步性和极性无差异的重要原因。此外, 对于恒温组实验结果与研究预期不符, 可能原因是恒温组的鱼群在整个实验过程中并未经历较大的环境变化, 鱼群在实验后期对行为装置的熟悉程度增加所导致的。
3.3 升温对草鱼幼鱼群体行为的影响
研究发现, 在适宜的温度范围内, 麦穗鱼(Pseudorasbora parva)、草鱼和南方鲇(Silurus meridionalis)的耗氧率随着温度的升高而增加[43—45], 这种能量消耗的增加是鱼类各种生理功能随着温度上升也相应增强的内在表征。在本研究升温组中草鱼幼鱼升温后的个体游泳速度明显快于升温前, 这与上述研究的实验结果一致。在相同氧饱和条件下, 水体的溶氧水平与温度呈负相关[25]。随着温度的升高, 鱼类为了能获取更多量的氧气, 会使更多水流从鳃部流过[46]。此外, 在25—40℃内, 细胞内丙酮酸脱羧酶、葡萄糖-6-磷酸脱氢酶、葡萄糖激酶、丙酮酸激酶、苹果酸脱氢酶、异柠檬酸脱氢酶和甘油醛-3-磷酸脱氢酶的酶活性均呈现出温度依赖的变化趋势[47], 进一步表现为供给肌肉的能量增加, 故鱼类的临界游泳速度会随着一定范围内温度的上升而显著增加[25]。然而, 在超过鱼类的最适温度后, 鱼类的临界游泳速度将随着水温的继续升高而出现一定程度的下降, 这种现象在接近鱼类的临界高温时表现更为明显[38]。
理论上分析, 在接近临界高温时鱼类的群体行为可能发生明显变化: 随着温度的逐渐升高, 鱼群将逐渐不能维持原有的群体结构和功能, 个体为逃离不断升温的水体而变得焦虑不安且沿着水槽4周游泳的行为[48]; 个体之间跟随的意愿和动机出现明显差异, 导致个体间距离和最近邻距离应明显增大[49], 游泳速度同步性和极性应明显降低, 即群体协调性和凝聚力出现下降的趋势。本研究发现, 升温组在接近临界高温前的个体间距离和最近邻距离明显增大, 表明水体升温会降低草鱼的群体凝聚力。然而, 该种鱼在升温前后的游泳速度同步性和群体极性均无明显变化, 说明群体成员之间的基本交互规则得到维持, 即升温并不影响草鱼的群体协调性。研究发现, 相较于有食物和隐蔽场所的条件, 空白对照环境中的中华倒刺鲃群体倾向于以中等速度进行群体移动, 会表现出比较强的群体行为协调性和凝聚力[50]; 此外, 鱼类群体的能量消耗会随着个体成员之间的距离增加而表现出增强的趋势[51], 在游泳过程中, 大个体群体的能量消耗更快, 对于食物的需求比小个体群体更大, 故大个体群体对于食物的探寻欲望也可能是造成大个体群体中的游泳速度同步性和极性不随温度变化的重要原因。对于恒温组而言, 本研究预期游泳速度同步性和极性在整个实验过程因不受环境胁迫而维持整体稳定。然而, 本研究发现大个体群体的游泳速度同步性和极性维持不变, 而小个体群体的游泳速度同步性不变, 但极性有所降低。此现象的可能原因是相比较大个体, 小个体群体在实验后期对行为装置的熟悉程度增加更为明显, 并且个体游泳速度的降低导致了群体极性的下降。
综上所述, 升温过程会导致鱼群的群体行为和群体结构发生显著变化, 自发游泳速度明显加快, 协调性和凝聚力显著下降; 在个体大小方面, 大个体的游泳速度比小个体更快, 大个体群体的个体间距离和最近邻距离明显大于小个体群体, 大个体群体的协调性和小个体群体并无明显差异。在面对全球气候变暖的大环境下, 多数鱼类面临着栖息环境水温上升的巨大挑战, 未来研究仍有必要关注水温变化与鱼类群体行为保护的研究。
-
图 1 个体大小对草鱼幼鱼热耐受的影响
a, b表示同一个体大小、同一温度处理下不同时间差异显著(P<0.05);#表示同一温度处理同一时间不同个体大小间差异显著(P<0.05);下同
Figure 1. The effect of body size on upper thermal tolerance of juvenile Ctenopharyngodon idellus
Lowercase letters (a and b) indicate significant differences in different times under the same individual size and temperature treatment (P<0.05). # indicates significant difference between different individual sizes at the same temperature and at the same time (P<0.05). The same applies below
图 2 个体大小、升温模式和测定时间对草鱼幼鱼个体游泳速度的影响
a, b表示同一个体大小、同一温度处理下不同时间差异显著(P<0.05);#表示同一温度处理同一时间不同个体大小间差异显著(P<0.05);下同
Figure 2. Effects of heating pattern, body size and measurement time on individual swimming speed of juvenile Ctenopharyngodon idellus
Lowercase letters (a and b) indicate significant differences in different times under the same individual size and temperature treatment (P<0.05). # indicates significant difference between different individual sizes at the same temperature and at the same time (P<0.05). The same applies below
表 1 草鱼幼鱼的形态学参数
Table 1 The morphology of juvenile grass carp
温度处理
Temperature
treatment个体大小
Body size体重
Body
weight
(g)体长
Body
length
(cm)肥满度
Condition
factor (g/cm3)恒温组
Constant
temperature group大个体 10.95±1.18 8.72±0.33 1.65±0.08 小个体 3.59±0.51 6.28±0.32 1.44±0.11 升温组
Heating group大个体 10.98±1.76 8.76±0.46 1.62±0.10 小个体 3.55±0.63 6.22±0.34 1.47±0.14 表 2 升温模式、个体大小和测定时间对群体行为影响的三因素方差分析结果
Table 2 Three-way ANOVA results for the effects of heating pattern, body size and measurement time on group behavior
行为参数
Behavioral parameters测定时间
Measuring time升温模式
Heating pattern个体大小
Body size测定时间×升温模式
Measuring time×
Heating pattern测定时间×个体大小
Measuring time×
Body size升温模式×个体大小
Heating pattern×
Body size个体游泳速度
VelocityF1,79=112.964, F1,79=215.389, F1,79=35.921, F1,79=230.51, F1,79=3.723, F1,79=6.251, P<0.001 P<0.001 P<0.001 P<0.001 P=0.058 P=0.015 游泳速度同步性
Synchronization of speedF1,79=2.289, F1,79=0.064, F1,79=3.756, F1,79=1.314, F1,79=0.083, F1,79=0.186, P=0.135 P=0.801 PP=0.057 P=0.255 P=0.774 P=0.667 个体间距离
Inter-individual distanceF1,79=11.222, F1,79=0.613, F1,79=50.722, F1,79=12.959, F1,79=0.132, F1,79=0.009, P=0.001 P=0.436 P<0.001 P=0.001 P=0.717 P=0.926 最近邻距离
Nearest neighbor distanceF1,79=19.087, F1,79=0.049, F1,79=87.627, F1,79=17.335, F1,79=0.272, F1,79=0.610, P<0.001 P=0.826 P<0.001 P<0.001 P=0.604 P=0.437 极性
PolarizationF1,79=9.362, F1,79=2.628, F1,79=39.854, F1,79=0.081, F1,79=0.337, F1,79=11.181, P=0.003 P=0.109 P<0.001 P=0.777 P=0.563 P=0.001 -
[1] Eliason E J, Clark T D, Hague M J, et al. Differences in thermal tolerance among sockeye salmon populations [J]. Science, 2011, 332(6025): 109-112. doi: 10.1126/science.1199158
[2] Xia J G, Nie L J, Mi X M, et al. Behavior, metabolism and swimming physiology in juvenile Spinibarbus sinensis exposed to PFOS under different temperatures [J]. Fish Physiology and Biochemistry, 2015, 41(5): 1293-1304. doi: 10.1007/s10695-015-0086-1
[3] Das T, Pal A K, Chakraborty S K, et al. Thermal tolerance and oxygen consumption of Indian major carps acclimated to four temperatures [J]. Journal of Thermal Biology, 2004, 29(3): 157-163. doi: 10.1016/j.jtherbio.2004.02.001
[4] Beitinger T L, Bennett W A, McCauley R W. Temperature tolerances of North American freshwater fishes exposed to dynamic changes in temperature [J]. Environmental Biology of Fishes, 2000(58): 237-275.
[5] Hernández R M, Bückle R L F. Temperature tolerance polygon of Poecilia sphenops Valenciennes (Pisces: Poeciliidae) [J]. Journal of Thermal Biology, 2002, 27(1): 1-5. doi: 10.1016/S0306-4565(01)00008-0
[6] Bicego K C, Barros R C H, Branco L G S. Physiology of temperature regulation: Comparative aspects [J]. Comparative Biochemistry and Physiology Part A, 2007, 147(3): 616-639. doi: 10.1016/j.cbpa.2006.06.032
[7] 王云松. 南方鲇、瓦氏黄颡鱼和中华倒刺鲃幼鱼的热耐受特征及其比较研究 [D]. 重庆: 重庆师范大学, 2009: 1-24. Wang Y S. Thermal tolerance and comparison of juvenile Silurus meridionalis Chen, Pelteobagrus vachelli Richardson and Spinibarbus sinensis Bleeker [D]. Chongqing: Chongqing Normal University, 2009: 1-24.
[8] 夏继刚, 蔡瑞钰, 吕潇, 等. 升温/降温速率和驯化模式对斑马鱼及孔雀鱼热耐受性测定的影响 [J]. 生态学杂志, 2016, 35(8): 2170-2174. Xia J G, Cai R Y, Lv X, et al. The effects of heating/cooling rate and acclimation mode on the determination of thermal tolerance of zebrafish (Danio rerio) and guppy (Poecilia reticulata) [J]. Chinese Journal of Ecology, 2016, 35(8): 2170-2174.
[9] 夏继刚, 黄艳, 付世建, 等. 斑马鱼热耐受性对温度驯化的响应及其性别差异 [J]. 生态学杂志, 2019, 38(8): 2477-2481. Xia J G, Huang Y, Fu S J, et al. Gender differences in thermal tolerance of zebrafish in response to temperature acclimation [J]. Chinese Journal of Ecology, 2019, 38(8): 2477-2481.
[10] Di Santo V, Lobel P S. Body size and thermal tolerance in tropical gobies [J]. Journal of Experimental Marine Biology and Ecology, 2017(487): 11-17.
[11] Leiva F P, Calosi P, Verberk W C E P. Scaling of thermal tolerance with body mass and genome size in ectotherms: a comparison between water- and air-breathers [J]. Philosophical Transactions of the Royal Society of London B, 2019, 374(1778): 20190035. doi: 10.1098/rstb.2019.0035
[12] Pritchard V L, Lawrence J, Butlin R K, et al. Shoal choice in zebrafish, Danio rerio: the influence of shoal size and activity [J]. Animal Behaviour, 2001, 62(6): 1085-1088. doi: 10.1006/anbe.2001.1858
[13] Ward A J, Axford S, Krause J. Mixed-species shoaling in fish: the sensory mechanisms and costs of shoal choice [J]. Behavioral Ecology and Sociobiology, 2002, 52(3): 182-187. doi: 10.1007/s00265-002-0505-z
[14] Killen S S, Fu C, Wu Q Y, et al. The relationship between metabolic rate and sociability is altered by food deprivation [J]. Functional Ecology, 2016, 30(8): 1358-1365. doi: 10.1111/1365-2435.12634
[15] Rodgers G M, Downing B, Morrell L J. Prey body size mediates the predation risk associated with being “odd” [J]. Behavioral Ecology, 2015, 26(1): 242-246. doi: 10.1093/beheco/aru185
[16] Thünken T, Eigster M, Frommen J G. Context-dependent group size preferences in large shoals of three-spined sticklebacks [J]. Animal Behaviour, 2014, 90(1): 205-210.
[17] Cote J, Fogarty S, Sih A. Individual sociability and choosiness between shoal types [J]. Animal Behaviour, 2012, 83(6): 1469-1476. doi: 10.1016/j.anbehav.2012.03.019
[18] Herbert-Read J E, Krause S, Morrell L J, et al. The role of individuality in collective group movement [J]. Proceedings of Royal Society: Biological Sciences, 2012, 280(1752): 20122564.
[19] Sumpter D J T. Collective Animal Behaviour [M]. Princeton. N J: Princeton University Press, 2010, 608.
[20] Clark P J, Evans F C. Distance to nearest neighbor as a measure of spatial relationships in populations [J]. Ecology, 1954, 35(4): 445-453. doi: 10.2307/1931034
[21] Jolles J W, Boogert N J, Sridhar V H, et al. Consistent individual differences drive collective behavior and group functioning of schooling fish [J]. Current Biology, 2017, 27(18): 2862-2868. doi: 10.1016/j.cub.2017.08.004
[22] 石小涛, 王博, 王雪, 等. 胭脂鱼早期发育过程中集群行为的形成 [J]. 水产学报, 2013, 37(5): 705-710. doi: 10.3724/SP.J.1231.2013.38460 Shi X T, Wang B, Wang X, et al. Ontogenetic changes in schooling behaviour during larval and early juvenile stages of Chinese sucker (Myxocryprinus asiaticus) [J]. Journal of Fisheries of China, 2013, 37(5): 705-710. doi: 10.3724/SP.J.1231.2013.38460
[23] Herbert-Read J E, Perna A, Mann R P, et al. Inferring the rules of interaction of shoaling fish [J]. Proceeding of the National Academy of Science, 2011, 108(46): 18726-18731. doi: 10.1073/pnas.1109355108
[24] 吴慧, 唐中华, 黄清, 等. 群体成员大小差异对不同生境鲤科鱼类集群行为的影响 [J]. 水生生物学报, 2017, 41(3): 552-559. doi: 10.7541/2017.71 Wu H, Tang Z H, Huang Q, et al. Effect of body size variation of group members on shoal behavior of two Cyprinids preferring different habitats [J]. Acta Hydrobiologica Sinica, 2017, 41(3): 552-559. doi: 10.7541/2017.71
[25] 付世建, 曹振东, 曾令清, 等. 鱼类游泳运动: 策略与适应性进化 [M]. 北京: 科学出版社, 2014: 1-219. Fu S J, Cao Z D, Zeng L Q, et al. Fish Swimming Locomotion: Strategy and Adaptive Evolution [M]. Beijing: Science Press, 2014: 1-219.
[26] 吴青怡, 曾令清, 曹振东, 等. 鲤科鱼类的流速选择及其与食性的关系 [J]. 水产学报, 2015, 39(12): 1807-1816. Wu Q Y, Zeng L Q, Cao Z D, et al. The preferred water velocity behavior of six Cyprinids with different feeding habits [J]. Journal of Fisheries of China, 2015, 39(12): 1807-1816.
[27] 何伟, 陈波见, 曹振东, 等. 温度驯化对五种鲤科鱼类糖代谢酶活性的影响 [J]. 水生生物学报, 2015, 39(1): 203-208. doi: 10.7541/2015.26 He W, Chen B J, Cao Z D, et al. The effect of acclimation temperature on the activity of carbohydrate-metabolizing enzymes in five Cyprinids [J]. Acta Hydrobiologica Sinica, 2015, 39(1): 203-208. doi: 10.7541/2015.26
[28] 杨亚, 彭姜岚, 付世建, 等. 饥饿对草鱼易钓性及其生态结果的影响 [J]. 生态学杂志, 2019, 38(2): 492-499. Yang Y, Peng J L, Fu S J, et al. Effect of starvation on the vulnerability to angling of juvenile grass garp (Ctenopharynodon idellus) and its ecological consequences [J]. Chinese Journal of Ecology, 2019, 38(2): 492-499.
[29] 付世建, 聂利娟, 吴慧, 等. 群体大小对青幼鱼群体特征的影响 [J]. 生态学报, 2016, 36(19): 6062-6070. Fu S J, Nie L J, Wu H, et al. The effect of group size on school structure in juvenile black carp [J]. Acta Ecologica Sinica, 2016, 36(19): 6062-6070.
[30] Atkinson D. Temperature and organism size: a biological law for ectotherms [J]. Advances in Ecological Research, 1994(25): 1-58.
[31] Forster J, Hirst A G, Atkinson D. Warming-induced reductions in body size are greater in aquatic than terrestrial species [J]. Proceeding of the National Academy of Science, 2012, 109(47): 19310-19314. doi: 10.1073/pnas.1210460109
[32] 庞旭, 付世建, 刘小红, 等. 中华倒刺鲃能量代谢和热耐受特征的体重效应 [J]. 生态学报, 2020, 40(16): 5814-5821. Pang X, Fu S J, Liu X H, et al. Effects of body mass on energy metabolism and thermal tolerance in Qingbo (Spinibarbus sinensis) [J]. Acta Ecologica Sinica, 2020, 40(16): 5814-5821.
[33] Recsetar M S, Zeigler M P, Ward D L, et al. Relationship between fish size and upper thermal tolerance [J]. Transactions of the American Fisheries Society, 2012, 141(6): 1433-1438. doi: 10.1080/00028487.2012.694830
[34] Gregory T R. The bigger the C-value, the larger the cell: genome size and red blood cell size in vertebrates [J]. Blood Cells, Molecules, and Diseases, 2001, 27(5): 830-843. doi: 10.1006/bcmd.2001.0457
[35] Atkinson D, Morley S A, Hughes R N. From cells to colonies: at what levels of body organization does the ‘temperature-size rule’ apply [J]. Evolution and Development, 2006, 8(2): 202-214. doi: 10.1111/j.1525-142X.2006.00090.x
[36] Czarnoleski M, Cooper B S, Kierat J, et al. Flies developed small bodies and small cells in warm and in thermally fluctuating environments [J]. Journal of Experimental Biology, 2013, 216(15): 2896-2901.
[37] Ospina A F, Mora C. Effect of body size on reef fish tolerance to extreme low and high Temperatures [J]. Environmental Biology of Fishes, 2004, 70(4): 339-343. doi: 10.1023/B:EBFI.0000035429.39129.34
[38] Hammer C. Fatigue and exercise tests with fish [J]. Comparative Biochemistry and Physiology Part A, 1995, 112(1): 1-20.
[39] Peck M A, Buckley L J, Bengtson D A. Effects of temperature and body size on the swimming speed of larval and juvenile Atlantic cod (Gadus morhua): implications for individual-based modelling [J]. Environmental Biology of Fishes, 2006, 75(4): 419-429. doi: 10.1007/s10641-006-0031-3
[40] Remen M, Solstorm F, Bui S, et al. Critical swimming speed in groups of Atlantic salmon Salmo salar [J]. Aquaculture Environment Interactions, 2016(8): 659-664.
[41] Cai L, Chen J H, Johnson D, et al. Effect of body length on swimming capability and vertical slot fishway design [J]. Global Ecology and Conservation, 2020(22): e00990.
[42] 王蕾, 唐金玉, 覃英莲, 等. 饥饿对中华倒刺鲃幼鱼代谢、个性和集群的影响 [J]. 生态学报, 2019, 39(3): 1095-1104. Wang L, Tang J Y, Qin Y L, et al. Effect of starvation on energy metabolism, fish behavior, and schooling behavior of Spinibarbus sinensis [J]. Acta Ecologica Sinica, 2019, 39(3): 1095-1104.
[43] Zeng L Q, Zhang Y G, Cao Z D, et al. Effect of temperature on excess post-exercise oxygen consumption in juvenile southern catfish (Silurus meridionalis Chen) following exhaustive exercise [J]. Fish Physiology and Biochemistry, 2010, 36(4): 1243-1252. doi: 10.1007/s10695-010-9404-9
[44] 闫杰. 流速、温度对麦穗鱼耗氧率的影响研究 [D]. 南京: 南京农业大学, 2014: 19-21. Yan J. The studies of water flow and temperture on the rate of oxygen consumption Pseudorasbora parva [D]. Nanjing: Nanjing Agricultural University, 2014: 19-21.
[45] 朱祥宇, 高勤峰, 董双林. 不同温度对草鱼C、N、P营养要素收支的影响 [J]. 水产学报, 2013, 37(10): 1521-1526. doi: 10.3724/SP.J.1231.2013.38657 Zhu X Y, Gao Q F, Dong S L. Effects of temperature on the C, N, P nutrient budgets of grass carp (Ctenopharyngodon idellus) [J]. Journal of Fisheries of China, 2013, 37(10): 1521-1526. doi: 10.3724/SP.J.1231.2013.38657
[46] 杨小东, 江兴龙, 乐普敏, 等. 南美洲鳗鲡的耗氧率、窒息点和适温范围及对非离子氨、NO2-的LC50和SC的研究 [J]. 海洋与湖沼, 2019, 50(2): 455-464. doi: 10.11693/hyhz20181200295 Yang X D, Jiang X L, Le P M, et al. Studies on oxygen consumption rate (ROC), asphyxial point (AP) and optimum water temperature range (RT) of Anguilla rostrata and LC50 and SC of non-ionic ammonia (NIA) and nitrite in water [J]. Oceanologia et Limnologia Sinica, 2019, 50(2): 455-464. doi: 10.11693/hyhz20181200295
[47] 陈玲, 王成涛, 曹雁平, 等. 温度对Zymomonas mobilis糖代谢关键酶活力和代谢流量的影响 [J]. 食品工业科技, 2009, 30(12): 182-185. Chen L, Wang C T, Cao Y P, et al. Effects of temperature on the key enzymes and metabolic flux distribution of glucose metabolism in Zymomonas mobilis [J]. Science and Technology of Food Industry, 2009, 30(12): 182-185.
[48] Machado A S D, Cardoso C M, Sartorio P V, et al. Lethal thermal maximum temperature induces behavioral responses and protein expressions (Hsp70 and p53) in juvenile common carp (Cyprinus carpio Linnaeus) [J]. Pan-American Journal of Aquatic Sciences, 2017, 12(4): 295-309.
[49] Bartolini T, Butail S, Porfiri M. Temperature influences sociality and activity of freshwater fish [J]. Environmental Biology of Fishes, 2015, 98: 825-832. doi: 10.1007/s10641-014-0318-8
[50] 杨亚, 凌鸿, 付世建, 等. 环境类型和代谢表型对中华倒刺鲃群体行为的影响 [J]. 生态学报, 2021, 41(11): 4447-4459. Yang Y, Ling H, Fu S J, et al. Effects of ecological context and metabolic phenotype on collective behaviour of qingbo Spinibarbus sinensis [J]. Acta Ecologica Sinica, 2021, 41(11): 4447-4459.
[51] Marras S, Killen S S, Lindström J, et al. Fish swimming in schools save energy regardless of their spatial position [J]. Behavioral Ecology and Sociobiology, 2015, 69(2): 219-226. doi: 10.1007/s00265-014-1834-4
-
期刊类型引用(5)
1. 张川,张明燡,郑春芳,章欣仪,陈琛,邵鑫斌,赵伟华,刘伟成. 鮻幼鱼的耳石锶标记. 生态学杂志. 2024(04): 975-981 .  百度学术
百度学术
2. 胡晓,陈伟,黄慧玲,张奔,杨国党,石小涛,龙泽宇. 静水环境下草鱼幼鱼摆尾-滑行动力学研究. 长江科学院院报. 2024(08): 82-89 .  百度学术
百度学术
3. 毕瑾秋,何衍,王春花,刘小玲,陈欢,蒲德永,曾令清. 不同光色环境对中华倒刺鲃幼鱼群体行为的影响. 重庆师范大学学报(自然科学版). 2024(03): 37-46 .  百度学术
百度学术
4. 李小红,付成,付世建. 焦虑对雌性成年斑马鱼热耐受和游泳能力的影响. 水生生物学报. 2024(09): 1566-1572 .  本站查看
本站查看
5. 凌鸿,王春花,付世建,曾令清. 营养状态和代谢范围对锦鲫幼鱼群体行为的影响. 水生生物学报. 2023(06): 958-972 .  本站查看
本站查看
其他类型引用(1)



 下载:
下载: