SCREENING, IDENTIFICATION AND PHYSIOLOGICAL CHARACTERISTICS OF INTESTINAL BACTERIA AGAINST VIBRIO HARVEYI FROM PENAEUS MONODON
-
摘要: 基于斑节对虾(非洲群体)(Penaeus monodon)肠道菌的生理生化特性, 为解决斑节对虾急性肝胰腺坏死综合征(AHPND)提供新思路, 文章分离纯化健康斑节对虾肠道中的优势菌株; 以致病性哈维氏弧菌为指示菌, 用牛津杯法从纯化菌株中筛选拮抗菌; 通过生理生化特征、Biolog系统鉴定及16S rDNA技术综合方法对菌株进行鉴定; 通过药敏实验, 评价拮抗菌株的安全性; 绘制高敏拮抗菌株的生长曲线, 得出其生长特性; 通过测定其产酶活性, 形成对其益生机制的初步推断。从斑节对虾肠道中共分离得到14株的优势土著菌, 分别标记为P.m-1、P.m-2······P.m-14, 经过拮抗实验得到了3株拮抗菌(P.m-1、P.m-9和P.m-13)。经鉴定P.m-1、P.m-9和P.m-13分别为枯草芽孢杆菌(Bacillus subtilis)、屎肠球菌(Enterococcus faecium)和溶藻弧菌(Vibrio alginolyticus)。药敏实验结果表明, 3株拮抗菌均不属于耐药菌, P.m-1对药物高度敏感。生长特征实验表明: P.m-1在2h进入对数期, 10h达到生长高峰, 菌体密度可达1.14×109 cfu/mL, 表现出了强劲的生命力。经过蛋白酶活性测定, P.m-1具有较强的产酶能力。优势菌P.m-1具有成为益生菌的潜力, 后续将作为功能性饲料添加剂或水质调节剂进行应用, 为AHPND进行生物防治提供新思路。
-
关键词:
- 枯草芽孢杆菌 /
- 益生菌 /
- 哈维氏弧菌 /
- 拮抗作用 /
- 急性肝胰腺坏死综合征(AHPND) /
- 斑节对虾(非洲群体)
Abstract: Penaeus monodon (African group) is a new cultured prawn species, which has good development prospects. At present, aquaculture diseases are seriously affecting the health of prawn farming. Based on physiological characteristics of intestinal bacteria in P. monodon, the experimental study was carried out to provide new treatments for acute hepatopancreas necrosis syndrome (AHPND). The dominant intestinal strains in healthy P. monodon were isolated and purified. Using pathogenic Vibrio harveyi as indicator bacteria, antagonistic bacteria were screened from the strains by the Oxford cup method. To identify these antagonistic bacteria, high-throughput sequencing technology was used as the main method. Biolog microbe identification system was also used to identify the strains. These two methods were supplemented by biochemical characteristic tests. To evaluate the safety of antagonistic strains, the drug susceptibility test was carried out in the study. The basic drug resistance information of intestinal bacteria was obtained by this test. According to the drug resistance information, antagonistic strains with high drug sensitivity were selected. The growth curve of the hypersensitive antagonistic strain was plotted to show its growth characteristics. The activity of extracellular enzymes of potential probiotics was calculated. As a result, sixteen dominant indigenous strains were isolated from the intestinal tract of P. monodon. The three antagonistic strains which were named as P.m-1, P.m-9, P.m-13. P.m-1, P.m-9 and P.m-13 were identified as Bacillus subtilis, Enterococcus faecium and Vibrio alginolyticus, respectively. The results of drug sensitivity tests showed that they were not intestinal drug-resistant bacteria, and P.m-1 was highly sensitive to drugs. P.m-1 entered the exponential growth stage from the 2nd hour, and reached the growth peak at the 10th hour. The maximum concentration of P.m-1 was 1.14×109 cfu/mL, which indicated that P.m-1 had the strong vitality. After protease activity determination, P.m-1 was considered as a strain that had the strong protease production capacity, which could provide a basis for digestion or purification of the environment. P.m-1 has the potential to become probiotics, which could contribute to the prevention and treatment of acute hepatopancreas necrosis syndrome. The experiment would provide the theoretical basis for functional feed additives from the perspective of intestinal microecology. -
斑节对虾(非洲群体)(Penaeus monodon)俗称金刚虾、斑节王, 隶属节肢动物门(Arthropoda)甲壳纲(Crustacea)十足目(Decapoda)对虾科(Penaeidae)对虾属(Penaeus), 是虾类新兴品种[1]。因其生长速度快、抗逆性强、虾池无须改造即可转养等优点被引进我国, 近年来养殖规模不断扩大, 养殖范围逐渐从东南沿海向北方延伸[2]。然而, 多种弧菌引起的急性肝胰腺坏死综合征(AHPND)对生产养殖造成巨大损失, 其中哈维氏弧菌是主要病原之一。
细菌间的拮抗作用可以被用来抑制病原菌的生长, 这是进行生物防治的有效途径[3]。目前对病原菌的拮抗性仍作为益生菌筛选的主流标准[4]。从动物体内或体表可分离得到益生效果优良的土著菌, 本实验通过对健康斑节对虾肠道菌群进行筛选, 得到优势菌株, 并对其进行深入研究。
本实验通过牛津杯法, 筛选得到AHPND哈维氏弧菌的拮抗菌(P.m-1、P.m-9和P.m-13), 采用多种方法对菌株进行鉴定, 得出其菌株具体信息后, 对其进行药敏实验, 以检验菌株安全性, 从而得到对药物高度敏感的拮抗菌株。为检验其生命力, 我们还对其进行了生长特性实验。根据体外酶活性测定结果, 我们初步推断产酶能力可能有助于其抑菌效果的发挥。本实验旨在从肠道微生态角度研发功能性饲料添加剂, 为斑节对虾工厂化健康养殖提供理论依据。
1. 材料与方法
1.1 材料与试剂
实验菌株 本实验室从山东滨州和东营某养殖基地的斑节对虾样品中分离得到的 14株斑节对虾肠道优势菌(编号: P.m-1、P.m-2······P.m-14), 养殖期间投喂量为体重的 8%—10%, 每天分4次投喂(6:00, 11:00, 17:00和22:00), 周期长约56d。全程曝气, 水温28—29℃, 盐度35—36, pH 8.0—8.6, 溶氧量≥7.5 mg/L, 总氨氮≤0.25 mg/L。每天上午9:00—10:00换水, 日换水量达总体积的30%。哈维氏弧菌从AHPND患病虾池中分离获得, 为本实验室保藏菌株。
培养基 TSA培养基、2216E培养基、MRS培养基、TCBS培养基和Biolog培养基均购自青岛海博生物技术有限公司。
试剂 斑节对虾配合饲料, 购自江门市特种水产饲料有限公司; HBIG14芽孢杆菌生化鉴定条和HBIG11乳酸菌生化鉴定条均购自青岛海博生物技术有限公司; 抗菌药物药敏纸片购自杭州微生物试剂有限公司。乙酰甲喹和萘啶酮酸购自上海源叶生物科技有限公司; 阿奇霉素、磺胺嘧啶、卡那霉素和氟苯尼考均购自北京索莱宝科技有限公司; TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0购自宝日医生物技术(北京)有限公司; DNA marker和TaqDNA聚合酶购自北京天根生化科技有限公司。
1.2 实验方法
优势菌的分离和纯化 无菌条件下取对虾的全肠于离心管中, 在冰浴条件下研磨匀浆。使用1% PBS溶液对研磨液进行10倍梯度稀释直至稀释倍数为10–5; 取各浓度梯度菌液(包括原液)各100 µL涂布于2216E固体培养基上, 每个梯度3个平行, 28℃恒温培养箱中倒置培养24—48h。挑取形态和颜色不相同的单菌落进行多次划线纯化, 确定为纯培养物后进行保种。
拮抗菌的筛选 采用牛津杯法对肠道优势菌进行筛选, 以哈维氏弧菌为指示菌。用移液器准确吸取0.1 mL哈维氏弧菌(108 cfu/mL)于2216E培养基上, 用玻璃涂布棒涂布均匀, 然后用镊子将牛津杯置于培养基中央, 轻压使其不易移动, 杯中分别加入0.2 mL优势菌悬液(108 cfu/mL)。将所有平板正置放入培养箱中28℃下培养48h, 进行抑菌圈直径的测定, 游标卡尺测量3次取平均值。
拮抗菌的菌株鉴定: 生理生化鉴定 使用成套生化鉴定试剂条按照相应说明书进行鉴定, 接种结束后做好标记。具体接种方法如下: 挑取菌落接种于营养琼脂斜面或平板。若试剂条中内容物为液体, 采用菌悬液法接种; 若内容物为固态, 则采用“之”字形划线接种或穿刺接种。测定项目包括: 硝酸盐还原、淀粉水解、V-P、七叶苷水解和精氨酸双水解酶等, 具体生化试验参照国家标准依据菌株而定。放置于(36±1)℃条件下进行培养, 厌氧生长生化管放入厌氧环境中进行培养。在培养结束后, 对比记录卡观察结果。参照伯杰氏细菌鉴定手册(第九版)和国家标准确定其分类地位。
16S rDNA技术及系统发育分析 在多次划线纯化后, 挑取平板单菌落, 通过16S rDNA 序列分析技术鉴定菌株。使用试剂盒法提取菌株的基因组DNA。所用引物为 27F (5'-AGTTTGATCMTGGCTCAG-3')和 1492R(5'-GGTTACCTTGTTACGACTT-3'), 通过聚合酶链反应(PCR)扩增提取DNA, 进行琼脂糖凝胶电泳检测。将纯化后的PCR产物, 送至生工生物工程(上海)股份有限公司测序, 应用BLAST软件将所得序列在GenBank的资源库中进行同源性分析。选取相应菌属及相似属的11株细菌的16S rDNA序列, 利用Mega 7.0软件构建系统发育树。
Biolog系统鉴定及表型代谢分析 按照接种培养流程进行操作。将纯化后的单菌落接种于Biolog琼脂平板划“十”字培养16—24h, 用接种棒挑取“十”字四边外半部分的菌落, 在IF-A接种液中分散制备菌悬液, 调整透光率为95%—98%, 静置5min后倾入“V”型贮液槽中, 用八道孔移液器每孔加100 μL菌悬液于GEN Ⅲ板条中, 置于30℃培养箱中孵育, 经Biolog自动微生物鉴定系统读取菌株基本信息(48h)和指纹代谢图谱(72h)。
肠道菌的耐药性分析 将2216E固体培养基灭菌后冷却至50℃左右, 按照0.5%的比例[5]分别加入阿奇霉素、磺胺嘧啶和卡那霉素等13种抗生素, 充分混匀后倒平板。取200 μL肠道优势菌涂布含药平板, 28℃培养48h后观察并记录肠道菌的生长结果。挑取含抗药平板上形态不一致的菌株纯化3—4次, 利用16S rDNA技术鉴定, 得到耐药菌的基本信息。
药敏纸片实验(纸片扩散法) 按1%的比例将菌株接种于2216E液体培养基中, 28℃振荡培养(135 r/min)18h备用。采用纸片琼脂扩散法进行耐药性分析: 在超净工作台内, 取肠道优势菌液200 μL, 均匀涂布TSA培养基, 将药敏纸片均匀贴布于培养基表面(每个平板贴布3—4片), 轻轻按压以防止移动。28℃培养48h后, 测定抗生素的抑菌圈直径。依据透明圈直径判定药物敏感性。
生长曲线的绘制 将P.m-1接种于TSB液体培养基中, 30℃下135 r/min振荡培养18h制成种子液。将P.m-1按1%的比例接种新鲜TSB培养基, 在96孔板中每孔加入250 μL 种子液。以空白TSB培养基为对照, 每次加样设置6个复孔。打开酶标仪系统, 放置96孔板, 选中扫描区域, 设置培养温度30℃, 测定波长600 nm。酶标仪自动振摇, 每隔2h读取OD600, 培养72h后结束实验。计算每个时间点的OD600平均值, 以培养时间为横坐标, 以OD600为纵坐标, 绘制待测菌株的生长曲线。
蛋白酶活性的测定 将P.m-1的发酵液(种子液)离心(6000 r/min, 10min), 分离上清液即为粗酶液。胞外蛋白酶活性采用Folin-酚法测定: 在pH为7.8的条件下, 粗酶液28℃水解酪蛋白10min, 1min产生1 μg酪氨酸为1个酶活力单位(U)。
2. 结果
2.1 优势菌的筛选结果
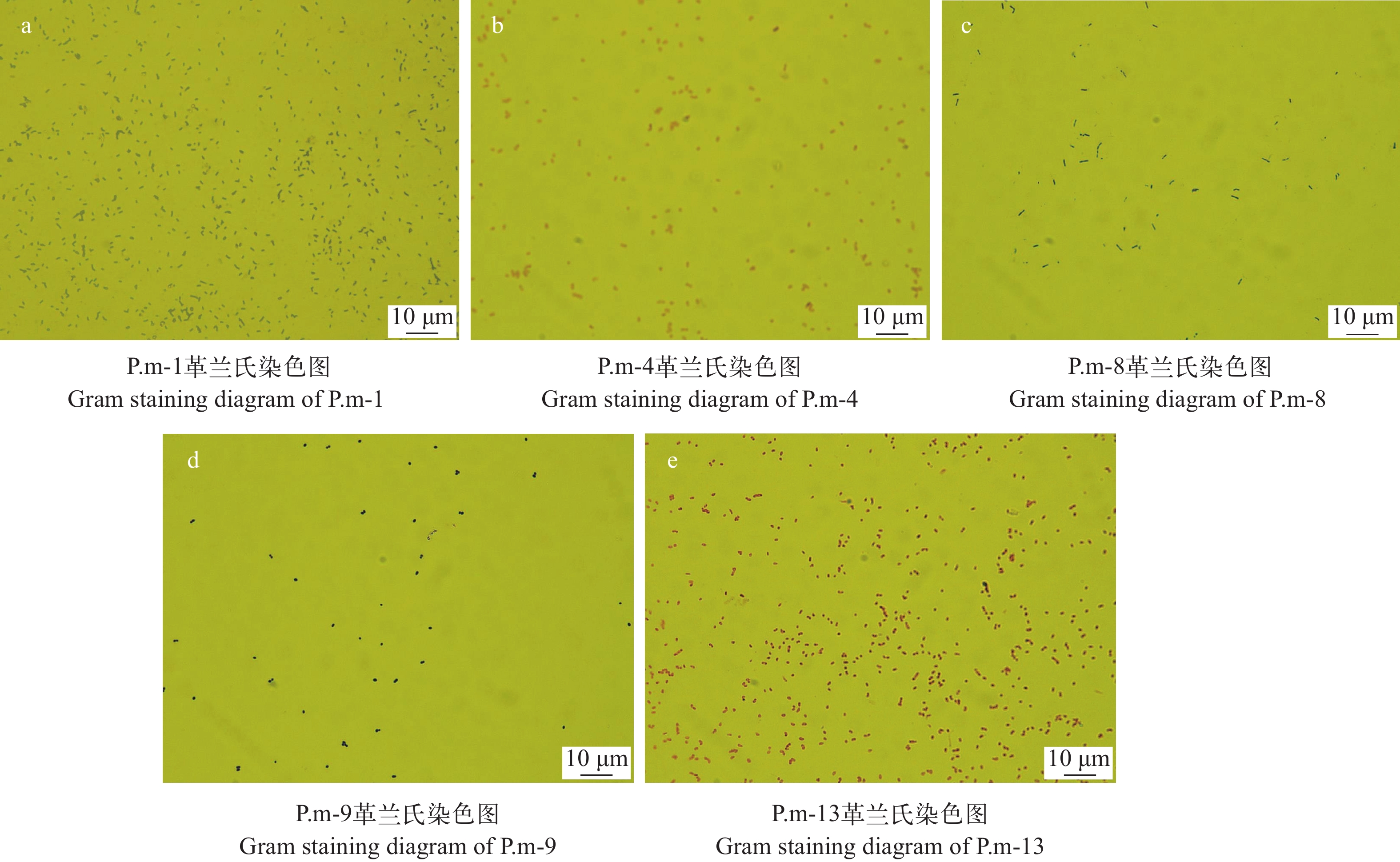
从健康斑节对虾肠道内分离纯化得到的细菌中, 挑选其中不同形态和颜色的14株优势菌株进行实验, 表 1和图 1展示具有代表性的优势菌的形态特征及革兰氏染色结果。
表 1 优势菌的形态特征及革兰氏染色结果Table 1. Morphological characteristics and Gram staining results of dominant strains菌株名称
Strain形态特征
Morphological characteristic革兰氏染色结果
Gram staining resultP.m-1 菌落呈不透明淡黄色、圆形粗糙、表面干燥无光泽、边缘不整齐 革兰氏阳性菌G+ P.m-4 菌落呈白色, 凸起, 有光泽 革兰氏阴性菌G– P.m-8 菌落呈半透明黄色、圆形小凸起、表面光滑、边缘整齐 革兰氏阳性菌G+ P.m-9 菌落呈乳白色, 圆形凸起、表面光泽、边缘整齐 革兰氏阳性菌G+ P.m-13 菌落呈黄色、圆形凸起、光滑湿润、黏稠状、边缘整齐 革兰氏阴性菌G– 2.2 拮抗菌的筛选结果
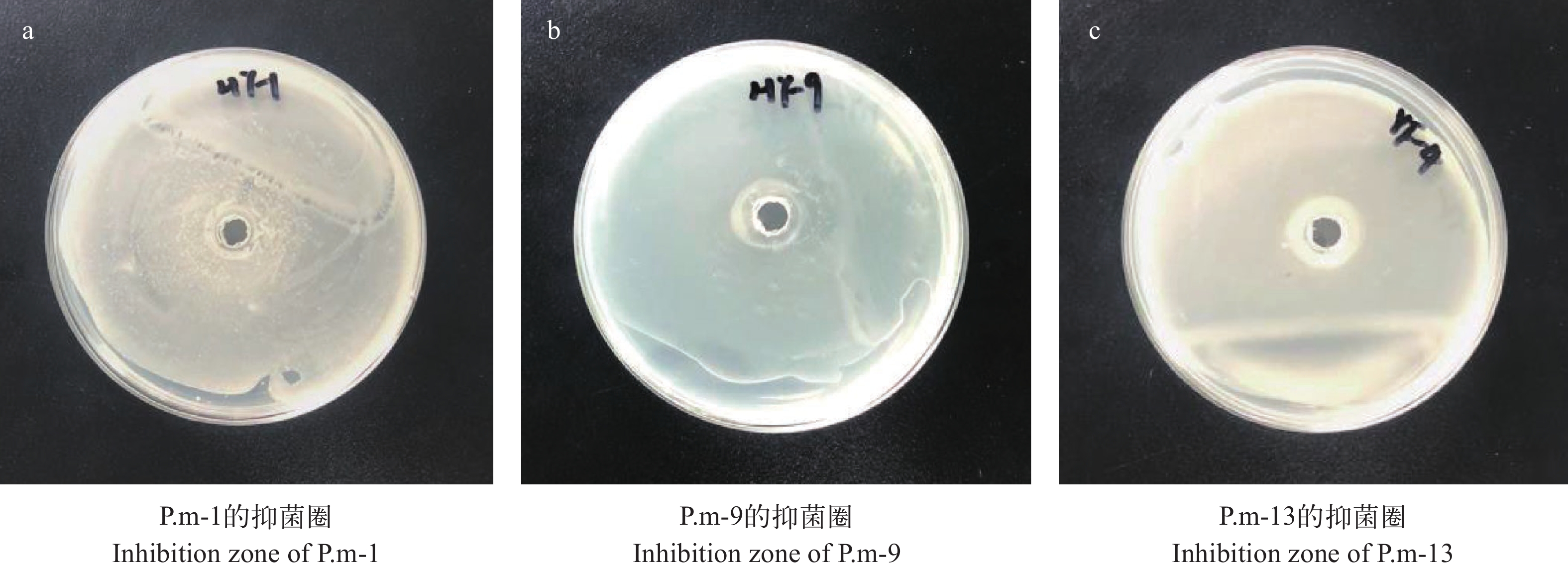
以哈维氏弧菌为病原菌, 从14株优势菌中筛选拮抗菌, P.m-1、P.m-9和P.m-13的抑菌效果表现为“+++”(图 2和表 2), 说明哈维氏弧菌对菌株P.m-1、P.m-9和P.m-13极敏感。本实验的拮抗标准[6]为: 抑菌圈直径>20 mm, 对于弧菌的抑制效果为极敏感“+++”; 15<抑菌圈直径<20 mm, 抑菌效果为高敏“++”; 10<抑菌圈直径<15 mm, 抑菌效果为中敏“+”; 抑菌圈直径<10 mm, 则抑菌效果为低敏或无效“–”。P.m-1、P.m-9和P.m-13具有明显的哈维氏弧菌抑制作用。抑菌效果是益生菌筛选的主要标准, 所以后续研究围绕P.m-1、P.m-9和P.m-13开展。
表 2 优势菌P.m-1、P.m-9和P.m-13对病原菌的抑制作用Table 2. Inhibtory activity of P.m-1, P.m-9 and P.m-13 to pathogen菌株类型
Strain抑菌圈直径
Diameter of inhibition
zone (mm)抑菌效果
Antibacterial effect结果判定
Evaluation resultsP.m-1 26—30 +++ 极敏感 P.m-2 8—9 – 无效 P.m-3 8—9 – 无效 P.m-4 7 – 无效 P.m-5 5—6 – 无效 P.m-6 8 + 中敏 P.m-7 8—9 – 无效 P.m-8 10 – 无效 P.m-9 33—35 +++ 极敏感 P.m-10 4—5 – 无效 P.m-11 11 + 中敏 P.m-12 3—5 – 无效 P.m-13 32—37 +++ 极敏感 P.m-14 8—9 – 无效 2.3 拮抗菌的鉴定
生理生化结果 根据生理生化实验结果(表 3), 参照伯杰手册和国家标准GB 4789.35-2016, P.m-1被鉴定为枯草芽孢杆菌(Bacillus subtilis), P.m-9被鉴定为乳酸菌属, P.m-13被鉴定为溶藻弧菌(Vibrio alginolyticus)。
表 3 P.m-1、P.m-9和P.m-13的生化鉴定结果Table 3. Biochemical identification of P.m-1, P.m-9 and P.m-13P.m-1的生化鉴定结果
Biochemical identification result of P.m-1生化项目
Item结果
Result生化项目
Item结果
ResultV-P + 明胶液化 + 柠檬酸盐 – 7%NaCl生长 + 丙酸盐 – pH5.7生长 + D-木糖 + 硝酸盐还原 + L-阿拉伯糖 + 淀粉水解 + D-甘露糖 – 厌氧生长 + P.m-9的生化鉴定结果
Biochemical identification result of P.m-9生化项目
Item结果
Result生化项目
Item结果
Result七叶苷 + 山梨醇 – 纤维二糖 + 蔗糖 + 麦芽糖 + 棉子糖 – 甘露糖 + 菊糖 + 水杨苷 + 乳糖 + P.m-13的生化鉴定结果
Biochemical identification result of P.m-13生化项目
Item结果
Result生化项目
Item结果
Result1%NaCl葡萄糖 + 1%NaCl氨基酸对照 胨水(VP、MR) +/+ 1%精氨酸双水解酶 + 1%蛋白胨水(靛基质) – 1%精氨酸双水解酶对照 1%NaCl蔗糖 + 无盐胨水 – 1%NaCl甘露糖 + 3%NaCl胨水 + 1%NaCl阿拉伯糖 + 6%NaCl胨水 + 1%肌醇 – 8%NaCl胨水 + 1%NaCl赖氨酸 + 10%NaCl胨水 + 16S rDNA基因序列分析 送测的16S rDNA基因序列, 提交到GenBank数据库(https://www.ncbi.nlm.nih.gov/), 进行Blast序列比对。结果表明P.m-1与枯草芽孢杆菌(Bacillus subtilis)相似性最高, 达100.00%; P.m-9与屎肠球菌(Enterococcus faecium)同源性最高, 达100.00%; P.m-13与溶藻弧菌(Vibrio alginolyticus)同源性最高, 达100.00%。选取相应菌属及相似属的11株细菌的16S rDNA序列, 利用Mega 7.0软件构建系统发育树。发育树(图 3)的结果表明, P.m-1与枯草芽孢杆菌亲缘关系最近, P.m-9与屎肠球菌亲缘关系最近, P.m-13与溶藻弧菌亲缘关系最近。
Biolog系统鉴定结果 Biolog系统读取GEN Ⅲ板并给出4个匹配度最高的细菌种类(表 4)。鉴定结果包括3个参数, 可能性(PROB)表示可能性大小, 相似性(SIM)和位距(DIST)表示准确性和精确度。48h的培养结果表明, P.m-1、P.m-9和P.m-13为枯草芽孢杆菌(Bacillus subtilis)、海氏肠球菌(Enterococcus hirae)和溶藻弧菌(Vibrio alginolyticus), 鉴定概率分别为95.3%、71.1%和89.7%。
表 4 P.m-1和P.m-9的Biolog鉴定结果Table 4. Identification of intestinal bacteria P.m-1 and P.m-9 (Biolog method)编号
Number鉴定结果
Identification result中文名称
Chinese name可能性
PROB (%)相似性
SIM (%)位距
DIS培养时间
Incubation time (h)P.m-1 Bacillus subtilis 枯草芽孢杆菌 0.953 0.953 5.027 48 P.m-9 Enterococcus hirae 海氏肠球菌 0.711 0.711 4.135 48 P.m-13 Vibrio alginolyticus 溶藻弧菌 0.897 0.897 4.213 48 根据16S rDNA技术、Biolog系统鉴定及生理生化实验结果, 最终确定P.m-1、P.m-9和P.m-13分别为枯草芽孢杆菌(Bacillus subtilis)、屎肠球菌(Enterococcus faecium)和溶藻弧菌(Vibrio alg inolyticus)。
2.4 药敏实验结果
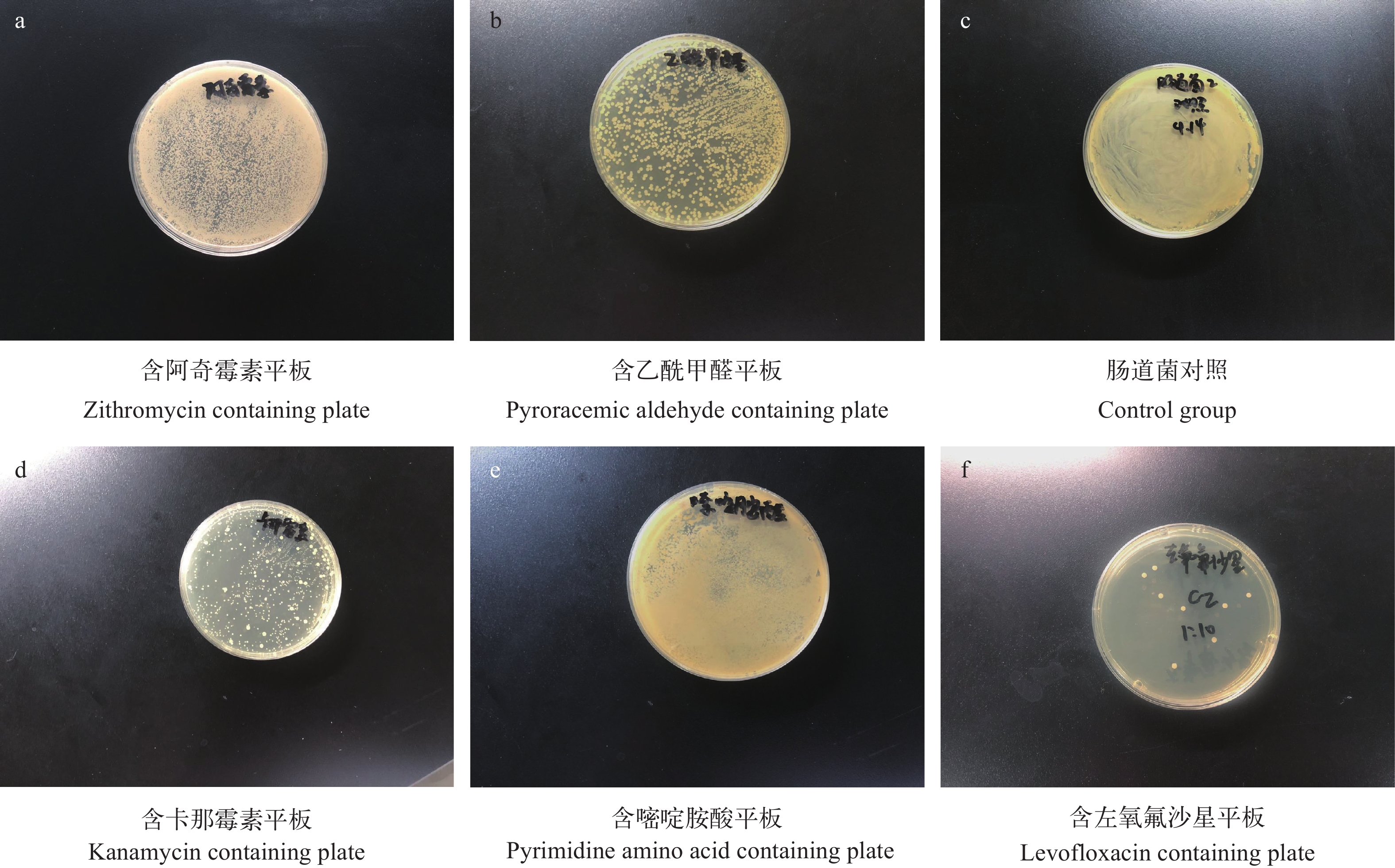
肠道菌的耐药性分析 在含药平板上生长的单菌落(图 4)经纯化后送测, BLAST比对后得到斑节对虾肠道菌基本的耐药情况(表 5)。实验结果表明, P.m-1、P.m-9和P.m-13均不属于肠道耐药菌。
表 5 肠道耐药菌测序结果、菌株名称及登录号Table 5. Sequencing results, name and Genbank accession of intestinal drug-resistant bacteria送测编号及抗生素种类
Sequencing numbers and drugsBLAST结果
BLAST results菌株中文名称
Chinese name登录号
GenBank AccessionA1 阿奇霉素 Staphylococcus saprophyticus 腐生性葡萄
球菌MK073020.1 F1 氟苯尼考 Staphylococcus
arlettae阿尔莱(特)
葡萄球菌MK748242.1 F2 氟苯尼考 Acinetobacter
oryzae米不动杆菌 MN704435.1 H2-1 磺胺嘧啶 Shewanella algae 海藻施万氏菌 MT185147.1 K1-1 卡那霉素 Staphylococcus haemolyticus 溶血葡萄球菌 KJ847335.1 K1-2 卡那霉素 Enterococcus diestrammenae 哥伦比亚肠
球菌NR_135720.1 M1-2 萘啶酮酸 Exiguobacterium aestuarii 海岸微小杆菌 MW192903.1 M2 萘啶酮酸 Acinetobacter johnsonii 约氏不动杆菌 CP043307.1 Y1 乙酰甲喹 Staphylococcus haemolyticus 溶血葡萄球菌 JF784022.1 Y2-2 乙酰甲喹 Aerococcus
viridans病毒气球菌 KC692208.1 Z2 左氧氟沙星 Staphylococcus
pasteuri巴氏葡萄球菌 KT986165.1 药敏纸片实验结果 根据NCCLS的最新判断标准, P.m-1对青霉素、羧苄西林、哌拉西林、头孢氨苄、头孢唑林、头孢拉定和呋喃唑酮具有耐药性(R), 对氨苄西林、头孢他啶、四环素和克林霉素中度敏感(I), 对其他抗生素均表现为敏感(S); P.m-9表现出对诺氟沙星敏感(S), 对庆大霉素和麦迪霉素中度敏感(I), 对其他抗生素均具有耐药性(R); P.m-13对卡那霉素、新霉素、四环素、多西环素和多黏霉素B敏感(S), 对头孢他啶、丁胺卡那和万古霉素中度敏感(I), 对其他抗生素均耐药(R) (表 6)。耐药菌株给生产带来损失的同时对人体健康有害, 因此选取对药敏性高的P.m-1进行后续的生长特性实验。
表 6 P.m-1、P.m-9和P.m-13的药敏实验结果Table 6. The antibiotic susceptibility of P.m-1, P.m-9 and P.m-13抗生素名称
Antimicrobialagents纸片药含量 (μg/片)
Concentration
per discP.m-1 P.m-9 P.m-13 抑菌圈直径
Diameter (mm)判断结果
Result抑菌圈直径
Diameter (mm)判断结果
Result抑菌圈直径
Diameter (mm)判断结果
Results青霉素 10 U 19 R 0 R 0 R 苯唑西林 1 38—41 S 0 R 0 R 氨苄西林 10 14 I 0 R 0 R 羧苄西林 100 18—20 R 0 R 0 R 哌拉西林 100 10—12 R 0 R 0 R 头孢氨苄 30 0 R 0 R 12 R 头孢唑啉 30 0 R 0 R 12—13 R 头孢拉定 30 0 R 0 R 14 R 头孢他啶 30 14—15 I 0 R 20 I 头孢哌酮 75 40—43 S 13 R 0 R 丁胺卡那 30 26 S 8 R 14 I 庆大霉素 10 26 S 8 I 9 R 卡那霉素 30 38 S 8 R 0 S 新霉素 30 22—24 S 8—9 R 16 S 四环素 30 17 I 8 R 28—29 S 多西环素 30 18—19 S 12 R 19 R 红霉素 15 23—24 S 11 R 17 R 麦迪霉素 30 21—24 S 16—20 I 11 R 诺氟沙星 10 23—25 S 18—20 S 14 R 氧氟沙星 5 24—30 S 0 R 15—16 R 环丙沙星 5 26—30 S 0 R 15 R 万古霉素 30 25—27 S 0 R 10 I 多黏霉素B 300 22—23 S 0 R 17 S 呋喃唑酮 300 11 R 0 R 0 R 氯霉素 30 32 S 0 R 0 R 克林霉素 2 18—20 I 12 R 0 R 2.5 P.m-1的生长曲线
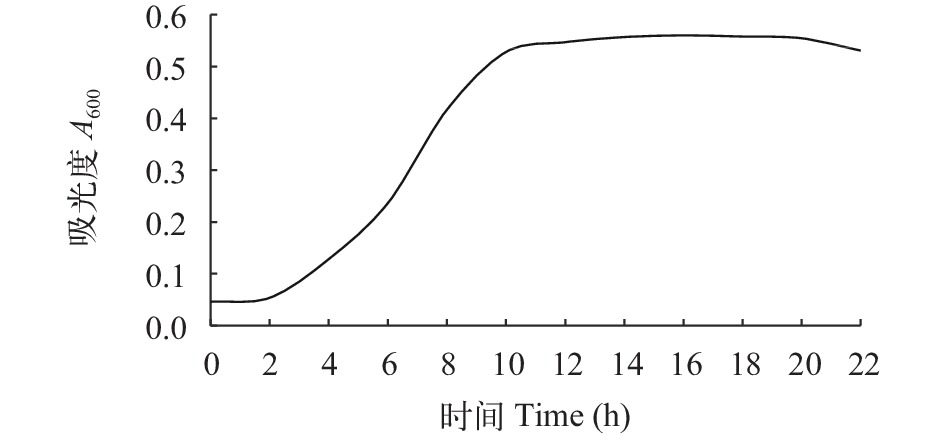
在P.m-1的生长过程中, 0—2h是生长缓滞期, 2—10h为生长对数期, 10—22h 为平台期, 22h步入衰亡期。2—10h, P.m-1的生命力最强, 生长速率最大, 代谢活性最旺盛。而后由于营养物质消耗及有害代谢产物积累, 细胞衰老甚至出现自溶现象, 培养22h后菌体的密度明显下降(图 5)。在培养过程中, 10h的悬液OD600值最高, 菌体密度可达1.14×109 cfu/mL, 表明P.m-1生命力强劲。
2.6 Biolog代谢特征分析
Biolog细菌全自动鉴定系统的GEN Ⅲ微孔板中含有不同的底物, 培养过程中发生氧化还原反应和同化反应, 比对Gen Ⅲ微孔板底物及鉴定特征项目, 可以得到细菌代谢特征的“指纹图谱”。P.m-1代谢的底物种类有18种, 主要包括糊精、D-麦芽糖等; 同化底物种类主要包括D-山梨醇、D-甘露醇等(图 6)。此外, Biolog结果还提示P.m-1具有消化能力, 如氨基酸代谢。
![]() 图 6 P.m-1在鉴定板上的代谢指纹图谱a. P.m-1的鉴定表型; b. GEN Ⅲ鉴定板碳源组成; c. GEN Ⅲ鉴定板鉴定项目; 图a中A—C行的结果反映细菌对碳源的利用程度, D—H行的结果反映细菌对碳源的同化程度Figure 6. Metabolic fingerprint of P.m-1 on identification boarda. phenotypic identification of P.m-1; b. carbon source composition of Gen Ⅲ identification board; c. Identification items of Gen Ⅲ identification board. The results of lines A to C in figure a reflect the degree of utilization of carbon sources, and the results of lines D to H reflect the degree of assimilation of carbon sources
图 6 P.m-1在鉴定板上的代谢指纹图谱a. P.m-1的鉴定表型; b. GEN Ⅲ鉴定板碳源组成; c. GEN Ⅲ鉴定板鉴定项目; 图a中A—C行的结果反映细菌对碳源的利用程度, D—H行的结果反映细菌对碳源的同化程度Figure 6. Metabolic fingerprint of P.m-1 on identification boarda. phenotypic identification of P.m-1; b. carbon source composition of Gen Ⅲ identification board; c. Identification items of Gen Ⅲ identification board. The results of lines A to C in figure a reflect the degree of utilization of carbon sources, and the results of lines D to H reflect the degree of assimilation of carbon sources2.7 产酶能力评价
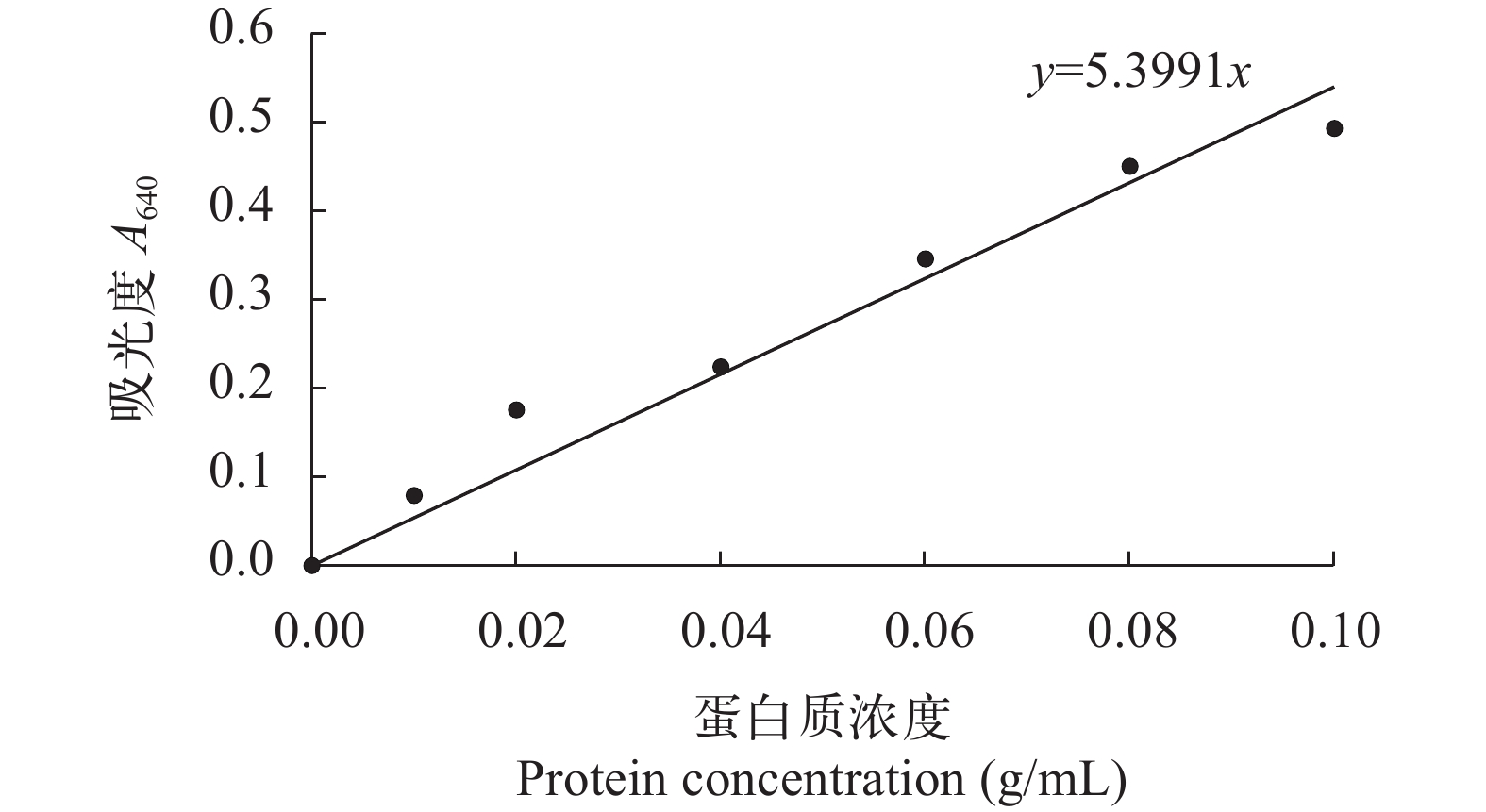
经Biolog指纹代谢图谱提示, 测定P.m-1发酵上清液的蛋白酶活性。本实验测得发酵上清液的OD值为0.14, 根据标准曲线(图 7)并结合稀释倍数计算得到枯草芽孢杆菌P.m-1的胞外蛋白酶活性可达259 U。由此得出枯草芽孢杆菌P.m-1具有较强蛋白消化能力, 可能为其生长提供条件。
3. 讨论
当前国内对虾养殖业的问题颇多, 其中一大原因就是疾病威胁, AHPND就是其中的一种。目前许多研究和实践已经证明, 可以动物体土著菌作为益生菌株, 以菌治菌, 解决斑节对虾的疾病问题。本实验从健康斑节对虾肠道中筛选AHPND病原菌——哈维氏弧菌的拮抗菌株, 在经过耐药性检验、生长特性分析和产酶效果评价后, 发现拮抗菌P.m-1具有良好益生菌潜质。后续将在实践中试用此菌种, 以评价其在疾病防控的效果。
3.1 对虾益生菌的筛选与鉴定
对虾属于无脊椎甲壳类动物, 主要依赖非特异性免疫系统发挥功能。在水生动物体内, 肠道菌群具有调节作用, 其中的益生菌发挥益生机制, 抑制或杀灭外来病原菌, 进而维持肠道稳态。在宿主肠道内实现定植, 是益生菌发挥作用的首要条件。由于土著菌对肠原生态具有较好的适应性, 这往往使得定植作用更易实现。对病原菌具有抑制效果, 这是益生菌的功能性要求[7]。目前, 体外拮抗实验仍作为抗病益生菌筛选的主流方法。本实验牛津杯法筛选出对病原菌具有良好抑制效果的土著菌——P.m-1、P.m-9和P.m-13。
对筛选出的拮抗菌进行种属鉴定, 是承上启下的重要步骤[8]: 精确的分类地位不仅有利于明确菌种信息, 而且有利于了解研究进展和应用现状。目前存在多种菌株的鉴定方法, 一般来说我们会综合多种方法, 并辅以生理生化特征验证。本实验主要采取了3种方法, 以保证结果的准确性。其中, 16S rDNA 技术基于序列的进化保守性, 鉴定结果比较准确, 可作为菌株鉴定的主要方法[9]。经鉴定, P.m-1、P.m-9和P.m-13分别为枯草芽孢杆菌(Bacillus subtilis)、屎肠球菌(Enterococcus faecium)和溶藻弧菌(Vibrio alginolyticus)。
3.2 芽孢杆菌属的益生潜质
本实验中P.m-1具有弧菌拮抗活性, 我们可以充分利用其这一特性, 将P.m-1添加于养殖生产饲料, 进而有效防控对虾AHPND。据报道芽孢杆菌属具有多种益生作用, 例如Irasema等[10]曾从对虾肠道中分离出4株非溶血性芽孢杆菌, 对创伤弧菌(Vibrio vulnificus)、坎氏弧菌(Vibrio campbelli)、副溶血弧菌和溶藻弧菌(Vibrio alginolyticus)均具有明显的拮抗作用。 Lins等[11]发现枯草芽孢杆菌的添加有利于提升银鲶(Rhamdia quelen)的生长性能; Cao等[12]研究发现补充枯草芽孢杆菌显著改善了彭泽鲫(Carassius auratus var. Pengze)肠道的褶皱高度和微绒毛高度; Xia等[13]的研究表明投喂枯草芽孢杆菌能够显著增加尼罗罗非鱼肠道微绒毛密度、微绒毛长度以及周长比(肠腔内周长与肠外周长之比)。
Werasan等[14]从健康对虾体内筛选到1株可以抑制多种AHPND致病副溶血弧菌的潜在益生菌——枯草芽孢杆菌AQAHBS001, 将其添加进饲料可显著降低WSSV病毒的胁迫致死率, 改善微绒毛和肠壁厚度等中肠结构特征, 提高凡纳滨对虾的生长性能, 增强吞噬细胞活性并且提高病毒清除效率。Subuntith等[15]从斑节对虾肠道和生长环境中分别分离出两株芽孢杆菌, 通过冻干、微胶囊形式加入水中或者富集卤虫进行饲喂, 结果表明不同给药方式均可显著提升凡纳滨对虾早期发育过程的生长性能和存活率, 增加机体和养殖水体的有益细菌丰度, 并改善pH、氨氮和亚硝态氮含量等养殖水质指标。
3.3 潜在益生菌的安全性评价
粪肠球菌调节动物肠道菌群, 提高动物生长性能, 提高机体抗病能力。张棋等[16]报道屎肠球菌和粪肠球菌(Enterococcus faecalis)具有拮抗病原菌作用和一定益生效果。溶藻弧菌当基因表达改变时, 也可促进凡纳滨对虾幼体的生长, 提高幼虾的成活率[17], 增强水生动物的免疫力和抗病力[18]。本实验通过对肠道菌进行耐药性检测, 发现P.m-1、P.m-9和P.m-13不在肠道耐药菌之列。耐药菌在水产养殖上并不可取, 因为其不仅会导致多种病害, 造成经济损失; 而且通过抗生素抗性基因(ARGs)接合等方式, 产生健康影响。
抗生素耐药性模型的建立是保障益生菌安全性的重要步骤[19]。药敏纸片实验(纸片扩散法)进一步表明, P.m-9和P.m-13对大多数抗生素都具有抗性, P.m-1的抗生素药敏性较强, 因此P.m-9和P.m-13并不符合安全要求, 而P.m-1具有成为益生菌的潜质。枯草芽孢杆菌曾先后被美国食品药物管理局(FDA)和中国农业农村部列为饲料添加安全菌株[20]。目前已作为益生菌制剂, 广泛应用于人体及其他动物。而且P.m-1取自对虾, 这也在一定程度上能够保障其安全性[21]。
Yang等[22]对在淡水鱼养殖中对解淀粉芽孢杆菌(Bacillus amyloliquefaciens)进行安全性评价, 通过评估其对草鱼(Ctenopharyngodon idella)、银鲫(Carassius gibelio)和鲢(Hypophthalmichthys molitrix)的混养池微生物群落的影响, 得出菌株具有高度安全性的结论。Muhamad等[23]从克氏原螯虾肠道中分离出3株具有抑菌活性的潜在益生菌——枯草芽孢杆菌FS6、贝莱斯芽孢杆菌FS26和短小芽孢杆菌(Bacillus pumilus)FS97, 根据抗生素敏感性分析和溶血活性实验, 他们认为分离的芽孢杆菌属具有一定安全性。Kim等[24]对31株凝结芽孢杆菌(Bacillus coagulans)进行毒素基因、溶血活性和抗生素耐药性检测, 发现凝结芽孢杆菌具有一定的安全性。
3.4 益生菌筛选的其他要求
在满足菌株安全性的前提下, 益生菌能否快速生长繁殖, 也是发挥拮抗作用的关键[25]。肠道作为一个复杂的生态系统, 其中的微生物既互利共生又相互制约, 共同促进菌群平衡。一方面, 益生菌吸收营养物质, 有利于占据定殖位点, 形成和维持优势地位; 另一方面, 通过分泌胞外产物, 竞争性排斥病原菌, 抑制条件致病菌的生长。本实验P.m-1对数生长期末菌体密度可达1.14×109 cfu/mL, 表明P.m-1生命力强劲, 满足作为益生菌的生长速度需求。
胞外酶的产生种类和能力成为益生菌筛选的又一重要标准。王佰涛等[26]发现蜡样芽孢杆菌W21-B5具有较强的产蛋白酶和产淀粉酶功能; 朱永明等[27]筛选得到最优抑制大肠杆菌的淀粉芽孢杆菌B-4M-6, 具有最佳产淀粉酶、蛋白酶和纤维素酶的能力。本实验通过测定悬液中的消化酶活性, 初步推断所得的枯草芽孢杆菌P.m-1通过分泌蛋白酶发挥益生作用。据报道, 消化酶在动物体肠道保持一定的比例, 帮助宿主消化食物的同时, 还可以分解水中的残饵杂质等[28]。
3.5 芽孢杆菌属的作用机制
枯草芽孢杆菌DSM33018降解由质粒PirAVP和PirBVP基因编码的AHPND毒素[29]。Riet等[30]对枯草芽孢杆菌进行基因编辑, 产生与WSSV vp28基因的互补dsRNA, 从而抑制WSSV病毒的复制活动。枯草芽孢杆菌E20能够加强凡纳滨对虾对氨基酸的吸收, 通过谷氨酰胺代谢和己糖胺生物合成途径(HBP)改善免疫机能[31]。枯草芽孢杆菌的表面活性素(Surfactin)通过ERK和PI3K/AKT通路抑制细胞周期进展并诱导细胞凋亡[32]。枯草芽孢杆菌通过宿主细胞膜转运蛋白(OCTN2)介导的群体感应信号分子CSF(Sporulation factor), 激活AKT和p38 MAPK通路, 诱导热休克蛋白的产生, 抑制肠道上皮细胞产生氧化损伤现象[33]。
此外, 目前针对其他芽孢杆菌属的菌种学界也多有报道。解淀粉芽孢杆菌的多糖EPS-K4可以刺激机体分泌黏蛋白、减少血清中毒力物质含量[34], 还可以用来维持肠道屏障完整性等。解淀粉芽孢杆菌CBSYD产生的抗氧化肽YD1具有强氧化活性, 通过Nrf-2转录因子介导血红素加氧酶-1(HO-1)的表达发挥作用[35]。此外, 表面活性素还作为一种群体感应信号分子, 影响解淀粉芽孢杆菌碳代谢过程中的多项反应, 如糖酵解途径和TCA循环等[36]。
本实验P.m-1益生作用的发挥可能与其蛋白酶分泌能力有关, 具体的分子机制有待于通过实验设计探明。芽孢杆菌属除可用于增强动物的体质和防治疾病, 而且具有一定的缓解应激以及改善水质的作用。Zhao等[37]发现枯草芽孢杆菌产生的脂肽可以促进铅离子(Pb2+)的富集和沉淀, 在此之前的实验研究还证明过枯草芽孢杆菌产生的脂肽可以将银离子(Ag+)还原为银纳米颗粒(AgNPs)[38]。张峰峰等[39]研究得到枯草芽孢杆菌可以有效降低水体pH, 刘晓燕等[40]还通过研究发现枯草芽孢杆菌能够显著降低水体氨氮含量、硝态氮含量及化学需氧量(COD值)。后续将尝试本实验获得的潜在益生菌株用于水体, 检验其在水质调节方面的作用效果。
-
图 6 P.m-1在鉴定板上的代谢指纹图谱
a. P.m-1的鉴定表型; b. GEN Ⅲ鉴定板碳源组成; c. GEN Ⅲ鉴定板鉴定项目; 图a中A—C行的结果反映细菌对碳源的利用程度, D—H行的结果反映细菌对碳源的同化程度
Figure 6. Metabolic fingerprint of P.m-1 on identification board
a. phenotypic identification of P.m-1; b. carbon source composition of Gen Ⅲ identification board; c. Identification items of Gen Ⅲ identification board. The results of lines A to C in figure a reflect the degree of utilization of carbon sources, and the results of lines D to H reflect the degree of assimilation of carbon sources
表 1 优势菌的形态特征及革兰氏染色结果
Table 1 Morphological characteristics and Gram staining results of dominant strains
菌株名称
Strain形态特征
Morphological characteristic革兰氏染色结果
Gram staining resultP.m-1 菌落呈不透明淡黄色、圆形粗糙、表面干燥无光泽、边缘不整齐 革兰氏阳性菌G+ P.m-4 菌落呈白色, 凸起, 有光泽 革兰氏阴性菌G– P.m-8 菌落呈半透明黄色、圆形小凸起、表面光滑、边缘整齐 革兰氏阳性菌G+ P.m-9 菌落呈乳白色, 圆形凸起、表面光泽、边缘整齐 革兰氏阳性菌G+ P.m-13 菌落呈黄色、圆形凸起、光滑湿润、黏稠状、边缘整齐 革兰氏阴性菌G– 表 2 优势菌P.m-1、P.m-9和P.m-13对病原菌的抑制作用
Table 2 Inhibtory activity of P.m-1, P.m-9 and P.m-13 to pathogen
菌株类型
Strain抑菌圈直径
Diameter of inhibition
zone (mm)抑菌效果
Antibacterial effect结果判定
Evaluation resultsP.m-1 26—30 +++ 极敏感 P.m-2 8—9 – 无效 P.m-3 8—9 – 无效 P.m-4 7 – 无效 P.m-5 5—6 – 无效 P.m-6 8 + 中敏 P.m-7 8—9 – 无效 P.m-8 10 – 无效 P.m-9 33—35 +++ 极敏感 P.m-10 4—5 – 无效 P.m-11 11 + 中敏 P.m-12 3—5 – 无效 P.m-13 32—37 +++ 极敏感 P.m-14 8—9 – 无效 表 3 P.m-1、P.m-9和P.m-13的生化鉴定结果
Table 3 Biochemical identification of P.m-1, P.m-9 and P.m-13
P.m-1的生化鉴定结果
Biochemical identification result of P.m-1生化项目
Item结果
Result生化项目
Item结果
ResultV-P + 明胶液化 + 柠檬酸盐 – 7%NaCl生长 + 丙酸盐 – pH5.7生长 + D-木糖 + 硝酸盐还原 + L-阿拉伯糖 + 淀粉水解 + D-甘露糖 – 厌氧生长 + P.m-9的生化鉴定结果
Biochemical identification result of P.m-9生化项目
Item结果
Result生化项目
Item结果
Result七叶苷 + 山梨醇 – 纤维二糖 + 蔗糖 + 麦芽糖 + 棉子糖 – 甘露糖 + 菊糖 + 水杨苷 + 乳糖 + P.m-13的生化鉴定结果
Biochemical identification result of P.m-13生化项目
Item结果
Result生化项目
Item结果
Result1%NaCl葡萄糖 + 1%NaCl氨基酸对照 胨水(VP、MR) +/+ 1%精氨酸双水解酶 + 1%蛋白胨水(靛基质) – 1%精氨酸双水解酶对照 1%NaCl蔗糖 + 无盐胨水 – 1%NaCl甘露糖 + 3%NaCl胨水 + 1%NaCl阿拉伯糖 + 6%NaCl胨水 + 1%肌醇 – 8%NaCl胨水 + 1%NaCl赖氨酸 + 10%NaCl胨水 + 表 4 P.m-1和P.m-9的Biolog鉴定结果
Table 4 Identification of intestinal bacteria P.m-1 and P.m-9 (Biolog method)
编号
Number鉴定结果
Identification result中文名称
Chinese name可能性
PROB (%)相似性
SIM (%)位距
DIS培养时间
Incubation time (h)P.m-1 Bacillus subtilis 枯草芽孢杆菌 0.953 0.953 5.027 48 P.m-9 Enterococcus hirae 海氏肠球菌 0.711 0.711 4.135 48 P.m-13 Vibrio alginolyticus 溶藻弧菌 0.897 0.897 4.213 48 表 5 肠道耐药菌测序结果、菌株名称及登录号
Table 5 Sequencing results, name and Genbank accession of intestinal drug-resistant bacteria
送测编号及抗生素种类
Sequencing numbers and drugsBLAST结果
BLAST results菌株中文名称
Chinese name登录号
GenBank AccessionA1 阿奇霉素 Staphylococcus saprophyticus 腐生性葡萄
球菌MK073020.1 F1 氟苯尼考 Staphylococcus
arlettae阿尔莱(特)
葡萄球菌MK748242.1 F2 氟苯尼考 Acinetobacter
oryzae米不动杆菌 MN704435.1 H2-1 磺胺嘧啶 Shewanella algae 海藻施万氏菌 MT185147.1 K1-1 卡那霉素 Staphylococcus haemolyticus 溶血葡萄球菌 KJ847335.1 K1-2 卡那霉素 Enterococcus diestrammenae 哥伦比亚肠
球菌NR_135720.1 M1-2 萘啶酮酸 Exiguobacterium aestuarii 海岸微小杆菌 MW192903.1 M2 萘啶酮酸 Acinetobacter johnsonii 约氏不动杆菌 CP043307.1 Y1 乙酰甲喹 Staphylococcus haemolyticus 溶血葡萄球菌 JF784022.1 Y2-2 乙酰甲喹 Aerococcus
viridans病毒气球菌 KC692208.1 Z2 左氧氟沙星 Staphylococcus
pasteuri巴氏葡萄球菌 KT986165.1 表 6 P.m-1、P.m-9和P.m-13的药敏实验结果
Table 6 The antibiotic susceptibility of P.m-1, P.m-9 and P.m-13
抗生素名称
Antimicrobialagents纸片药含量 (μg/片)
Concentration
per discP.m-1 P.m-9 P.m-13 抑菌圈直径
Diameter (mm)判断结果
Result抑菌圈直径
Diameter (mm)判断结果
Result抑菌圈直径
Diameter (mm)判断结果
Results青霉素 10 U 19 R 0 R 0 R 苯唑西林 1 38—41 S 0 R 0 R 氨苄西林 10 14 I 0 R 0 R 羧苄西林 100 18—20 R 0 R 0 R 哌拉西林 100 10—12 R 0 R 0 R 头孢氨苄 30 0 R 0 R 12 R 头孢唑啉 30 0 R 0 R 12—13 R 头孢拉定 30 0 R 0 R 14 R 头孢他啶 30 14—15 I 0 R 20 I 头孢哌酮 75 40—43 S 13 R 0 R 丁胺卡那 30 26 S 8 R 14 I 庆大霉素 10 26 S 8 I 9 R 卡那霉素 30 38 S 8 R 0 S 新霉素 30 22—24 S 8—9 R 16 S 四环素 30 17 I 8 R 28—29 S 多西环素 30 18—19 S 12 R 19 R 红霉素 15 23—24 S 11 R 17 R 麦迪霉素 30 21—24 S 16—20 I 11 R 诺氟沙星 10 23—25 S 18—20 S 14 R 氧氟沙星 5 24—30 S 0 R 15—16 R 环丙沙星 5 26—30 S 0 R 15 R 万古霉素 30 25—27 S 0 R 10 I 多黏霉素B 300 22—23 S 0 R 17 S 呋喃唑酮 300 11 R 0 R 0 R 氯霉素 30 32 S 0 R 0 R 克林霉素 2 18—20 I 12 R 0 R -
[1] 王晓璐, 李乐, 王友红, 等. 南非斑节对虾肠道组织结构及菌群特征、代谢活性研究 [J]. 广西科学院学报, 2019, 35(4): 325-331. Wang X L, Li L, Wang Y H, et al. Research on organization structure, micro-flora characteristics and metabolic activity of Penaeus monodon [J]. Journal of Guangxi Academy of Sciences, 2019, 35(4): 325-331.
[2] 樊英, 王晓璐, 刘吉丹, 等. 盐度胁迫对非洲斑节对虾生理特征的影响 [J]. 广西科学院学报, 2021, 37(2): 123-132. Fan Y, Wang X L, Liu J D, et al. Effects of salinity stress on physiological characteristics of Penaeus monodon [J]. Journal of Guangxi Academy of Sciences, 2021, 37(2): 123-132.
[3] Duan Y F, Liu Q, Wang Y, et al. Impairment of the intestine barrier function in Litopenaeus vannamei exposed to ammonia and nitrite stress [J]. Fish & Shellfish Immunology, 2018(78): 279-288.
[4] 郑军荣, 罗婷, 李志强, 等. 4株凡纳滨对虾肠道益生菌分离、鉴定及应用研究 [J]. 水产科学, 2019, 38(3): 320-326. Zheng J R, Luo T, Li Z Q, et al. Isolation, identification and application of four intestinal probiotics from Pacific white shrimp Litopenaeus vannamei [J]. Fisheries Science, 2019, 38(3): 320-326.
[5] 龚发源. 饲用益生枯草芽孢杆菌的食品安全性评价研究 [D]. 武汉: 华中农业大学, 2016: 20-30. Gong F Y. Study on food safety assessment of probiotic Bacillus subtilis used in animal feed [D]. Wuhan: Huazhong Agricultural University, 2016: 20-30.
[6] 王文君. 一株弧菌拮抗菌的鉴定、抑菌特性及应用效果的初步研究 [D]. 青岛: 中国海洋大学, 2015: 18-23. Wang W J. Preliminary studies of identification, inhibitory characteristics and application of an antagonistic bacterium strain against vibrio [D]. Qingdao: Ocean University of China, 2015: 18-23.
[7] 王晓琳, 马甡, 单洪伟. 两株潜在益生菌安全性评价及其对凡纳滨对虾免疫力和抗WSSV能力影响 [J]. 中国海洋大学学报(自然科学版), 2016, 46(10): 39-47. Wang X L, Ma S, Shan H W. Safety evaluation of two probiotics strains and their effects on the immunity and the ability of anti-WSSV of Litopenaeus vannamei [J]. Periodical of Ocean University of China, 2016, 46(10): 39-47.
[8] Chythanya R, Karunasagar I, Karunasagar I. Inhibition of shrimp pathogenic vibrios by a marine Pseudomonas I-2 strain [J]. Aquaculture, 2002, 208(1-2): 1-10. doi: 10.1016/S0044-8486(01)00714-1
[9] Vijayan K K, Bright Singh I S, Jayaprakash N S, et al. A brackishwater isolate of Pseudomonas PS-102, a potential antagonistic bacterium against pathogenic vibrios in penaeid and non-penaeid rearing systems [J]. Aquaculture, 2006, 251(2-4): 192-200. doi: 10.1016/j.aquaculture.2005.10.010
[10] Luis-Villaseñor I E, Macías-Rodríguez M E, Gómez-Gil B, et al. Beneficial effects of four Bacillus strains on the larval cultivation of Litopenaeus vannamei [J]. Aquaculture, 2011, 321(1-2): 136-144. doi: 10.1016/j.aquaculture.2011.08.036
[11] Lins Rodigues M, Damasceno D Z, Gomes R L M, et al. Probiotic effects (Bacillus cereus and Bacillus subtilis) on growth and physiological parameters of silver catfish (Rhamdia quelen) [J]. Aquaculture Nutrition, 2021, 27(2): 454-467. doi: 10.1111/anu.13198
[12] Cao H, Yu R, Zhang Y, et al. Effects of dietary supplementation with β-glucan and Bacillus subtilis on growth, fillet quality, immune capacity, and antioxidant status of Pengze crucian carp (Carassius auratus var. Pengze) [J]. Aquaculture, 2019, 508: 106-112. doi: 10.1016/j.aquaculture.2019.04.064
[13] Xia Y, Wang M, Gao F, et al. Effects of dietary probiotic supplementation on the growth, gut health and disease resistance of juvenile Nile tilapia (Oreochromis niloticus) [J]. Animal Nutrition, 2020, 6(1): 69-79. doi: 10.1016/j.aninu.2019.07.002
[14] Kewcharoen W, Srisapoome P. Probiotic effects of Bacillus spp. From Pacific white shrimp (Litopenaeus vannamei) on water quality and shrimp growth, immune responses, and resistance to Vibrio parahaemolyticus (AHPND strains) [J]. Fish & Shellfish Immunology, 2019(94): 175-189.
[15] Nimrat S, Suksawat S, Boonthai T, et al. Potential Bacillus probiotics enhance bacterial numbers, water quality and growth during early development of white shrimp (Litopenaeus vannamei) [J]. Veterinary Microbiology, 2012, 159(3-4): 443-450. doi: 10.1016/j.vetmic.2012.04.029
[16] 张棋, 吴志新, 李景, 等. 中华鳖肠道益生菌的筛选、鉴定与生长特性研究 [J]. 水生生物学报, 2015, 39(2): 294-300. Zhang Q, Wu Z X, Li J, et al. The selection identification and characterization of the growth of probiotics from intestinal tract of Chinese softshell turtle (Trionyx sinensis) [J]. Acta Hydrobiologica Sinica, 2015, 39(2): 294-300.
[17] Garriques D, Arevalo G. An evaluation of the production and use of a live bacterial isolate to manipulate the microbial flora in commercial production of Penaeus vannamei postlarvae in Ecuador [J]. Aquaculture, 1995: 53-59.
[18] Austin B, Stuckey L F, Robertson P A W, et al. A probiotic strain of Vibrio alginolyticus effective in reducing diseases caused by Aeromonas salmonicida, Vibrio anguillarum and Vibrio ordalii [J]. Journal of Fish Diseases, 1995, 18(1): 93-96. doi: 10.1111/j.1365-2761.1995.tb01271.x
[19] 解维俊, 姜海滨. 微生态制剂在水产养殖中的应用研究进展 [J]. 安徽农学通报, 2021, 27(22): 103-108. doi: 10.3969/j.issn.1007-7731.2021.22.037 Xie W J, Jiang H B. Application and research progress of microecological preparations in aquaculture [J]. Anhui Agricultural Science Bulletin, 2021, 27(22): 103-108. doi: 10.3969/j.issn.1007-7731.2021.22.037
[20] 陈琼, 杨汝德. 饲用微生物制剂的研究进展 [J]. 广州食品工业科技, 2003, 19(S1): 98-100. doi: 10.3969/j.issn.1673-9078.2003.z1.030 Chen Q, Yang R D. Progress and application of direct-fed microbials [J]. Modern Food Science and Technology, 2003, 19(S1): 98-100. doi: 10.3969/j.issn.1673-9078.2003.z1.030
[21] 刘梅, 王宝杰, 蒋克勇, 等. 对虾病害防控的理论与实践 [J]. 海洋科学, 2020, 44(7): 16-25. Liu M, Wang B J, Jiang K Y, et al. Disease control in shrimps: theory and practice [J]. Marine Sciences, 2020, 44(7): 16-25.
[22] Yang Y, Xia J, Liu Y, et al. Safety evaluation for the use of Bacillus amyloliquefaciens in freshwater fish cultures [J]. Aquaculture Reports, 2021(21): 100822. doi: 10.1016/j.aqrep.2021.100822
[23] Sam-On M F S, Mustafa S, Yusof M T, et al. Evaluation of three Bacillus spp. isolated from the gut of giant freshwater prawn as potential probiotics against pathogens causing Vibriosis and Aeromonosis [J]. Microbial Pathogenesis, 2022(164): 105417. doi: 10.1016/j.micpath.2022.105417
[24] Kim Y S, Lee J, Heo S, et al. Technology and safety evaluation of Bacillus coagulans exhibiting antimicrobial activity for starter development [J]. LWT, 2021(137): 110464. doi: 10.1016/j.lwt.2020.110464
[25] 谷舞. 凡纳滨对虾肠道益生芽孢杆菌的筛选及抗病机理研究 [D]. 沈阳: 沈阳农业大学, 2020: 11-24. Gu W. Probiotics Bacillus screening from the intestine of Litopenaeus vannamei and its disease resistance mechanism [D]. Shenyang: Shenyang Agricultural University, 2020: 11-24.
[26] 王佰涛, 权淑静, 杨文玲, 等. 1株蜡样芽孢杆菌的分离鉴定及其生物学功能研究 [J]. 饲料研究, 2021, 44(14): 88-92. Wang B T, Quan S J, Yang W L, et al. Isolation and identification of a strain of Bacillus cereus and study on its biological function [J]. Feed Research, 2021, 44(14): 88-92.
[27] 朱永明, 王倩, 郗艳菊, 等. 动物源功能性芽孢杆菌的筛选与鉴定 [J]. 今日畜牧兽医, 2021, 37(7): 16-18. doi: 10.3969/j.issn.1673-4092.2021.07.011 Zhu Y M, Wang Q, Xi Y J, et al. Screening and identification of functional Bacillus from animals [J]. Today Animal Husbandry and Veterinary Medicine, 2021, 37(7): 16-18. doi: 10.3969/j.issn.1673-4092.2021.07.011
[28] 产启霞, 王福强, 李坤, 等. 复合益生菌粉对大菱鲆幼鱼生长、消化和肠道益生菌数量的影响 [J]. 饲料工业, 2021, 42(16): 6-11. Chan Q X, Wang F Q, Li K, et al. Effects of compound probiotics on growth, digestion and number of intestinal probiotics of juvenile turbot Scophthalmus maximus [J]. Feed Industry, 2021, 42(16): 6-11.
[29] Nguyen N D, Pande G S J, Kashem M A, et al. Acute hepatopancreatic necrosis disease (AHPND) toxin degradation by Bacillus subtilis DSM33018 [J]. Aquaculture, 2021(540): 736634. doi: 10.1016/j.aquaculture.2021.736634
[30] Riet J, Costa-Filho J, Dall’Agno L, et al. Bacillus subtilis expressing double-strand RNAs (dsRNAs) induces RNA interference mechanism (RNAi) and increases survival of WSSV-challenged Litopenaeus vannamei [J]. Aquaculture, 2021(541): 736834. doi: 10.1016/j.aquaculture.2021.736834
[31] Chien C C, Lin T Y, Chi C C, et al. Probiotic, Bacillus subtilis E20 alters the immunity of white shrimp, Litopenaeus vannamei via glutamine metabolism and hexosamine biosynthetic pathway [J]. Fish & Shellfish Immunology, 2020(98): 176-185.
[32] Kim S Y, Kim J Y, Kim S H, et al. Surfactin from Bacillus subtilis displays anti-proliferative effect via apoptosis induction, cell cycle arrest and survival signaling suppression [J]. FEBS Letters, 2007, 581(5): 865-871. doi: 10.1016/j.febslet.2007.01.059
[33] Fujiya M, Musch M W, Nakagawa Y, et al. The Bacillus subtilis quorum-sensing molecule CSF contributes to intestinal homeostasis via OCTN2, a host cell membrane transporter [J]. Cell Host & Microbe, 2007, 1(4): 299-308.
[34] Kuang J H, Huang Y Y, Hu J S, et al. Exopolysaccharides from Bacillus amyloliquefaciens DMBA-K4 ameliorate dextran sodium sulfate-induced colitis via gut microbiota modulation [J]. Journal of Functional Foods, 2020(75): 104212. doi: 10.1016/j.jff.2020.104212
[35] Rahman M S, Choi Y H, Choi Y S, et al. A novel antioxidant peptide, purified from Bacillus amyloliquefaciens, showed strong antioxidant potential via Nrf-2 mediated heme oxygenase-1 expression [J]. Food Chemistry, 2018(239): 502-510. doi: 10.1016/j.foodchem.2017.06.106
[36] Wen J, Zhao X, Si F, et al. Surfactin, a quorum sensing signal molecule, globally affects the carbon metabolism in Bacillus amyloliquefaciens [J]. Metabolic Engineering Communications, 2021(12): 174.
[37] Zhao P, Xu X, Zhao X, et al. Capability of Bacillus subtilis to remove Pb2+ via producing lipopeptides [J]. Science of the Total Environment, 2020(730): 138941. doi: 10.1016/j.scitotenv.2020.138941
[38] Zhao X, Yan L, Xu X, et al. Synthesis of silver nanoparticles and its contribution to the capability of Bacillus subtilis to deal with polluted waters [J]. Applied Microbiology and Biotechnology, 2019, 103(15): 6319-6332. doi: 10.1007/s00253-019-09880-2
[39] 张峰峰, 谢凤行, 赵玉洁, 等. 枯草芽孢杆菌水质净化作用的研究 [J]. 华北农学报, 2009, 24(4): 218-221. doi: 10.7668/hbnxb.2009.04.044 Zhang F F, Xie F X, Zhao Y J, et al. Effect of Bacillus subtilis on purification of aquaculture wastewater [J]. Acta Agriculturae Boreali-Sinica, 2009, 24(4): 218-221. doi: 10.7668/hbnxb.2009.04.044
[40] 刘晓燕, 王玲玲, 栾会妮, 等. 一株枯草芽孢杆菌的分离鉴定、生物学特性及其对水质净化的作用 [J]. 微生物学通报, 2021, 48(2): 449-461. Liu X Y, Wang L L, Luan H N, et al. Isolation and identification of a Bacillus subtilis strain for water purification [J]. Microbiology China, 2021, 48(2): 449-461.
-
期刊类型引用(2)
1. 于鹏,马晶晶,成钰,张成硕,王凯,周正海. 异育银鲫'中科5号'产消化酶益生菌的筛选、鉴定及生物学特性研究. 农业生物技术学报. 2024(08): 1878-1889 .  百度学术
百度学术
2. 李梓路,刘畅,李腾,王俏俏,窦乐,潘鲁青. 对虾养殖环境脱氮脱硫复合菌的构建与效能分析. 渔业现代化. 2024(05): 18-27 .  百度学术
百度学术
其他类型引用(3)



 下载:
下载: