DIFFERENT WATER FLOW RATES ON THE GROWTH PERFORMANCE, ANTIOXIDANT CAPACITY, ENERGY METABOLISM AND TISSUE STRUCTURE OF MICROPTERUS SALMOIDES UNDER AN IN-POND RECIRCULATING AQUACULTURE SYSTEM
-
摘要: 研究旨在探明池塘内循环流水养殖(Inner-Pond Raceway Aquaculture, IPRA)系统中不同水流速度对大口黑鲈(Micropterus salmoides)生长性能、抗氧化能力、能量代谢及组织结构的影响。选取已驯食好、体质健康、大小均一的大口黑鲈[放养规格为(8.13±0.82) g]192尾, 随机分配到4个模拟水槽中, 每组3个重复, 每个重复16尾。养殖试验设置空白静水组和3个水流速度组, 分别为低流速0.2 m/s、中流速0.4 m/s和高流速0.6 m/s, 养殖周期为154d。结果显示: (1)中流速组大口黑鲈的增重率和特定生长率显著高于其他3个处理组(P<0.05); 中、高流速组肥满度显著低于静水组和低流速组(P>0.05); 大口黑鲈内脏脂肪指数随着流速的增加而显著降低(P<0.05); (2)中流速组肌肉粗蛋白显著高于其他3个处理组(P<0.05), 静水组和低流速组肌肉粗脂肪含量显著高于中、高流速组(P<0.05); 中、高流速组肝脏粗蛋白显著高于静水组和低流速组(P<0.05); (3)中、高流速组血清中甘油三酯和总胆固醇显著低于静水组和低流速组(P<0.05); 中流速组总蛋白和谷草转氨酶活性显著高于静水组和低流速组(P<0.05); (4)血清中SOD和CAT活性随着水流速度的增加而升高, 中流速肝脏组SOD活性最高, 高流速组血清中CAT显著高于其他3个处理组(P<0.05); 中流速组血清和肝脏组织MDA含量显著低于其他3个处理组(P<0.05); 中流速组血清和肝脏组织T-AOC显著高于其他3个处理组(P<0.05); (5)肠道脂肪酶活性随着流速增加而显著升高(P<0.05); 中流速组胃淀粉酶和蛋白酶活性则最高; 中流速组肝脏脂肪酶活性最高, 显著高于静水组和低流速组(P<0.05); 中、高流速组蛋白酶活性显著高于低流速组(P<0.05)。肌肉和肝脏中谷氨酸脱氢酶均随着流速的增加而显著升高(P<0.05), 激素敏感脂肪酶和丙酮酸激酶则是先升后降, 至中流速组最高; (6)肌肉和肝脏组织切片观察发现, 低流速组肌纤维直径显著高于其他3个处理组(P<0.05), 肌纤维密度随着水流速度增加而显著增加(P<0.05); 中流速组会改善肝细胞组织结构, 而高流速组会造成肝细胞损伤, 引起细胞核空泡化严重和细胞核偏移聚集等。综上, 试验中流速组即0.4 m/s能够促进大口黑鲈生长, 提高机体抗氧化能力, 改善机能代谢, 增加粗蛋白含量, 抑制脂肪沉积, 可以作为大口黑鲈IPRA养殖系统中最适养殖水流速度。Abstract: The aim of this study is to investigate the effects of different water velocities on the growth performance, antioxidant capacity, energy metabolism and tissue structure of Micropterus salmoides kept in an in-pond recirculation aquaculture (IPRA) system. 192 well-fed, healthy and uniformly sized largemouth bass [average weight: (8.13±0.82) g] were randomly assigned to 4 simulation tanks with 3 duplicates containing 16 fish each. The experiment was set up with a control group (a stagnant water group) and three water flow rate groups, namely, a low flow rate group (0.2 m/s), a medium flow rate group (0.4 m/s) and a high flow rate group (0.6 m/s), respectively, with a culture period of 154 days. The results were as follows: (1) WGR and SGR of largemouth bass in the medium flow rate group were significantly higher than those of the other three groups (P<0.05), while the SGR of the high flow rate group was significantly lower than that of the other three treatment groups. The CF was significantly lower in the medium and high flow rate groups than that in the stagnant water and low flow rate groups. The visceral adiposity index (VAI) of largemouth bass decreased significantly with the increasing of flow rate (P<0.05). (2) The crude protein levels of muscle were significantly higher in the medium flow rate group than that in the other three groups. The crude fat content of muscle was significantly higher in the stagnant water and low flow rate groups than that in the medium and high low rate groups. The amount of crude fat in the specimens decreased significantly with an increased flow rate of water (P<0.05). (3) Serum triglycerides and the total amount of cholesterol in the specimens were significantly lower in the medium and high flow rate groups than that in the stagnant water and low flow rate groups (P<0.05). The concentration of free fatty acids and total amount of protein were significantly lower in the high flow rate group than that in the other three groups (P<0.05). (4) SOD and CAT increased with the increasing of the water flow rate, with the highest SOD level in the livers of the specimens in the medium flow rate group and there was a significantly higher concentration of serum CAT in the high flow rate group than the other three groups (P<0.05). Serum and liver tissue MDA levels were significantly lower in the medium flow rate group than that in the other three groups (P<0.05). The AOC of serum and liver tissues were significantly higher in the medium flow rate group than that in the other three groups (P<0.05). (5) LPS activity increased significantly in the specimens tested with an increased flow rate (P<0.05). AMS and PTS activities were the highest in the medium flow rate group. Hepatic LPS activity was the highest in the medium flow rate group, which was significantly higher than that in the stagnant water and low flow rate groups (P<0.05). PTS activity was significantly higher in the medium and high flow rate groups than that in the low flow rate groups. GDH increased significantly with the increased flow rate in both the muscles and liver (P<0.05). (6) The diameter of muscle fibres in the low flow rate group was significantly higher than that in the other three treatment groups (P<0.05). The density of muscle fibres increased significantly with an increase of water velocity. The medium flow group improved the tissue structure, while the high flow group caused some damage to their liver cells. In conclusion, the medium flow rate group with a flow rate of 0.4 m/s can promote the growth of largemouth bass, boost the immune systems, improve the functioning of their metabolisms, increase the crude protein content and inhibit fat deposition, and should be used as the optimal water flow rate for IPRA.
-
随着野生渔业资源的日益枯竭, 以及我国内陆淡水池塘养殖的快速发展, 高密度放养成为当前池塘主要养殖方式, 然而由于养殖鱼类活动空间拥挤、范围小, 游泳运动减少, 造成商品鱼质量严重下降, 例如土腥味严重、脂肪堆积、肌肉松弛、鱼体免疫力下降及经济效益低等问题[1]。同时消费者对鱼类品质的要求不断提高, 流水养鱼这种不仅能够提高渔业产量又能改善肌肉营养品质的生态养殖模式正越来越受到人们的关注[2]。池塘内循环流水养殖(Inner-Pond Raceway Aquaculture, IPRA), 简称“跑道养殖”, 于2015年引入我国, 是对传统常规池塘养殖模式进行工程化改造, 形成高密度养殖水槽和生态净水区相结合的养殖系统, 是一种新型的生态高效环保养殖模式[3]。IPRA作为一种有效收集养殖对象残饵粪便和以养殖用水净化后循环利用为主要特征的高效养殖模式, 具有节水、环保、高产、智能化的特点, 符合绿色渔业发展的要求。截至2021年仅浙江省已建成2000余条的IPRA养殖水槽, 推广面积近10 km2 [4]。目前, 草鱼(Ctenopharyngodon idella)、花鲈(Lateolabrax maculatus)、大口黑鲈(Micropterus salmoides)、黄颡鱼(Pelteobagrus fulvidraco)、罗非鱼(Oreochromis mossambicus)及鲫(Carassius auratus)等多个品种已在国内开展了IPRA养殖试验[4], 相关研究主要总结了水质改善[5]、设备改进[6]、营养成分[7]和市场效益[8]等, 而有关水流诱导鱼类运动引起鱼类生长代谢的基础理论研究相对较少。因此, 探索水流因子对养殖对象生长性能、抗氧化能力、生理生化、能量代谢和组织结构等指标的影响, 为IPRA甚至流水养鱼提供重要的技术理论支撑。
经笔者团队近几年的生产实践, 已证实大口黑鲈是适宜IPRA系统养殖的主要品种之一, IPRA的氮磷排放量及排污系数是传统池塘养殖(UPA)四倍以上, 且IPRA净利润率为(53.96±2.21)%, 显著高于UPA(48.04±2.05)%, 取得了较好的生态和经济效益[8]。目前该养殖模式仍处于探索起步阶段, 许多参数都还处于空白阶段, 而本研究前期养殖试验发现, IPRA养殖系统中当流速控制在(0.3±0.05) m/s时, 其养殖的大口黑鲈相对于UPA能增强能量代谢从而有效抑制大口黑鲈内脏脂肪的沉积。相关研究亦表明适当的游泳运动训练可以增强心血管功能, 促进鱼类生长, 改善其生理代谢机能, 提高鱼类生长率等[6], 但运动量过大又会导致代谢紊乱及免疫能力下降, 增加机体的易感性, 影响机体健康[9], 因此急需探索大口黑鲈最适水流速度。
本项目拟通过开展IPRA模拟系统中不同流速大口黑鲈养殖的试验研究, 探明水流因子对大口黑鲈生长指标、体营养成分、形体指标、抗氧化指标、代谢指标及组织形态的影响, 探讨IPRA大口黑鲈养殖最适流速, 为IPRA大口黑鲈健康养殖提供技术支撑。
1. 材料与方法
1.1 实验地点与设施
在浙江省湖州市南浔区勤劳村现代渔业园区内选择1个水域面积约2.2 ha的IPRA模式池塘, 池塘安装有4条流水养殖槽, 生态净水区投放鲢(Hypophthalmichthys molitrix)和鳙(Aristichthys nobilis)等滤食性鱼类, 水面利用生态浮床种植铜钱草(Hydrocotyle vulgaris)和狐尾藻(Myriophyllum verticillatum L.)等耐低温水生植物, 并配有4台水车式增氧机(2.0 kW·h/台), 岸边靠近水槽的一侧建有1个集污池。在IPRA水槽进水端一侧放置4套自主研制的模拟水槽装置, 如图 1所示, 该套装置主要包括3条水槽、变频水泵、整流栅、PVC漂浮管及盖网。前期生产中IPRA养殖调查分析结果显示, 前端流水槽中推水速度基本处于0.3—0.4 m/s, 在该流速下大口黑鲈具有较高的生长速度, 因此参照此流速, 本试验设置3个水流速度处理组, 分别为低流速0.2 m/s (L)、中流速0.4 m/s (M)和高流速0.6 m/s (H), 另外设置空白对照组, 即静水组(C)。其中每条养殖水槽的水深为0.5 m, 长1.2 m, 宽0.3 m, 养殖体积为0.18 m3。
1.2 养殖管理
模拟水槽投放鱼苗时间与IPRA系统中投放鱼苗保持一致, 即在12条模拟水槽内放养规格为(8.13±0.82) g的在IPRA系统中已驯食好的健康大口黑鲈苗种, 每条水槽初始投放苗种22尾, 未开启变频水泵, 以适应模拟水槽装置。另外可能由于本模拟装置为白色, 与IPRA系统养殖水槽为灰色有一定差异, 鱼类存在一定应激, 前2天不摄食, 第3天起开始摄食, 前4天内每条模拟水槽死亡3—5尾, 之后整个养殖实验周期无死亡现象。为了保持每条模拟水槽养殖密度同实际IPRA养殖密度(90尾/m3)保持一致, 在适应阶段的第7天每条水槽随机捞出1—3尾, 使得每条模拟水槽大口黑鲈养殖数量均为16尾/条, 养殖试验从7d适应阶段结束后即2020年5月30日开始, 10月30日结束, 养殖持续154d。每天投喂3次饲料(6:00、12:00和18:00), 达饱食水平, 并做好相关生产记录。
1.3 生长指标测定
在试验结束时, 4个水槽中各随机抽取10尾大口黑鲈, 现场测定其体重和体长, 并用消毒后的剪刀、镊子解剖取其内脏、肝脏和脂肪, 称量其重量, 计算大口黑鲈增重率(Weight Gain Rate, WGR, %)、特定生长率(Specific Growth Rate, SGR, %/d)、肝体指数(Hepatosomatic Index, HSI)、脏体指数(Viscerosomatic Index, VSI)和内脏脂肪指数(Visceral Adipose Index, VAI), 同时根据体长和体重计算肥满度(Condition Factor, CF, g/cm3), 并根据记录的饲料投喂量和每条水槽累计出鱼量, 计算饵料系数(Feed Coefficient, FC)和单位水体产鱼量(Fish Yield, FY, kg/m3)计算公式如下:
$ {\rm{WGR}} = \frac{({W}_{t} - {W}_{0})}{{W}_{0}} \times 100 \qquad\quad$
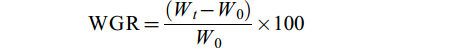
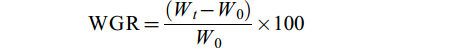
$ {\rm{SGR}} = \frac{\mathrm{L}\mathrm{n}\left({W}_{t}\right) - \mathrm{L}\mathrm{n}\left({W}_{0}\right)}{t} \times 100 $
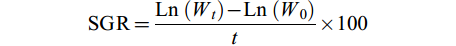
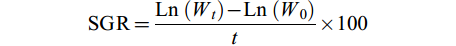
$ \text{}\text{HSI}=\frac{{W}_{\mathrm{肝}\mathrm{脏}}}{{W}_{t}}\times 100\qquad\qquad\;\;\; $
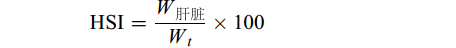
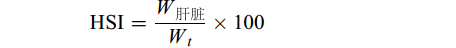
$ \text{}\text{VSI}=\frac{{W}_{\mathrm{内}\mathrm{脏}}}{{W}_{t}}\times 100\qquad\qquad\;\;\; $
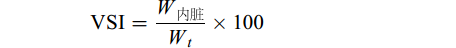
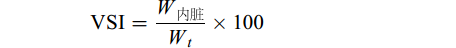
$ \text{}\text{VAI}=\frac{{W}_{\mathrm{脂}\mathrm{肪}}}{{W}_{t}}\times 100 \qquad\qquad\;\;\;$
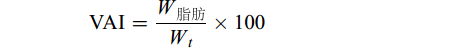
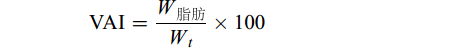
$ {\rm{CF}}=\frac{{W}_{\mathrm{脂}\mathrm{肪}}}{{W}_{t}}\times 100\qquad\qquad\;\;\; $
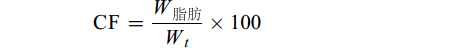
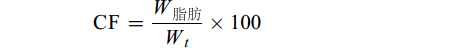
$ {\rm{FC}}=\frac{{W}_{\mathrm{饲}\mathrm{料}}}{{W}_{\mathrm{鱼}}} \qquad\qquad\qquad\;\;\;$
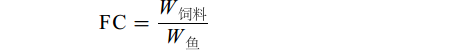
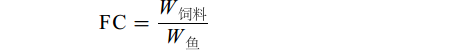
$ {\rm{FY}}=\frac{{W}_{\mathrm{水}\mathrm{体}}}{{V}_{\mathrm{水}\mathrm{体}}}\qquad\qquad\qquad\;\;\; $
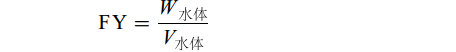
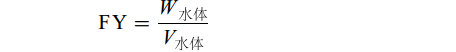
式中, Wt表示养殖t时间时的体重; W0表示试验开始时体重; L表示体长; W肝脏表示肝脏的重量; W内脏表示内脏组织的重量; W脂肪表示内脏脂肪组织重量; W饲料表示单位产鱼量投喂饲料量; W鱼表示单位产鱼量; W水体表示单位水体产鱼量; V水体表示单位水体。
1.4 血清生化指标测定
在测定生长指标之前, 随机采集各个水槽大口黑鲈各5尾, 尾柄抽血5 mL, 迅速注入10 mL的肝素钠抗凝管中, 于4℃保存, 12h内测定各血清指标, 然后每个水槽中的血清样品指标取平均值作为特定流速的1个重复。血清总蛋白(TP)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、总胆汁酸(TBA)、总胆固醇(TC)和血糖(GLU)采用AURORA/Veras 10自动化工作站和SMT 100V生化自动分析工作站检测。甘油三酯(TG)、游离脂肪酸(EFA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)和总抗氧化力(T-AOC)均采用南京建成生物工程研究所的试剂盒, 具体测定方法按照试剂盒的说明进行。
1.5 组织酶活指标测定
待抽完血后, 立即用75%酒精擦拭鱼体表后用蒸馏水漂洗, 消毒后的剪刀镊子解剖获取背部肌肉和肝脏, 置于冰面上的玻璃培养皿中, 迅速清除肝脏附着的脂肪, 并用PBS缓冲液反复冲洗肌肉和肝脏, 取约1 g肝脏和肌肉同一位置的组织分别放入2 mL的无菌离心管中, 立即放入液氮罐中速冻, 带回实验室后将肌肉和肝脏样品放入–80℃冰箱保存, 用于抗氧化酶、消化酶和脂肪代谢相关酶指标的测定。
需要检测的抗氧化指标包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)和总抗氧化力(T-AOC), 消化酶包括脂肪酶(LPS)、淀粉酶(AMS)和蛋白酶(PTS), 能量代谢相关酶包括谷氨酸脱氢酶(GDH)、激素敏感脂肪酶(HSL)和丙酮酸激酶(PK), 9种指标的测定均采用南京建成生物工程研究所的试剂盒, 具体测定方法按照试剂盒的说明进行。蛋白浓度用考马斯亮蓝染色法测定, 采用酶标仪测定吸光度值。每个水槽中的酶活指标取平均值作为特定流速的1个重复。
1.6 肌肉和肝脏营养成分分析
在测定生长指标之后, 各组随机取5尾大口黑鲈, 首先解剖获取肝脏, 再剖离背部肌肉, 剔除附着杂物后及时称重, 记录数据。暂存于–80℃冰箱中用于测定常规营养成分组成及含量。水分采用直接干燥法测定, 参考GB 5009.3-2010; 粗蛋白采用凯式定氮法测定, 参考GB 5009.5-2010; 粗脂肪采用索氏抽提法测定, 参考GB/T 5009.6-2003; 灰分采用马弗炉灼烧法测定, 参考GB 5009.4-2010。每个水槽中的营养成分取平均值作为特定流速的一个重复。
1.7 组织切片、扫描电镜和透射电镜制样
组织固定: 在测定生长指标时, 各组随机抽取3条大口黑鲈, 用75%酒精擦拭鱼体表后用蒸馏水漂洗, 消毒后的剪刀镊子获取背部统一位置直径0.5—0.8 cm的肌肉, 放入肌肉专用固定液中; 然后解剖获取肝脏, 取肝部同一位置直径0.5—0.8 cm的组织3份, 1份放入Bouin液中, 2份放入戊二醛电镜固定液中。
组织切片制样: 肌肉固定液和Bouin液中的肌肉和肝组织固定24h后, 用乙醇逐级脱水, 石蜡包埋后切片, 苏木素-伊红(HE, hematoxylin-eosin)染色, 用Motic BA210光学显微镜观察并拍照。
扫描电镜制样: 电镜固定液的肝脏经PBS缓冲液洗涤2次, 用4%(W/V)的蔗糖溶液洗涤1次, 用系列梯度酒精脱水, 加入100%酒精重悬后, 吸取少量悬液滴加在玻片上, 将玻片粘在导电胶上, 临界点干燥, 真空喷镀, 在SU8010(Hitachi公司)型扫描电镜下观察与摄片。
1.8 数据处理与统计分析
利用数据处理软件Excel 2010进行数据处理, 采用SPSS 20.0软件对文中所得数据进行单因素方差分析(One-way ANOVA), 显著性水平设为P<0.05; 实验结果以平均值±标准差表示。
2. 结果
2.1 不同流速下大口黑鲈生长性能和形体指标差异
由表 1可知, 中流速组大口黑鲈的增重率和特定生长率显著高于其他3个处理组(P<0.05), 高流速组的特定生长率显著低于其他3个处理组; 中、高流速肥满度显著低于静水组和低流速组(P<0.05); 肝体指数和脏体指数处理组之间无显著性差异(P>0.05); 大口黑鲈内脏脂肪指数高低顺依次为静水组>低流速组>中流速组>高流速组, 且之间存在显著性差异(P<0.05)。
表 1 不同处理组大口黑鲈生长性能和形体指标的差异Table 1. Difference of growth indices of M. salmoides (n=10)项目Item 静水组C 低流速组L 中流速组M 高流速组H 初重 Initial weight (g) 8.82±0.82 8.85±0.79 8.80±0.81 8.82±0.84 末重Final weight (g) 210.1±10.6 214.0±10.2 225.9±9.8 203.8±8.7 饵料系数FC 0.94±0.02 0.98±0.03 1.02±0.02 1.09±0.04 单位水体产鱼量FY (kg/m3) 18.67±1.22 19.02±1.31 20.08±1.32 18.04±1.25 增重率WGR (%) 2382.2±107.8a 2418.5±106.2a 2567.4±112.8b 2311.4±116.1a 特定生长率SGR (%) 1.89±0.035b 1.78±0.032b 2.14±0.035c 1.59±0.029a 肥满度CF (g/cm3) 2.12±0.02b 2.05±0.02b 1.89±0.02a 1.82±0.02a 肝体指数HSI 1.01±0.06 0.96±0.07 0.97±0.07 0.96±0.05 脏体指数VSI 6.89±0.57 6.79±0.56 6.95±0.65 6.84±0.63 内脏脂肪指数VAI 1.25±0.11a 0.89±0.08b 0.58±0.06c 0.33±0.05d 注: 同行数据肩标不同小写字母表示差异显著(P<0.05); 下同Note: In the same row, values with different small letter superscripts are significantly different (P<0.05). The same applies below 2.2 不同流速下大口黑鲈肌肉和肝脏常规营养成分指标差异
由表 2可知, 不同处理组肌肉和肝脏常规营养成分存在较大差异。对于肌肉而言, 中流速组粗蛋白显著高于其他3个处理组(P<0.05), 静水组和低流速组粗脂肪含量显著高于中、高流速组(P<0.05)。对于肝脏而言, 中、高流速组粗蛋白显著高于静水组和低流速组(P<0.05); 粗脂肪含量高低顺依次为静水组>低流速组>中流速组>高流速组, 且之间存在显著性差异(P<0.05); 高流速组粗灰分含量显著高于静水组。
表 2 不同处理组大口黑鲈肌肉和肝脏常规营养成分比较Table 2. Difference of routine nutritional components in muscle of M. salmoides (n=5; %)组织Tissue 项目Item 静水组C 低流速组L 中流速组M 高流速组H 肌肉 Muscle 粗蛋白 Crude protein 18.7±1.54a 18.5±1.35a 20.7±1.54b 18.5±1.58a 粗脂肪 Crude fat 6.72±0.61c 6.14±0.52c 4.58±0.44b 3.27±0.42a 粗灰分 Ash 1.39±0.08a 1.33±0.10a 1.35±0.11a 1.87±0.18b 水分 Moisture 77.6±5.5 76.5±5.9 73.5±4.9 74.2±4.1 肝脏 Liver 粗蛋白 Crude protein 23.24±1.84a 24.58±2.18a 26.14±2.71b 27.79±2.32b 粗脂肪 Crude fat 11.28±1.21d 9.54±1.05c 7.37±0.89b 5.19±0.47a 粗灰分 Ash 1.14±0.23a 1.29±0.15ab 1.25±0.16ab 1.45±0.14b 水分 Moisture 62.54±5.89 64.32±5.89 64.52±5.71 65.33±5.27 2.3 不同流速下大口黑鲈血清和肝脏生化指标的差异
运动对大口黑鲈血清生化和抗氧化指标产生较大影响(表 3), 血清中甘油三酯和总胆固醇变化趋势一致, 即中、高流速组显著低于静水组和低流速组(P<0.05); 高流速组游离脂肪酸显著低于其他3个处理组(P<0.05), 而总胆汁酸显著高于其他3个处理组(P<0.05); 高流速组总蛋白显著低于其他3个处理组(P<0.05), 而中流速组显著高于静水组和低流速组(P<0.05); 静水组血糖含量显著高于其他3个处理组(P<0.05)。中、高流速组谷草转氨酶显著高于静水组和低流速组(P<0.05), 且高流速组显著高于中流速组(P<0.05); 高流速组的碱性磷酸酶显著高于其他3组(P<0.05)。
表 3 不同处理组大口黑鲈血清和肝脏生化指标比较Table 3. Difference of biochemical and antioxidant indexes in serum of M. salmoides (n=5)项目
Item生化指标
Biochemical index静水组C 低流速组L 中流速组M 高流速组H 血清生化指标
Serum biochemical index甘油三酯TG (mg/mL) 2.35±0.18b 2.21±0.17b 2.05±0.15a 1.93±0.20a 游离脂肪酸EFA (μmol/L) 1.25±0.11b 1.12±0.10b 1.08±0.09b 0.87±0.08a 总胆固醇TC (mmol/L) 8.75±0.79b 8.19±0.76b 7.57±0.72a 7.18±0.75a 总胆汁酸TBA (μmol/L) 14.21±1.21a 14.82±1.32a 14.65±1.21a 17.84±1.41b 总蛋白TP (g/L) 35.6±2.41b 34.6±2.50b 38.7±2.50c 27.98±2.22a 血糖GLU (mmol/L) 6.28±0.54b 5.21±0.51a 5.44±0.48a 4.87±0.45a 谷草转氨酶AST (U/L) 192±11.9a 207±12.8a 218±11.80b 245.73±12.7c 碱性磷酸酶ALP (U/L) 62.21±3.31a 65.12±4.12a 65.01±3.80a 72.00±4.5.b 血清抗氧化指标
Serum antioxidant index超氧化物歧化酶SOD (U/mL) 52.32±4.12a 58.89±4.89b 69.87±6.02b 67.88±5.74b 过氧化氢酶CAT (U/mL) 4.21±0.52a 5.04±0.41b 5.15±0.48b 5.77±0.67c 丙二醛MDA (mmol/L) 18.87±1.51c 16.78±1.48b 13.25±1.12a 15.74±1.25b 总抗氧化力T-AOC (U/L) 178.21±12.91a 188.97±13.8a 223.14±18.40b 189.95±14.87a 肝脏抗氧化指标
Liver antioxidant index超氧化物歧化酶SOD (U/mg prot) 163.11±5.90 168.92±6.61 173.31±6.92 159.89±6.51 过氧化氢酶CAT (U/mg prot) 14.88±1.21a 15.81±1.44a 18.73±1.52b 17.65±1.51b 丙二醛MDA (U/mg prot) 1.72±0.33c 1.43±0.41bc 1.11±0.25a 1.53±0.31b 总抗氧化力T-AOC (U/mg prot) 1.64±0.27a 1.75±0.35ac 2.12±0.33b 1.89±0.32c 在血清抗氧化指标中, 静水组SOD和CAT显著低于其他3个处理组(P<0.05), 且随着水流速度的增加而升高; 静水组MDA含量显著高于其他3个处理组(P<0.05), 而中流速组最低, 显著低于其他3个处理组(P<0.05); 中流速组T-AOC最高, 显著高于其他3个处理组(P<0.05)。
在肝脏抗氧化指标中, 中、高流速组CAT活性显著高于静水组和低流速组(P>0.05); MDA含量顺序依次为中流速组<低流速组<高流速组<静水组, 且中流速组显著低于其他3个处理组(P<0.05); T-AOC顺序依次为中流速组>高流速组>低流速组>静水组, 且中流速组显著高于其他3个处理组(P<0.05)。
2.4 不同流速下大口黑鲈肠胃消化酶指标的差异
由表 4可知, 大口黑鲈不同组织消化酶活力变异较大, 肝脏和肠道是分泌脂肪酶的主要部位, 胃部是淀粉酶和蛋白酶的主要分泌部位, 其次是肠道, 最后是肝脏。不同处理组之间差异也较大, 肠道脂肪酶活性随着水流速度增强而增加, 中、高流速组显著高于静水组和低流速组(P<0.05); 流速组肠道蛋白酶显著高于对照组(P<0.05), 且中流速组显著高于低流速组和高流速组(P<0.05)。
表 4 不同处理组下大口黑鲈消化酶活力比较Table 4. Difference of digestive enzyme of M. salmoides (n=5; U/mg prot)组织Tissue 项目Item 静水组C 低流速组L 中流速组M 高流速组H 肠Intestine 脂肪酶 LPS 79.82±6.75a 86.82±9.10a 95.26±8.79b 105.61±9.78c 淀粉酶 AMS 93.53±8.81 96.81±8.25 99.54±9.54 97.26±8.91 蛋白酶 PTS 83.62±7.63a 96.56±8.72b 114.63±9.78c 101.22±9.24b 胃Stomach 脂肪酶LPS 31.25±3.45a 35.57±3.97a 42.61±4.15b 67.87±6.24c 淀粉酶AMS 152.82±14.21a 157.4±15.67a 181.82±18.98c 168.91±15.42b 蛋白酶PTS 112.35±11.24a 116.23±10.14a 128.47±11.44b 118.60±10.81a 肝Liver 脂肪酶LPS 90.61±8.47a 92.34±8.89a 99.89±8.98b 96.83±8.97ab 淀粉酶AMS 68.74±6.21a 85.15±8.12b 96.52±9.12c 108.79±9.59d 蛋白酶PTS 48.85±5.14a 52.61±5.60ab 58.74±5.47b 56.25±6.57b 胃组织中、高流速组脂肪酶和淀粉酶活性显著高于静水组和低流速组(P<0.05), 且高流速脂肪酶活性显著高于中流速组(P<0.05), 而中流速组淀粉酶活性显著高于高流速组(P<0.05); 中流速组蛋白酶活性最高, 显著高于其他3个处理组(P<0.05)。
对于肝脏组织而言, 中流速组脂肪酶活性最高, 显著高于静水组和低流速组(P<0.05); 淀粉活性顺序依次为高流速组>中流速组>低流速组>静水组, 处理组之间存在显著性差异(P<0.05); 中、高流速组蛋白酶活性显著高于静水组(P<0.05)。
如表 5所示, 肌肉和肝脏中谷氨酸脱氢酶均是随着流速的增加而显著升高(P<0.05); 中流速组肌肉和肝脏中激素敏感脂肪酶最高, 且肌肉激素敏感脂肪酶显著高于其他3个处理组(P<0.05); 中流速组肌肉和肝脏中丙酮酸激酶均显著高于其他3个处理组(P<0.05)。
表 5 不同处理组下大口黑鲈能量代谢酶活性比较Table 5. Difference of energy metabolizing enzyme of M. salmoides (n=5; U/mg prot)组织Tissue 项目Item 静水组C 低流速组L 中流速组M 高流速组H 肌肉 Muscle 谷氨酸脱氢酶GDH 1.32±0.22a 1.79±0.28b 2.17±0.18c 2.52±0.23d 激素敏感脂肪酶HSL 0.45±0.03a 0.62±0.05b 0.75±0.06c 0.65±0.05b 丙酮酸激酶PK 26.54±1.21a 35.87±2.32b 54.21±3.87c 43.5±3.21d 肝Liver 谷氨酸脱氢酶GDH 2.25±0.31a 2.99±0.33b 3.22±0.42c 3.45±0.31d 激素敏感脂肪酶HSL 1.25±0.21a 1.41±0.19ab 1.58±0.25bc 1.49±0.26b 丙酮酸激酶PK 11.25±1.21a 15.26±1.58b 23.58±1.87c 18.21±2.19b 2.5 不同流速下大口黑鲈组织结构形态差异
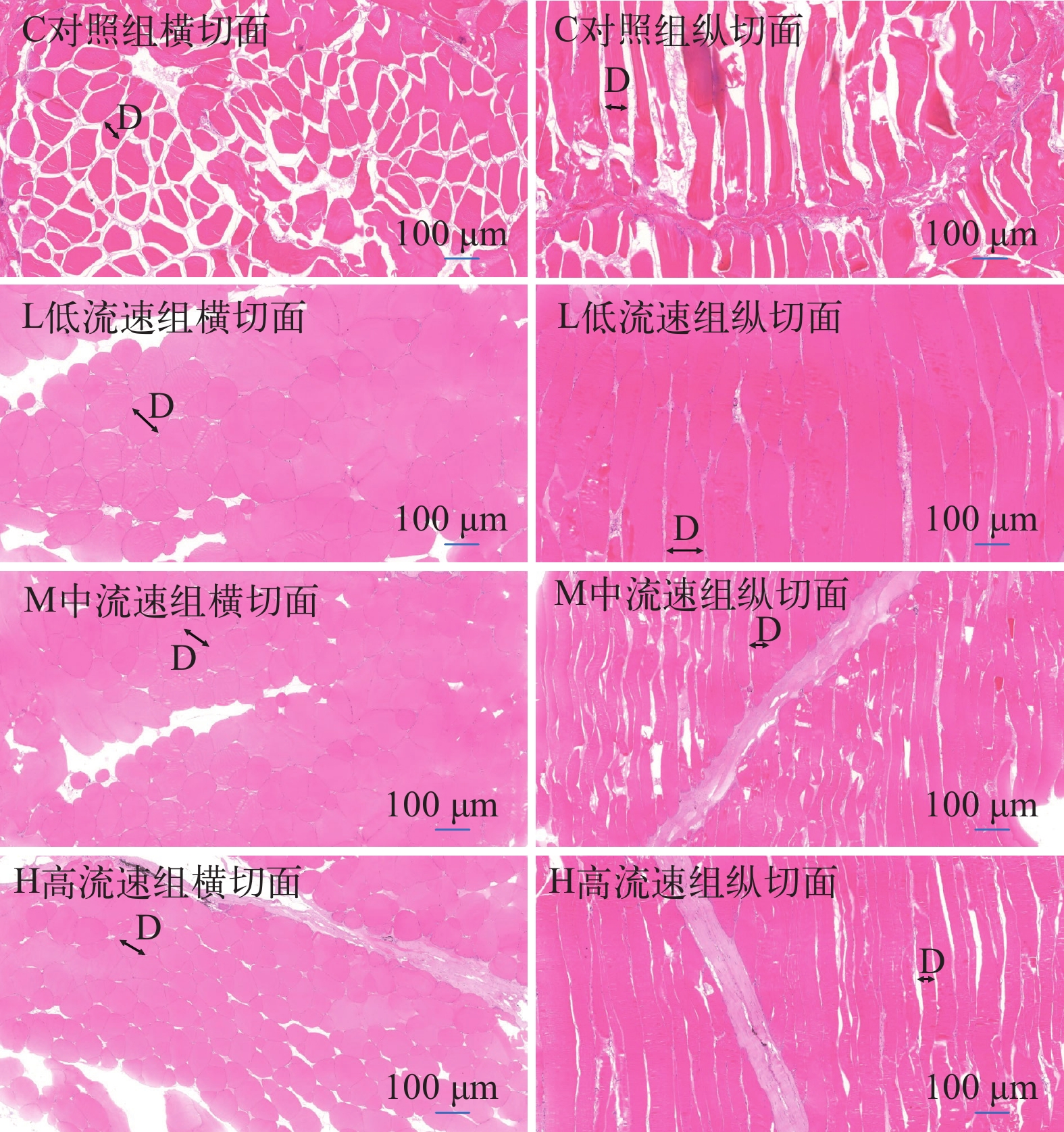
如图 2所示, 肌纤维直径顺序依次为低流速组>中流速组>静水组>高流速组, 且低流速组显著高于其他3个处理组(P<0.05), 静水组和中流速组均显著高于高流速组(P<0.05)。肌纤维密度随着水流速度增加而显著增加(P<0.05; 表 6)。
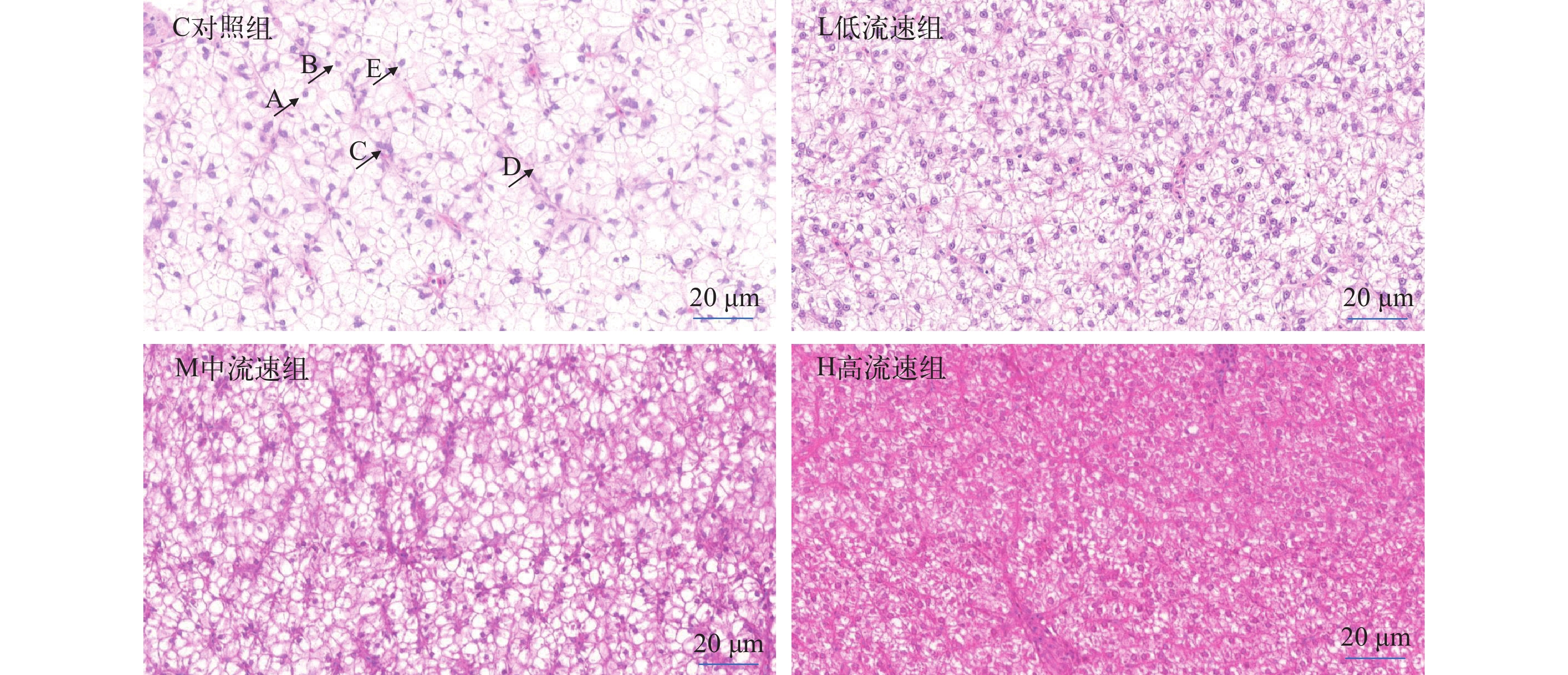
表 6 不同水流速度对大口黑鲈肌纤维直径和密度的影响Table 6. The effect of different water velocity on the diameter and density of muscle fiber from M. salmoides (n=5)指标Index 静水组C 低流速组L 中流速组M 高流速组H 肌纤维直径Fiber diameter (μm) 112.36±16.54b 132.14±14.56c 113.58±12.39b 98.84±8.75a 肌纤维密度Fiber density (根/单位面积) 34.61±2.63a 49.51±4.22b 66.89±5.98c 75.98±6.47d 如图 3所示, 不同水流速度均明显影响大口黑鲈肝组织结构。对照组细胞空泡化程度明显高于处理组。随着水流速度增加, 空泡化现象越来越低, 至高流速组出现了部分肝细胞边缘模糊, 细胞排列不整齐、细胞核偏移现象, 甚至组织结构的网状支架被破坏, 一些细胞核聚集在一起。与静水组和高流速组相比, 低、中流速组具有细胞形态正常, 肝血窦、细胞核等结构清晰, 无细胞核空泡化和细胞核偏移聚集等现象。
3. 讨论
3.1 流速对大口黑鲈生长性能和形体指标的影响
水流, 是鱼类生活环境中的重要生态因子, 一定的水流条件会促进鱼类游泳运动, 增强活动代谢, 改善其生理功能, 影响鱼类的摄食、生长和鱼体营养组成[9]。Young等[10]研究发现与没有运动训练的相比, 条纹鲈(Morone saxatilis)在经过1.2—2.4 bl/s流速的逆流运动训练后, 其增重率和特定生长率都有所增加, 而超过2.4 bl/s, 则增重率和特定生长率会降低; 斜带石斑鱼(Epinephelus coioides)在1.0 bl/s流速下运动训练8周后, 增重率显著提高, 而在2.0 bl/s流速下增重率则显著下降[11]。这与本研究结果一致, 即中流速组大口黑鲈的增重率和特定生长率显著高于其他3个处理组, 说明在适宜的流速下鱼类的生长率达到最高, 低流速时鱼类的自发活动就会增多, 高流速时鱼类的游泳状态会不稳定, 导致鱼体疲劳而影响生长, 而持续性的适宜流水刺激一定程度上能够削弱鱼类种群中的攻击行为, 减少自主运动而产生的能量消耗, 有利于鱼体生长[12]。
相关研究表明运动对鱼体形态的影响主要与脂肪沉积有关, 适宜范围内的水流速度可以促进脂肪沉积, 导致肥满度、内脏脂肪指数上升[9], 但超过一定范围的运动, 鱼体会因脂肪分解供能而造成肥满度等指标出现下降[13, 14]。宋波澜等[15]在对多鳞四须鲃(Barbodes schwanenfeldi)的实验中发现, 设置3种流速(0、0.7和2.0 bl/s)条件下, 随流速增大, 鱼体粗脂肪含量显著下降; 而Li等[16]研究发现, 两种流速(1.0和1.5 bl/s)的运动锻炼有利于鱼体内脂肪的沉积, 其肥满度、脏体指数和肝体指数出现一定程度的上升。本研究中大口黑鲈内脏脂肪指数随着流速的增加而显著下降, 中、高流速组肥满度显著低于静水组和低流速组, 与上述研究存在一定差异。这可能是因为养殖品种与养殖环境之间的差异引起, 同时也说明在持续的游泳运动状态下, 大口黑鲈通过分解脂肪供能, 从而有效抑制内脏脂肪的沉积, 这一现象也与Yuan等[6]报道的IPRA养殖系统中大口黑鲈肥满度显著低于传统池塘养殖组的结果较一致。因此, 通过适宜水流刺激来促进鱼体运动, 可以提高鱼体代谢速率, 从而减少脂肪在鱼体内的过量累积, 提高对营养物质的吸收利用效率, 进一步提升商品鱼品质。
3.2 流速对大口黑鲈肌肉和肝脏常规营养成分的影响
水流运动会导致鱼体能量和物质代谢发生变化, 从而导致脂肪含量、营养成分发生变化, 同时对蛋白质、糖分等也产生影响[17]。目前, 国内外已有较多关于水流运动对鱼类营养成分的影响研究, 但结论不一。Yogata等[14]和Shin等[18]在研究流速对牙鲆(Paralichthysolivaceus)和虹鳟(Oncorhynchus mykiss)影响时发现水流运动未对两种鱼类的常规营养成分产生显著性差异; 而宋波澜等[15]和朱志明[17]发现适宜运动能促进多鳞四须鲃肌肉和肝脏蛋白质沉积但抑制了脂肪沉积。本研究结果表明中流速组肌肉粗蛋白显著高于其他处理组, 静水组和低流速组粗脂肪含量显著高于中、高流速组, 而高流速组肝脏粗蛋白显著高于静水组和低流速组, 粗脂肪含量随着流速的增加而显著降低, 说明不同流速对肌肉和肝脏产生了不同的影响, 中流速的大口黑鲈具有高蛋白低脂肪的特点, 较其他3个处理组肌肉品质有所改善。这主要是由于大口黑鲈随着运动量增加, 其代谢速率提高, 能量消耗加大, 首先大量消耗肝脏中的脂肪, 再分解蓄存在肌肉中的脂肪以供能, 因而造成肌肉和肝脏中脂肪随着运动量增加而降低; 同时肌肉蛋白质含量增加主要可能是由于持续性的运动锻炼促进了蛋白质的合成和转化效率[6]。大量研究也已证实适当运动会提高鱼体对糖类和脂肪的利用率[19], 从而减少蛋白质消耗, 有利于肌肉蛋白质的积累, 如逆流运动能明显提高吉富罗非鱼的蛋白质含量[20], 运动同样可提高黄尾鰤(Seriola lalandi)蛋白质含量[14], 但是当运动量过大时, 即当肌肉中的糖原和脂肪被消耗殆尽时, 则会进一步分解蛋白质以供能, 从而导致蛋白分解大于合成, 蛋白质含量有所降低[15]。
3.3 流速对大口黑鲈血清和肝脏生化指标的影响
鱼类在持续有氧运动时, 鱼类代谢和心率加快, 血液循环加速, 血清生化指标能比较直观反映鱼类运动时的生理状况[16]。在本试验中, 血清中甘油三酯、总胆固醇、游离脂肪酸、血糖和总蛋白随着流速的增加而下降, 说明在本试验条件下, 运动对蛋白质、脂肪和糖类三大营养物质代谢有着明显的影响, 尤其是在高流速高强度运动状态下, 这些指标显著性降低, 机体通过分解血脂和血糖甚至血蛋白进行供能。这一结果与Li等[21]研究结果不一致, 该研究发现运动训练(0.36 m/s, 4周)会导致鲤(Cyprinus carpio)血清中甘油三酯和总胆固醇显著上升, 这可能是由不同的鱼类品种、饲料营养差异、不同的运动强度及时间等因素造成, 具体作用机理有待进一步探索。本试验结果显示血清中总胆汁酸、谷草转氨酶和碱性磷酸酶则随着流速的增加而升高, 且至高流速组达到显著性水平, 综合肝体比、肝脏脂肪含量、血清甘油三酯、胆固醇、脂肪酸及肝脏组织结构等结果, 表明适当的运动强度会降低肝脏脂肪含量, 而高强度的运动则会引起肝脏组织细胞产生损伤, 从而造成血清相关指标发生显著性变化。这一结果与Azuma等[22]研究结果较一致。
运动调节免疫功能的主要是通过改变机体心血功能和代谢途径, 进而增加抵抗力, 因此运动训练也会对鱼类的免疫功能产生影响[18]。目前, 关于水流诱导的鱼类运动对鱼类免疫能力影响的研究还不多。Azuma等[22]发现大麻哈鱼(Oncorhynchus keta)在11周水流速度分别为2、13和22 cm/s运动训练后, 显著提高了血清SOD活性; 宋波澜[23]发现红鳍银鲫(Barbodes schwanenfeldi)在低流速(0.1 m/s)和高流速(0.3 m/s)的水流训练下其SOD、T-AOC随着水流速度的增加而升高; 而于丽娟[24]发现中华倒刺鲃(Spinibarbus sinensis)幼鱼免疫酶活性随着水流速度增加而升高, 当流速达到2 bl/s免疫酶活性达到最高, 其后随着流速的增加而又开始下降。本试验结果显示, 中流速组的血清和肝脏T-AOC均最高, 且肝脏中SOD、CAT活性最高, 而MDA含量最低, 说明适宜强度的水流运动可以增强抗应激能力, 改善鱼体机体状况, 提高抗氧化能力, 防止感染疾病, 而过量的运动会降低机体的抗氧化能力。
3.4 流速对大口黑鲈消化酶和代谢酶指标的影响
水流作为重要的影响因子可以刺激鱼类运动, 增强能量代谢, 从而使消化组织器官产生相应的反应机制[25]。目前对消化能力和生长的关系国内外已进行了大量深入的研究报道[26], 而关于水流对鱼类消化酶影响的研究仍较少。肝脏是消化酶合成的重要场所, 肠和胃是鱼类的主要消化场所, 分泌有大量消化酶, 消化酶活性的提高可以促进鱼类对各种营养物质的吸收利用。赵璐琪等[25]发现罗非鱼在水流运动训练7d和30d后的消化酶活性都显著高于对照组, 且随着流速的增加其消化酶活性也增大, 在2 bl/s组达到最大, 其后则开始降低; 许亚琴[27]发现4个水流速度(0、2、5和8 cm/s)显著影响拉氏鱥(Rhynchocypris lagowskii)幼鱼淀粉酶和脂肪酶活力, 呈现先升后降的趋势, 在5 cm/s流速组活力达到最高。本研究中肠胃脂肪酶活性随着流速增加而显著升高, 至高流速组达到最大, 中流速组胃的淀粉酶和蛋白酶活性则最高; 而对于肝脏, 则是中流速组脂肪酶和蛋白酶活性最高, 高流速组淀粉酶活性最高, 这与以往的报道存在一定差异, 这主要可能是因为不同品种的鱼类及训练环境等因素造成的[16]。
运动代谢是指鱼类自发的或因由水流因子及其他外界环境因子的刺激而产生主动或被动运动所表现出来的能量消耗[17], 而其代谢快慢受相关限速酶控制, 其中谷氨酸脱氢酶(GDH)、激素敏感脂肪酶(HSL)和丙酮酸激酶(PK)分别是蛋白质、脂肪和糖原供能分解的关键酶, 在一定程度上可以反映能量代谢强度[28]。目前, 对GDH的研究较多集中在植物及哺乳动物上, 而对水产动物的研究相关报道较少[29]。在本试验中, 随着流速增加肌肉和肝脏中GDH活性显著增加, 说明肝脏中不断合成GDH, 并运送到肌肉组织中, 推测随着流速增加, 肌肉组织不断增强分解蛋白质能力以供能, 同时也反映出肝脏组织可能存在一定损伤[29]。同样运动训练后虹鳟肌肉中PK活性会显著增加, 对葡萄糖利用率提高了28倍[30]; Anttila等[30]发现运动训练能有效提高褐鳟(Salmo trutta)肝脏的HSL活性, 增强脂肪代谢能力; 魏小岚等[11]试验表明在1.0和1.5 bl/s运动训练下GDH等蛋白代谢酶活性显著低于对照组, 而在高流速组2.0 bl/s则蛋白代谢酶活性则显著增强, 蛋白质分解供能进一步增强。可见, 运动对鱼类糖类、脂肪和蛋白质代谢整体上具有显著影响, 但研究结果也存在一些差异。本试验结果显示, 运动能显著增加能量代谢相关酶活, 且高流速组肌肉和肝脏中蛋白脂酶和HSL活性最高, 而PK则是中流速组最高, 其原因可能是大口黑鲈超过一定运动强度后, 肌肉和肝脏中储存的糖原被快速分解殆尽, 主要依靠脂肪和蛋白质供能。综上, 持续且适度的水流运动虽然能增强鱼体蛋白质消耗, 但是合成大于分解而使肌肉蛋白质累积, 同时适度消耗鱼体储存的脂肪和糖原, 改善机体生理代谢。
3.5 流速对大口黑鲈组织结构形态的影响
研究表明适宜的水流运动训练能有效改善肌肉的结构和形态, 增加鱼体肌纤维数目或直径[31], 促进其生长, 提高游泳能力[32]。如虹鳟在一定程度的游泳锻炼下肌纤维更加发达, 纤维数目和直径分别显著高于对照组[33], 欧鳟(Salvelinus confluentus)在3种水流速度(1.5、3.0和4.5 bl/s)运动训练4周后, 肌纤维直径比对照组分别提高40%、18%和20%, 数目分别提高14%、31%和15%[34], 这一现象也在溪红点鲑(Salvelinus fontinalus)的研究中发现[35]。而有报道显示金鱼在1.5 bl/s流速下, 肌纤维数目比对照组提高25%, 但在3.0和4.5 bl/s流速下则无显著性差异[36], 也有研究发现中华刺鲃经过1.0和2.0 bl/s的8周运动训练未对肌纤维直径和密度产生明显差异, 但在4.0 bl/s运动训练组显著降低了肌纤维直径, 显著增加了肌纤维密度[37]。综上可见有关运动对鱼肌纤维结构的影响并不一致, 主要受运动强度、运动时间及鱼类品种等因素的影响[35]。本试验结果显示低流速肌纤维直径最大, 其次为中流速、静水组和高流速组, 而纤维密度随着水流速度的升高而显著增加, 这与Harimana等[38]结果一致, 暗示适度的运动可以刺激肌纤维直径增大, 促进其增生, 提高生长率, 但是过高的水流刺激运动又会导致肌纤维直径缩小, 研究者认为由于这种较小的肌纤维更有利于游泳过程中氧气的扩散[36], 从而能够适应高强度运动下肌肉消耗氧气分解供能的需求。另外适度运动训练促进鱼类肌纤维直径和数目的增加是导致其生长率显著提高的主要原因[39, 40], 这与本试验中流速组最有最高的生长率结果一致。
肝脏是鱼类进行各种代谢途径的主要器官, 极易受到外界环境的影响, 对外部应激极其敏感[41]。当鱼类肝脏受到外界环境胁迫时, 其遭到损伤后的典型变化包括水肿变性、空泡化和肝细胞坏死等现象[42], 根据肝脏形态学的变化可以评估其所受的损伤程度。目前关于运动对鱼类肝脏组织形态的影响研究报道还不多。在本试验中, 与静水组和高流速组相比, 低、中流速具有细胞形态正常, 肝血窦和细胞核等结构清晰, 无细胞核空泡化和细胞核偏移聚集等现象, 说明静水组和高流速组均会导致肝脏组织受损, 而长期适度运动则有利于预防脂肪肝, 改善肝脏生理机能[43], 这与本试验中流速组具有最高的消化酶和免疫酶活性相一致。
4. 结论
本实验结果表明不同的运动强度会对大口黑鲈的生理生化状态产生不同的影响, 中流速组特定增重率和特定生长率最高, 而高流速组最慢; 中、高流速组具有条形好, 粗蛋白含量高的特点; 同静水组、低流速组相比, 中、高流速组可以增强机体消化能力和抗氧化能力, 且以中流速组改善效果最好; 同低、中流水组相比, 静水组和高流速组肝脏结构产生了轻微损伤。综上可知, 中流速组能够促进大口黑鲈生长, 提高机体抗氧化能力, 改善机体代谢, 增加粗蛋白含量, 抑制脂肪沉积, 有效改善肌肉营养品质。因此, 在本研究中, 从生理生化等指标及生产实际考虑, 0.4 m/s可以作为大口黑鲈IPRA养殖系统中最适养殖水流速度。
-
表 1 不同处理组大口黑鲈生长性能和形体指标的差异
Table 1 Difference of growth indices of M. salmoides (n=10)
项目Item 静水组C 低流速组L 中流速组M 高流速组H 初重 Initial weight (g) 8.82±0.82 8.85±0.79 8.80±0.81 8.82±0.84 末重Final weight (g) 210.1±10.6 214.0±10.2 225.9±9.8 203.8±8.7 饵料系数FC 0.94±0.02 0.98±0.03 1.02±0.02 1.09±0.04 单位水体产鱼量FY (kg/m3) 18.67±1.22 19.02±1.31 20.08±1.32 18.04±1.25 增重率WGR (%) 2382.2±107.8a 2418.5±106.2a 2567.4±112.8b 2311.4±116.1a 特定生长率SGR (%) 1.89±0.035b 1.78±0.032b 2.14±0.035c 1.59±0.029a 肥满度CF (g/cm3) 2.12±0.02b 2.05±0.02b 1.89±0.02a 1.82±0.02a 肝体指数HSI 1.01±0.06 0.96±0.07 0.97±0.07 0.96±0.05 脏体指数VSI 6.89±0.57 6.79±0.56 6.95±0.65 6.84±0.63 内脏脂肪指数VAI 1.25±0.11a 0.89±0.08b 0.58±0.06c 0.33±0.05d 注: 同行数据肩标不同小写字母表示差异显著(P<0.05); 下同Note: In the same row, values with different small letter superscripts are significantly different (P<0.05). The same applies below 表 2 不同处理组大口黑鲈肌肉和肝脏常规营养成分比较
Table 2 Difference of routine nutritional components in muscle of M. salmoides (n=5; %)
组织Tissue 项目Item 静水组C 低流速组L 中流速组M 高流速组H 肌肉 Muscle 粗蛋白 Crude protein 18.7±1.54a 18.5±1.35a 20.7±1.54b 18.5±1.58a 粗脂肪 Crude fat 6.72±0.61c 6.14±0.52c 4.58±0.44b 3.27±0.42a 粗灰分 Ash 1.39±0.08a 1.33±0.10a 1.35±0.11a 1.87±0.18b 水分 Moisture 77.6±5.5 76.5±5.9 73.5±4.9 74.2±4.1 肝脏 Liver 粗蛋白 Crude protein 23.24±1.84a 24.58±2.18a 26.14±2.71b 27.79±2.32b 粗脂肪 Crude fat 11.28±1.21d 9.54±1.05c 7.37±0.89b 5.19±0.47a 粗灰分 Ash 1.14±0.23a 1.29±0.15ab 1.25±0.16ab 1.45±0.14b 水分 Moisture 62.54±5.89 64.32±5.89 64.52±5.71 65.33±5.27 表 3 不同处理组大口黑鲈血清和肝脏生化指标比较
Table 3 Difference of biochemical and antioxidant indexes in serum of M. salmoides (n=5)
项目
Item生化指标
Biochemical index静水组C 低流速组L 中流速组M 高流速组H 血清生化指标
Serum biochemical index甘油三酯TG (mg/mL) 2.35±0.18b 2.21±0.17b 2.05±0.15a 1.93±0.20a 游离脂肪酸EFA (μmol/L) 1.25±0.11b 1.12±0.10b 1.08±0.09b 0.87±0.08a 总胆固醇TC (mmol/L) 8.75±0.79b 8.19±0.76b 7.57±0.72a 7.18±0.75a 总胆汁酸TBA (μmol/L) 14.21±1.21a 14.82±1.32a 14.65±1.21a 17.84±1.41b 总蛋白TP (g/L) 35.6±2.41b 34.6±2.50b 38.7±2.50c 27.98±2.22a 血糖GLU (mmol/L) 6.28±0.54b 5.21±0.51a 5.44±0.48a 4.87±0.45a 谷草转氨酶AST (U/L) 192±11.9a 207±12.8a 218±11.80b 245.73±12.7c 碱性磷酸酶ALP (U/L) 62.21±3.31a 65.12±4.12a 65.01±3.80a 72.00±4.5.b 血清抗氧化指标
Serum antioxidant index超氧化物歧化酶SOD (U/mL) 52.32±4.12a 58.89±4.89b 69.87±6.02b 67.88±5.74b 过氧化氢酶CAT (U/mL) 4.21±0.52a 5.04±0.41b 5.15±0.48b 5.77±0.67c 丙二醛MDA (mmol/L) 18.87±1.51c 16.78±1.48b 13.25±1.12a 15.74±1.25b 总抗氧化力T-AOC (U/L) 178.21±12.91a 188.97±13.8a 223.14±18.40b 189.95±14.87a 肝脏抗氧化指标
Liver antioxidant index超氧化物歧化酶SOD (U/mg prot) 163.11±5.90 168.92±6.61 173.31±6.92 159.89±6.51 过氧化氢酶CAT (U/mg prot) 14.88±1.21a 15.81±1.44a 18.73±1.52b 17.65±1.51b 丙二醛MDA (U/mg prot) 1.72±0.33c 1.43±0.41bc 1.11±0.25a 1.53±0.31b 总抗氧化力T-AOC (U/mg prot) 1.64±0.27a 1.75±0.35ac 2.12±0.33b 1.89±0.32c 表 4 不同处理组下大口黑鲈消化酶活力比较
Table 4 Difference of digestive enzyme of M. salmoides (n=5; U/mg prot)
组织Tissue 项目Item 静水组C 低流速组L 中流速组M 高流速组H 肠Intestine 脂肪酶 LPS 79.82±6.75a 86.82±9.10a 95.26±8.79b 105.61±9.78c 淀粉酶 AMS 93.53±8.81 96.81±8.25 99.54±9.54 97.26±8.91 蛋白酶 PTS 83.62±7.63a 96.56±8.72b 114.63±9.78c 101.22±9.24b 胃Stomach 脂肪酶LPS 31.25±3.45a 35.57±3.97a 42.61±4.15b 67.87±6.24c 淀粉酶AMS 152.82±14.21a 157.4±15.67a 181.82±18.98c 168.91±15.42b 蛋白酶PTS 112.35±11.24a 116.23±10.14a 128.47±11.44b 118.60±10.81a 肝Liver 脂肪酶LPS 90.61±8.47a 92.34±8.89a 99.89±8.98b 96.83±8.97ab 淀粉酶AMS 68.74±6.21a 85.15±8.12b 96.52±9.12c 108.79±9.59d 蛋白酶PTS 48.85±5.14a 52.61±5.60ab 58.74±5.47b 56.25±6.57b 表 5 不同处理组下大口黑鲈能量代谢酶活性比较
Table 5 Difference of energy metabolizing enzyme of M. salmoides (n=5; U/mg prot)
组织Tissue 项目Item 静水组C 低流速组L 中流速组M 高流速组H 肌肉 Muscle 谷氨酸脱氢酶GDH 1.32±0.22a 1.79±0.28b 2.17±0.18c 2.52±0.23d 激素敏感脂肪酶HSL 0.45±0.03a 0.62±0.05b 0.75±0.06c 0.65±0.05b 丙酮酸激酶PK 26.54±1.21a 35.87±2.32b 54.21±3.87c 43.5±3.21d 肝Liver 谷氨酸脱氢酶GDH 2.25±0.31a 2.99±0.33b 3.22±0.42c 3.45±0.31d 激素敏感脂肪酶HSL 1.25±0.21a 1.41±0.19ab 1.58±0.25bc 1.49±0.26b 丙酮酸激酶PK 11.25±1.21a 15.26±1.58b 23.58±1.87c 18.21±2.19b 表 6 不同水流速度对大口黑鲈肌纤维直径和密度的影响
Table 6 The effect of different water velocity on the diameter and density of muscle fiber from M. salmoides (n=5)
指标Index 静水组C 低流速组L 中流速组M 高流速组H 肌纤维直径Fiber diameter (μm) 112.36±16.54b 132.14±14.56c 113.58±12.39b 98.84±8.75a 肌纤维密度Fiber density (根/单位面积) 34.61±2.63a 49.51±4.22b 66.89±5.98c 75.98±6.47d -
[1] Li X, Li J, Wang Y, et al. Aquaculture industry in China: current state, challenges, and outlook [J]. Reviews in Fisheries Science, 2011, 19(3): 187-200. doi: 10.1080/10641262.2011.573597
[2] Brown T W, Chappell J A, Boyd C E. A commercial-scale, in-pond raceway system for Ictalurid catfish production [J]. Aquacultural Engineering, 2011, 44(3): 72-79. doi: 10.1016/j.aquaeng.2011.03.003
[3] Brown T W, Hanson T R, Chappell J A, et al. Economic feasibility of an in-pond raceway system for commercial catfish production in west Alabama [J]. North American Journal of Aquaculture, 2014, 76(1): 79-89. doi: 10.1080/15222055.2013.862195
[4] 马文君, 丁雪燕, 周凡, 等. 浙江省池塘内循环流水“跑道”养殖模式发展现状及建议 [J]. 中国渔业经济, 2019, 37(5): 76-81. doi: 10.3969/j.issn.1009-590X.2019.05.012 Ma W J, Ding X Y, Zhou F, et al. Development status and countermeasures of in-pond raceway aquaculture in Zhejiang Province [J]. Chinese Fisheries Economics, 2019, 37(5): 76-81. doi: 10.3969/j.issn.1009-590X.2019.05.012
[5] 王朋, 徐钢春, 徐跑. 大口黑鲈池塘工程化循环水养殖系统的溶解氧时空变化及菌群响应特征 [J]. 水生生物学报, 2019, 43(6): 1290-1299. doi: 10.7541/2019.153 Wang P, Xu G C, Xu P. Temporal and spatial variation of dissolved oxygen and reaction of bacterial community in in-pond raceway system (iprs) of largemouth bass (Micropterus salmoides) [J]. Acta Hydrobiologica Sinica, 2019, 43(6): 1290-1299. doi: 10.7541/2019.153
[6] 刘梅, 原居林, 练青平, 等. 池塘内循环流水养殖模式对养殖塘上覆水-沉积物-间隙水磷时空分布特征及释放通量的影响 [J]. 水生生物学报, 2021, 45(5): 1045-1056. doi: 10.7541/2021.2020.158 Liu M, Yuan J L, Lian Q P, et al. Effects of inner-circulation pond aquaculture on distribution and release flux of phosphorus in the overlaying-sediment-interstitial water [J]. Acta Hydrobiologica Sinica, 2021, 45(5): 1045-1056. doi: 10.7541/2021.2020.158
[7] Yuan J, Ni M, Liu M, et al. Analysis of the growth performances, muscle quality, blood biochemistry and antioxidant status of Micropterus salmoides farmed in in-pond raceway systems versus usual-pond systems [J]. Aquaculture, 2019(511): 734241. doi: 10.1016/j.aquaculture.2019.734241
[8] 刘梅, 原居林, 倪蒙, 等. 大口黑鲈(Micropterus salmoides)不同养殖模式氮磷收支及养殖效果研究 [J]. 海洋与湖沼, 2021, 52(3): 718-728. doi: 10.11693/hyhz20200900242 Liu M, Yuan J L, Ni M, et al. A comparative study on nitrogen and phosphorus budget and aquaculture effect of Micropterus salmoides in two modes [J]. Oceanologia et Limnologia Sinica, 2021, 52(3): 718-728. doi: 10.11693/hyhz20200900242
[9] Merino G E, Piedrahita R H, Conklin D E. Effect of water velocity on the growth of California halibut (Paralichthys californicus) juveniles [J]. Aquaculture, 2007, 271(1/2/3/4): 206-215.
[10] Young P S, Cech J J Jr. Optimum exercise conditioning velocity for growth, muscular development, and swimming performance in young-of-the-year striped bass (Morone saxatilis) [J]. Canadian Journal of Fisheries and Aquatic Sciences, 1994, 51(7): 1519-1527. doi: 10.1139/f94-151
[11] 魏小岚, 虞顺年, 阳艳, 等. 运动强度对斜带石斑鱼生长、非特异性免疫和肝脏抗氧化能力的影响 [J]. 中国水产科学, 2017, 24(5): 1055-1064. doi: 10.3724/SP.J.1118.2017.17036 Wei X L, Yu S N, Yang Y, et al. Effects of exercise intensity on growth, blood innate immunity, hepatic antioxidant capacity, and HSPs70 mRNA expression of Epinephelus coioides [J]. Journal of Fishery Sciences of China, 2017, 24(5): 1055-1064. doi: 10.3724/SP.J.1118.2017.17036
[12] Young P S, Cech J J Jr. Improved growth, swimming performance, and muscular development in exercise-conditioned young-of-the-year striped bass (Morone saxatilis) [J]. Canadian Journal of Fisheries and Aquatic Sciences, 1993, 50(4): 703-707. doi: 10.1139/f93-080
[13] Liu G, Wu Y, Qin X, et al. The effect of aerobic exercise training on growth performance, innate immune response and disease resistance in juvenile Schizothorax prenanti [J]. Aquaculture, 2018(486): 18-25. doi: 10.1016/j.aquaculture.2017.12.006
[14] Yogata H, Oku H. The effects of swimming exercise on growth and whole-body protein and fat contents of fed and unfed fingerling yellowtail [J]. Fisheries Science, 2000, 66(6): 1100-1105. doi: 10.1046/j.1444-2906.2000.00175.x
[15] 宋波澜, 林小涛, 许忠能. 逆流运动训练对多鳞四须鲃摄食、生长和体营养成分的影响 [J]. 水产学报, 2012, 36(1): 106-114. Song B L, Lin X T, Xu Z N. Effects of upstream exercise training on feeding efficiency, growth and nutritional components of juvenile tinfoil barbs (Barbodes schwanenfeldi) [J]. Journal of Fisheries of China, 2012, 36(1): 106-114.
[16] Li X M, Yu L J, Wang C, et al. The effect of aerobic exercise training on growth performance, digestive enzyme activities and postprandial metabolic response in juvenile qingbo (Spinibarbus sinensis) [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2013, 166(1): 8-16.
[17] 朱志明. 运动训练下多鳞四须鲃(Barbodes schwanenfeldi)肌肉和肝脏糖、脂代谢研究 [D]. 广州: 暨南大学, 2014: 28-55. Zhu Z M. Research of carbohydrate and lipid metabolism in muscles and liver in Barbodes schwanenfeld during exercise training [D]. Guangzhou: Jinan University, 2014: 28-55.
[18] Shin Y A, Lee J H, Song W, et al. Exercise training improves the antioxidant enzyme activity with no changes of telomere length [J]. Mechanisms of Ageing and Development, 2008, 129(5): 254-260. doi: 10.1016/j.mad.2008.01.001
[19] Anttila K, Jäntti M, Mänttäri S. Effects of training on lipid metabolism in swimming muscles of sea trout (Salmo trutta) [J]. Journal of Comparative Physiology B, 2010, 180(5): 707-714. doi: 10.1007/s00360-010-0446-1
[20] 穆小平, 林小涛, 朱志明, 等. 逆流运动及葵花籽油替代鱼油对吉富罗非鱼生长和体成分的影响 [J]. 南方水产科学, 2014, 10(2): 27-35. doi: 10.3969/j.issn.2095-0780.2014.02.004 Mu X P, Lin X T, Zhu Z M, et al. Effect of upstream exercise and replacement of dietary fish oil by sunflower seed oil on growth and body composition of GIFT Oreochromis niloticus [J]. South China Fisheries Science, 2014, 10(2): 27-35. doi: 10.3969/j.issn.2095-0780.2014.02.004
[21] Li D, Fu C, Wang Y, et al. The hematological response to exhaustive exercise in ‘all-fish’ growth hormone transgenic common carp (Cyprinus carpio L.) [J]. Aquaculture, 2011, 311(1/2/3/4): 263-268.
[22] Azuma T, Noda S, Yada T, et al. Profiles in growth, smoltification, immune function and swimming performance of 1-year-old Masu salmon Oncorhynchus masou Masou reared in water flow [J]. Fisheries Science, 2002, 68(6): 1282-1294. doi: 10.1046/j.1444-2906.2002.00566.x
[23] 宋波澜. 水流因子对红鳍银鲫(Barbodes schwanenfeldi)游泳行为、生长和生理生态影响的研究 [D]. 广州: 暨南大学, 2008: 88-101 Song B L. Effects of water current on swimming activity, growth and ecophysiological aspect of young Barbodes schwanenfeldi [D]. Guangzhou: Jinan University, 2008: 88-101.
[24] 于丽娟. 运动训练对中华倒刺鲃幼鱼生长、抗氧化及免疫机能的影响 [D]. 重庆: 西南大学, 2014: 25-32. Yu L J. The effects of exercise training on growth, antioxidative ability and immune function in juvenile Spinibarbus sinensis [D]. Chongqing: Southwest University, 2014: 25-32.
[25] 赵璐琪, 宋波澜. 流速对吉富罗非鱼幼鱼行为和消化酶的影响 [J]. 河北渔业, 2017(3): 21-23. doi: 10.3969/j.issn.1004-6755.2017.03.005 Zhao L Q, Song B L. Effects of flow rate on behavior and digestive enzymes of juvenile gifurophy [J]. Hebei Fisheries, 2017(3): 21-23. doi: 10.3969/j.issn.1004-6755.2017.03.005
[26] Bagatto B, Pelster B, Burggren W W. Growth and metabolism of larval zebrafish: effects of swim training [J]. The Journal of Experimental Biology, 2001, 204(Pt 24): 4335-4343.
[27] 许亚琴. 流速对拉氏鱥幼鱼生长、非特异性免疫能力及脂肪酸组成的影响 [D]. 大连: 大连海洋大学, 2020: 32-36. Xu Y Q. Effects of flow rate on growth, nonspecific immunity and fatty acid composition in juvenile Phoxinus lagowskii dybowskii [D]. Dalian: Dalian Ocean University, 2020: 32-36.
[28] West T G, Arthur P G, Suarez R K, et al. In vivo utilization of glucose by heart and locomotory muscles of exercising rainbow trout (Oncorhynchus mykiss) [J]. Journal of Experimental Biology, 1993, 177(1): 63-79. doi: 10.1242/jeb.177.1.63
[29] 朱站英, 华雪铭, 于宁, 等. 草鱼蛋白质和脂肪代谢对饥饿胁迫的响应 [J]. 水产学报, 2012, 36(5): 756-763. doi: 10.3724/SP.J.1231.2012.27785 Zhu Z Y, Hua X M, Yu N, et al. Response of lipid and protein metabolism of grass carp (Ctenopharyngodon idellus) to starvation [J]. Journal of Fisheries of China, 2012, 36(5): 756-763. doi: 10.3724/SP.J.1231.2012.27785
[30] Anttila K, Jokikokko E, Erkinaro J, et al. Effects of training on functional variables of muscles in reared Atlantic salmon Salmo salar smolts: connection to downstream migration pattern [J]. Journal of Fish Biology, 2011, 78(2): 552-566. doi: 10.1111/j.1095-8649.2010.02871.x
[31] Meyer-Rochow V B, Ingram J R. Red-white muscle distribution and fibre growth dynamics: a comparison between lacustrine and riverine populations of the southern smelt Retropinna retropinna Richardson [J]. Proceedings Biological Sciences, 1993, 252(1334): 85-92. doi: 10.1098/rspb.1993.0050
[32] Johnston I A. Muscle development and growth: potential implications for flesh quality in fish [J]. Aquaculture, 1999, 177(1/2/3/4): 99-115.
[33] Johnston I A, Moon T W. Endurance exercise training in the fast and slow muscles of a teleost fish (Pollachius virens) [J]. Journal of Comparative Physiology, 1980, 135(2): 147-156. doi: 10.1007/BF00691204
[34] Davison W, Goldspink G. The effect of prolonged exercise on the lateral musculature of the brown trout (Salmo trutta) [J]. Journal of Experimental Biology, 1977, 70(1): 1-12. doi: 10.1242/jeb.70.1.1
[35] Bjørnevik M, Karlsen Ø, Johnston I A, et al. Effect of sustained exercise on white muscle structure and flesh quality in farmed cod (Gadus morhua L.) [J]. Aquaculture Research, 2003, 34(1): 55-64. doi: 10.1046/j.1365-2109.2003.00794.x
[36] Davison W, Herbert N A. Swimming-enhanced growth [M]. Swimming Physiology of Fish. Berlin, Heidelberg: Springer Berlin Heidelberg, 2012: 177-202.
[37] 李秀明. 运动训练对中华倒刺鲃幼鱼生长的影响及其机理研究 [D]. 重庆: 西南大学, 2013: 112-118. Li X M. The effect and mechanism of exercise training on growth performance in juvenile Spinibarbus sinensis [D]. Chongqing: Southwest University, 2013: 112-118.
[38] Harimana Y, Tang X, Xu P, et al. Effect of long-term moderate exercise on muscle cellularity and texture, antioxidant activities, tissue composition, freshness indicators and flavor characteristics in largemouth bass (Micropterus salmoides) [J]. Aquaculture, 2019(510): 100-108. doi: 10.1016/j.aquaculture.2019.05.051
[39] Shrivastava J, Rašković B, Blust R, et al. Exercise improves growth, alters physiological performance and gene expression in common carp (Cyprinus carpio) [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2018(226): 38-48.
[40] Periago M J, Ayala M D, López-Albors O, et al. Muscle cellularity and flesh quality of wild and farmed sea bass, Dicentrarchus labrax L [J]. Aquaculture, 2005, 249(1/2/3/4): 175-188.
[41] 倪金金, 王裕玉, 徐钢春, 等. 养殖密度对池塘工程化循环水养殖大口黑鲈抗氧化力、组织结构及应激基因表达的影响 [J]. 中国水产科学, 2020, 27(6): 660-670. Ni J J, Wang Y Y, Xu G C, et al. Effects of stocking density on the antioxidant status, tissue structure, and HSP70 and Cu/Zn-SOD expression in largemouth bass (Micropterus salmoides) in an in-pond raceway culture system [J]. Journal of Fishery Sciences of China, 2020, 27(6): 660-670.
[42] Ei-Bakary N, Ei-Gammal H. Comparative histological, histochemical and ultrastructural studies on the liver of flathead grey mullet (Mugil cephalus) and sea bream (Sparus aurata) [J]. Global Veterinaria, 2010, 4(6): 548-553.
[43] Brown E J, Bruce M, Pether S, et al. Do swimming fish always grow fast? Investigating the magnitude and physiological basis of exercise-induced growth in juvenile New Zealand yellowtail kingfish, Seriola lalandi [J]. Fish Physiology and Biochemistry, 2011, 37(2): 327-336. doi: 10.1007/s10695-011-9500-5
-
期刊类型引用(7)
1. 张瑜,李辰钰,王涛,陈立婧,龚小玲. 上海市三大饮用水源地水库鳙肌肉特性比较. 上海海洋大学学报. 2024(03): 692-701 .  百度学术
百度学术
2. 丁兰,徐胜南,周聃,刘梅,李万祈,邹松保. 水产养殖固体废弃物有机肥对土壤肥效和蔬菜品质的影响. 中国农学通报. 2024(19): 102-108 .  百度学术
百度学术
3. 韩多彩,张静静,王亚冰,乔光德,王倩,彭士明. 大黄鱼不同抗流能力群体间能量代谢差异比较分析. 海洋渔业. 2024(05): 608-615 .  百度学术
百度学术
4. 张先炳,秦依雯,杨威,李耕,胡玉鹏,杨胜发,胡江,李文杰. 鱼类生物能量学模型研究及应用进展. 南方水产科学. 2024(06): 53-61 .  百度学术
百度学术
5. 顾玲玲,冯广朋,韩志强. 暗纹东方鲀运动训练后游泳能力和呼吸代谢的变化. 水生生物学报. 2023(12): 2011-2017 .  本站查看
本站查看
6. 汤保贵,陈秀灿,胡长圣,戴佳玥,王学锋,张静. 流速对黑鲷幼鱼游泳行为及运动生理的影响. 水生生物学报. 2023(12): 1993-2002 .  本站查看
本站查看
7. 蒲德成,郑吉澍,汪政希,翟旭亮,余米,李佩原,李脉,刘世仙. 不同地理大鲵子三代养殖群体肌肉营养成分比较. 饲料研究. 2023(23): 56-61 .  百度学术
百度学术
其他类型引用(6)




 下载:
下载: