THE ROLE OF ABSCISIC ACID AND COLD ADAPTATION IN IMPROVING THE CRYOPRESERVATION EFFICIENCY OF PYROPIA HAITANENSIS CONCHOCELIS
-
摘要: 为验证脱落酸(ABA)和冷适应能否提高紫菜丝状体种质的冷冻保存效率, 研究以坛紫菜(Pyropia haitanensis)自由丝状体为材料, 在20℃, 光强40 μmol·photons/(m2·s), 在光周期12L﹕12D条件下以ABA(100 μmol/L)处理48h或4℃暗培养6d, 随后进行–80℃冷冻保存实验。通过连续测定冻存复苏后藻体的存活率及最大光量子效率Fv/Fm, 并利用Realtime qPCR技术检测藻体与抗冷相关基因[P(H+)-ATPase、ald、Mn-sod A、Cu/Zn-sod 1、apx-2、hsp70-4、psy-2、gapdh、gpxha-1]等的表达情况来评估预处理及冻存效果。结果显示: (1)ABA和冷适应均可提高坛紫菜丝状体的冷冻存活率, ABA组存活率可达59%, 冷适应组存活率可达89%; (2)丝状体经冷适应后Fv/Fm恢复速率较其他组显著提高(P<0.05), 复苏35d即可恢复至最佳生长状态; (3)ABA和冷适应显著上调了藻体P(H+)-ATPase、ald、Mn-sod A、Cu/Zn-sod 1、gapdh(P<0.01)和psy-2(P<0.05)基因的表达, apx-2和hsp70-4只有在ABA刺激时才表现为上调(P<0.01)。综上, ABA处理和冷适应均可改善坛紫菜丝状体的抗冻能力, 提高超低温冷冻保存效率。4℃冷适应法操作简单, 效果显著, 具较大应用潜力。Abstract: To explore whether abscisic acid (ABA) and cold adaptation can improve the cryopreservation efficiency of Porphyra sensu lato, the free living conchocelis of Pyropia haitanensis were treated with ABA (100 μmol/L) for 48h at 20℃, light intensity of 40 μmol·photons/(m2·s) with photoperiod 12L﹕12D or cultured in dark at 4℃ for 6 days before cryopreservation at –80℃. The effects of cryopreservation were evaluated by continuous measurement of algal survival rate after frozen, the maximum light quantum efficiency (Fv/Fm) of PSⅡ and the expression of cold adaptative related genes, such as P(H+)-ATPase, ald, Mn-sod A, Cu/Zn-sod 1, apx-2, hsp70-4, psy-2, gapdh, and gpxha-1. The results showed that: (1) Both ABA treatment and cold adaptation at 4℃ increased the survival rate of P. haitanensis conchocelis after cryopreservation, 59% in the ABA groups and 89% in the cold adapt groups; (2) The Fv/Fm of the conchocelis after cold adaptation recovered significantly faster than those of the other groups (P<0.05), with the optimal level after 35 day culture; (3) ABA treatment and 4℃ cold adaptation significantly up-regulated genes like P(H+)-ATPase, ald, Mn-sod A, Cu/Zn-sod 1, gapdh (P<0.01) and psy-2 (P<0.05) in the algae, but only ABA induced apx-2 and hsp70-4 (P<0.01). In summary, ABA treatment and cold adaptation can improve the frost resistance of P. haitanensis and improve the efficiency of cryopreservation. The cold adaptation method at 4℃ is simple and effective, and has greater application potential.
-
Keywords:
- Pyropia haitanensis /
- Conchocelis /
- Cryopreservation /
- Cold adaptation /
- Abscisic acid
-
大型海藻是海洋中重要的初级生产者和生态工程师, 具有食品、药物、饲料和肥料等经济价值[1]。海洋环境恶化使得海藻种群的生存和多样性受到多种压力的威胁[2, 3]。收集并保存藻类种质资源成为保护生物多样性和藻类育种的重要工作。组织活体继代培养是海藻种质保存古老且常规的手段, 亦是多数藻类种质库的主要保种方式。于–196— –40℃进行冷冻保存则是藻类学家关注的另一种质保藏方法。其最大的优点在于:在冻存保护剂的作用下, 生物组织和细胞能够在低温导致代谢停滞的同时保持细胞结构和功能的完整性及遗传物质的稳定性[4];并且, 冻存期间可以避免产生新的微藻、细菌或真菌污染[5]。因此, 开发和优化低温冻存方法, 提高海藻种质的冷冻存活率一直受到藻类学家的关注。目前, 海带、紫菜、江蓠和萱藻等很多大型经济海藻都进行过孢子体或配子体的低温冻存尝试, 但大型海藻的冷冻保存普遍存在效率偏低且冻存后期恢复困难等问题[6-8]。
紫菜(Porphyra sensu lato)[9]是潮间带重要的底栖海藻, 亦是东亚广泛栽培的经济藻类。与其他大型栽培海藻的情况相似, 种质退化和良种使用率不高是紫菜栽培产业面临的主要问题[10]。保护紫菜种质资源, 扩大其收藏, 提高保种效率, 对紫菜多样性保护、遗传育种及产业发展至关重要。在生产中, 农户会收集当年的成熟紫菜叶状体作为种菜, 晾干脱水后于–20℃冷冻;次年取出, 常温复水后收集果孢子用于培育丝状体苗。这些自然生长的紫菜群体遗传混杂严重, 且冷冻大量种菜需要较多空间和能耗, 对紫菜种质的质量控制具有相当的局限性[11]。紫菜自由丝状体是由果孢子发育而来的二倍体微观世代, 体积小、耐受性强和遗传性质稳定, 且易于培养和诱导调控;因此, 自由丝状体是紫菜种质的最佳保存形式[12], 也是紫菜种质低温冻存的重点研究对象。
影响生物组织低温冻存的主要因素为细胞渗透压失衡、细胞溶质浓度过度增加[13]和胞内冰晶生成[14]。冻存方法、冻存保护剂的种类、浓度和处理时间[15, 16]、降温速率、解冻温度[12, 17]及不同物种的低温耐受能力都会影响冻存效率[18]。科学家通过冻存保护剂置换出细胞内水, 或者优化冻存程序, 其基本目的都是为了减少细胞内冰晶的形成, 促使细胞形成玻璃化状态, 以减缓冻存对细胞内膜系统的损伤[14, 19]。此外, 对植物组织进行冷驯化或在低浓度玻璃化培养液中预培养也可以加强生物本身的抗冷能力, 调节细胞渗透压、应对氧化胁迫, 进而提高冻存效率[20-23]。对藻类冻存方案中冻存保护剂和冻存程序的研究已有较多报道, 而利用冷适应提高大型海藻冻存效率方案的报道则较少。
脱落酸(Abscisic acid, ABA)是一种半倍萜羧酸类植物激素, 在植物中最典型的功能为:在干旱、寒冷、高温和失水等胁迫条件下可提高植物的抗逆能力[24]。在藻类中, ABA可以通过诱导抗氧化酶表达, 增加植物对氧化应激的耐受性以减缓失水、渗透及盐胁迫的伤害[25]。是否可以利用ABA处理及低温适应性培养来提高紫菜丝状体对冷冻的耐受性, 进而提高种质冷冻保存的效率?为验证这一假设, 本文以坛紫菜自由丝状体为实验材料, 拟采用ABA处理和4℃低温诱导紫菜丝状体自身的抗冷能力, 以期提高冷冻保存效率, 为改进紫菜种质冻存方案提供新思路和实验参数。
1. 材料与方法
1.1 实验材料及培养
坛紫菜(Pyropia haitanensis)浙东1号(ZD-1)自由丝状体, 由浙江省海洋生物工程重点实验室提供。挑选色泽红润, 健康松散的藻团备用。培养条件:温度20℃, 光照强度40 μmol·photons/(m2·s), 光周期12L﹕12D, 宁大Ⅲ号培养液培养[26]。宁大Ⅲ号母液:990 nmol/L KNO3、57 nmol/L K2HPO4、9 nmol/L FeSO4·7H2O、54 nmol/L Na2EDTA、1 nmol/L MnSO4·H2O、0.5 mg/L VB12和5 mg/L VB1。培养液由母液与灭菌海水按1﹕1000比例配置而成。
灭菌海水:盐度为25的天然海水由0.22 μm的水系滤膜过滤并高压蒸汽灭菌。
1.2 冻存方法
冻存保护剂由基础溶液(0.5 mol/L山梨醇和0.01 mol/L HEPES溶于稀释灭菌海水[12])和20%DMSO混合配置。
操作:将坛紫菜丝状体(约1 mg鲜重)悬浮在0.75 mL的0℃的基础溶液中。用等体积冰浴后的20%DMSO(w/v)于15min内缓慢加入悬浮液中, 使DMSO终浓度达到10%, 在4℃平衡4h。将装有丝状体悬液的冻存管置于程序降温盒(Biosharp, 美国)中, 以–1℃/min的速度冷却至–80℃, 保存24h。
解冻:在40℃水浴中迅速解冻, 管内还留有少量冰时将冻存管置于冰水浴中, 用0℃的海水在30min内逐渐稀释7倍, 然后用200目筛绢筛去冻存液, 将丝状体以80 mg/L的密度重悬于宁大Ⅲ号培养液中培养。解冻后1周内每天更换1次培养液。其后, 按检测周期(10d、20d和35d)更换培养液。检测并记录存活率。
以此程序冻存的样本, 作为实验对照。
1.3 ABA和4℃冷适应处理
ABA溶液配置及处理 先用无菌海水配置成1 mmol/LABA母液, 经0.22 μm滤膜过滤后稀释成0、25、50、100、200和400 μmol/LABA溶液。取(0.1±0.02) g坛紫菜丝状体在500 mL不同浓度的ABA溶液中恒温摇床培养3d, 培养条件同1.1。设置3个生物学平行。
冷适应 0.5 g/L坛紫菜丝状体在4℃冰箱内黑暗处理6d, 设置3个生物学平行。
预处理后冻存实验 通过2.2的结果最终确定以100 μmol/L的ABA处理48h和4℃暗培养6d预处理后的样本为材料, 根据1.2的冻存方法进行实验。冻存程序完成后, 按上文进行指标的测定。设置3个生物学平行。
1.4 生理生化及分子指标检测
藻体相对日生长率(RGR) 测量不同处理组坛紫菜丝状体初始和结束时的重量, 计算各样品的相对日生长速率RGR, 其计算公式为[27]:
$\begin{array}{l} RGR (\text{%})=100\times({\rm{Ln}}{{{S}}}_{T}-{\rm{Ln}}{{\rm{S}}}_{T{\text{-}}3} )/T \end{array}$
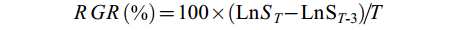
式中, ST为第T天藻体鲜重, ST-3为前一次称量时的藻体鲜重。
PSⅡ最大光量子效率(Fv/Fm) 用叶绿素荧光仪PAM(德国WAIZ公司)测定藻体的PSⅡ最大光量子效率Fv/Fm[28]。
存活率 以伊文思蓝染色法检测丝状体的存活率[29]。死细胞被染成蓝色, 活细胞保持红色。观察统计存活的细胞(红色)和死细胞(蓝色), 计算丝状体的存活率。
$\begin{array}\text{存\;活\;率}(\text{%}) = \frac{{丝\;状\;体\;活\;细\;胞\;数}}{{活\;细\;胞\;数}+{死\;细\;胞\;数}}\times 100 \end{array} $
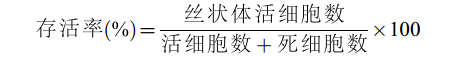
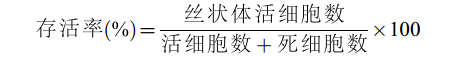
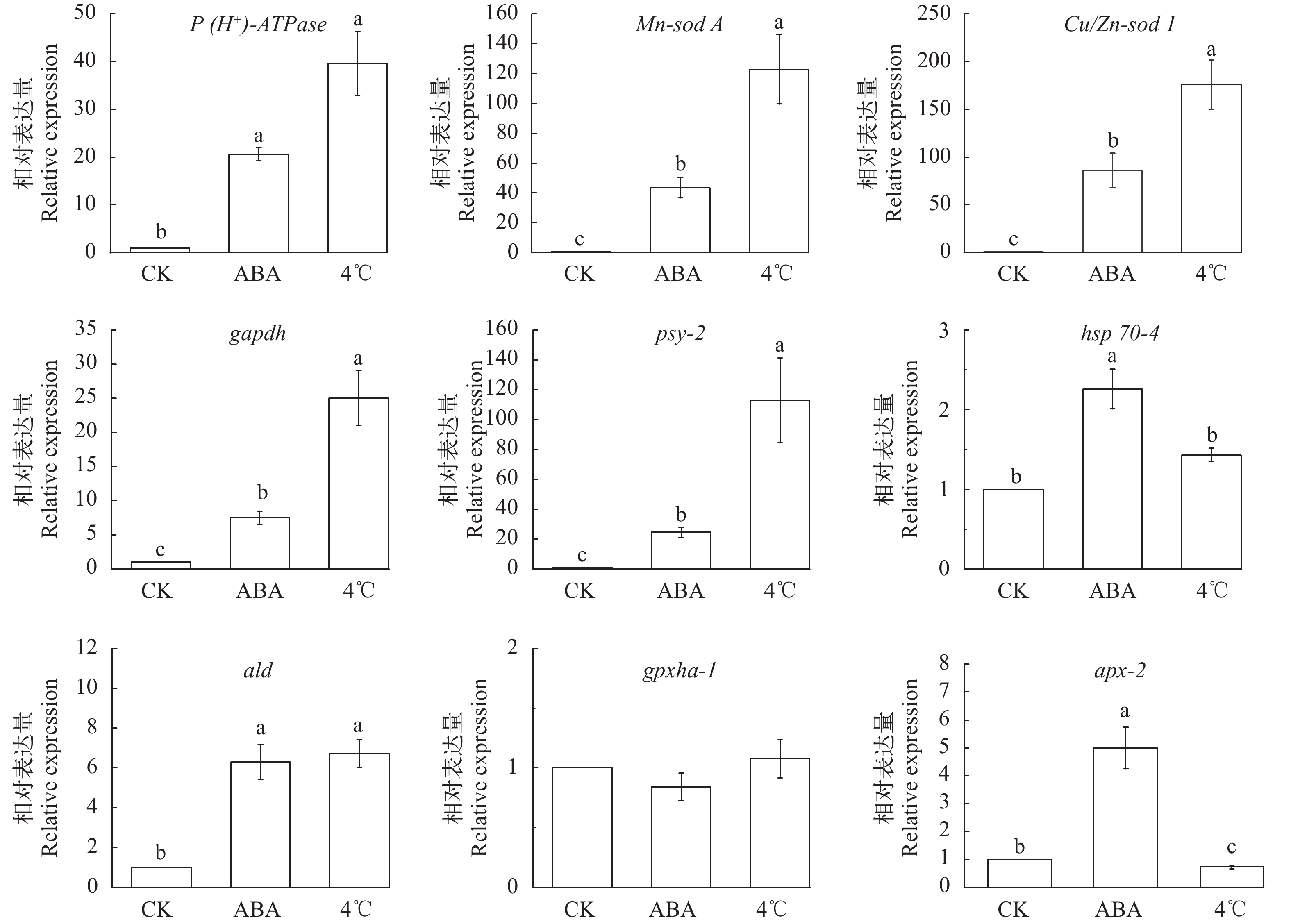
抗冷相关基因的Realtime qPCR分析 参照Plant RNA Kit (OMEGA)总RNA抽提试剂盒说明书提取每个样品的总RNA, 用TaKaRa PrieScript RT reagent Kit (TaKaRa, 中国)试剂盒反转成cDNA。以18S rRNA基因作为内参基因, 在Light Cyber 96 System (Roche, 瑞士)仪器中检测坛紫菜丝状体中质膜转运蛋白P(H+)-ATPase、酰基脂质去饱和酶(Acyl-lipid desaturase, ald)、锰超氧化物歧化酶(Mn-superoxide dismutase A, Mn-sod A)、铜/锌超氧化物歧化酶(Cu/Zn-superoxide dismutase 1, Cu/Zn-sod 1 )、抗坏血酸过氧化氢酶(Ascorbate peroxidase-2, apx-2)、热激蛋白70(Heat shock protein70-4, hsp70-4)、八氢番茄红素合成酶(Phytoene synthase-2, psy-2)、甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase, gapdh)、谷胱甘肽过氧化物酶(Glutathioneperoxidase-1, gpxha-1)等编码基因的相对表达量(表 1)。不同处理设置3个生物学平行, 每个平行做3次技术重复。反应体系20 μL, 扩增程序:95℃预变性3min;95℃变性5s, 60℃/55℃退火18s, 72℃延伸13s, 50个循环;在总延伸结束后, 加入溶解曲线的制备(60—95℃)步骤。用2–∆∆Ct法进行分析。
表 1 目标基因的RT-qPCR引物序列Table 1. RT-qPCR primer sequence of the target genes引物
Primer引物序列
Sequence (5′—3′)长度
Length (bp)psy-2-QF CCACTGATGGCGGGTGTTGT 109 psy-2-QR GGCGACTCGTAGGTACGCTTCT Mn-sod A-QF GGCGATCCGCAACAATG 159 Mn-sod A-QR CCACCCGCTCCCAAACA Cu/Zn-sod 1-QF GCACGGCTTCCACATCCA 132 Cu/Zn-sod 1-QR GTCGTCGCCCACCTCAAT apx-2-QF ATGGCATCATGGTGCGGGTAG 105 apx-2-QR CAATCGAGGCAAGCTGGTAGAGGT gpxha-1-QF CGGCACCAACGAGCAGA 149 gpxha-1-QR CAAAGTTCCACCCGCAGTC hsp70-4-QF TGGGCATCTGGCAGAATG 196 hsp70-4-QR CGACGGGTCCGAGAACTT ald-QF GTGCAGGATATTGTGGAGGT 212 ald-QR AGCCAGTAGCCAGTGGTAAA P(H+)-ATPase-QF CGTGTTTCCGCAGAGCA 225 P(H+)-ATPase-QR GCGTCCGTCGAGATGGT gapdh-QF TGGCGTTGAGGTTGTTGC 94 gapdh-QR CTTGTACGGGCCGTGGGT 18s-QF AGTTAGGGGATCGAAGACGA 150 18s-QR CAGCCTTGCGACCATACTC 1.5 数据统计
实验数据和统计作图采用Origin 2018软件, 利用SPSS 17.0进行单因素方差分析(One-way ANOVA)或双因素方差分析(Two-way ANOVA), 采用Tukey多重比较检验来确定各处理间的差异显著性。数据以平均值±标准差(Mean±SD)表示, P<0.05表示差异显著, P<0.01表示差异极显著。
2. 结果
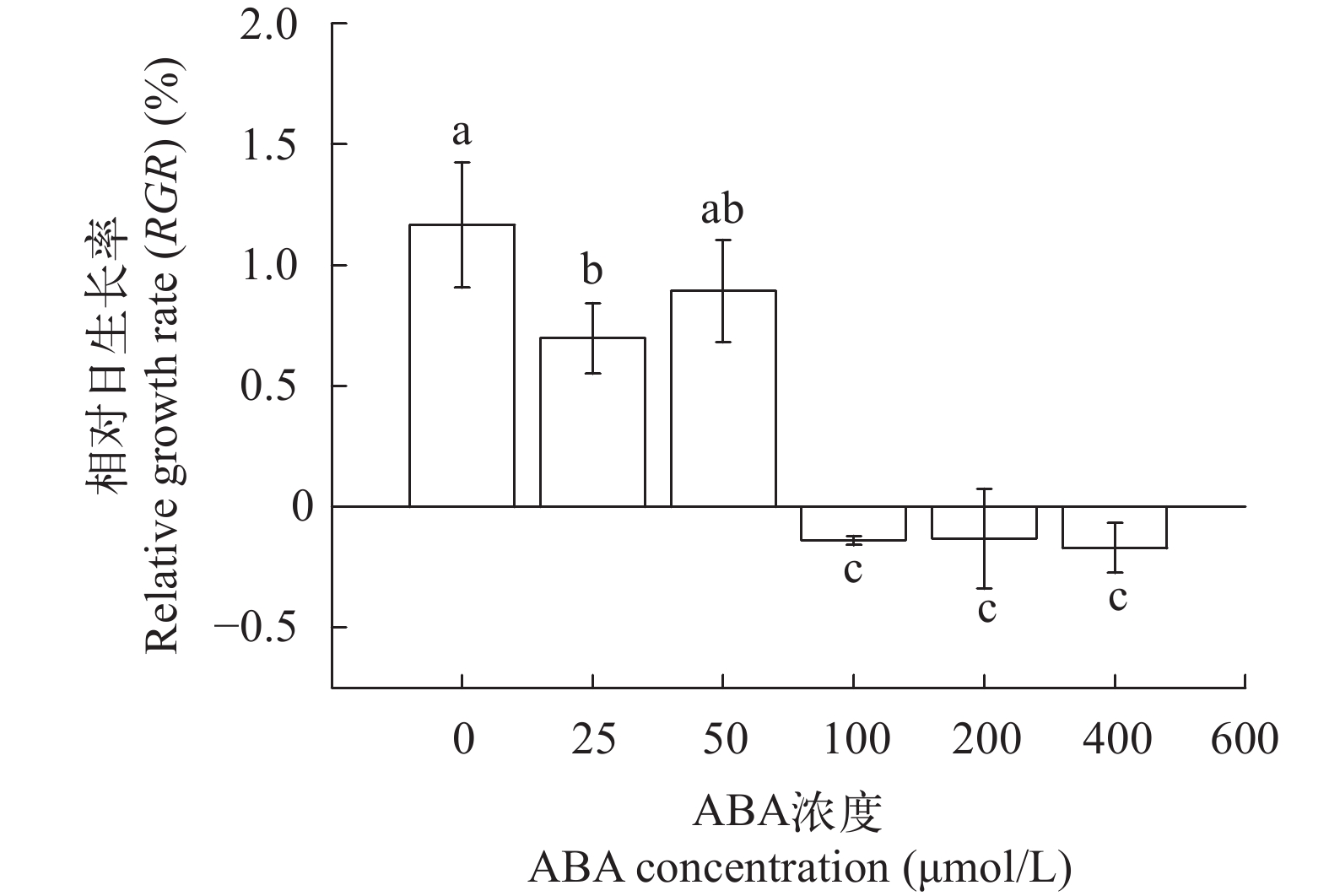
2.1 ABA对坛紫菜丝状体相对日生长率的影响
ABA预处理会降低坛紫菜自由丝状体的相对日生长率RGR(图 1), 且高浓度ABA(≥100 μmol/L)的抑制作用更为强烈(P<0.01), 当ABA浓度为200和400 μmol/L时, 丝状体出现死亡的情况。
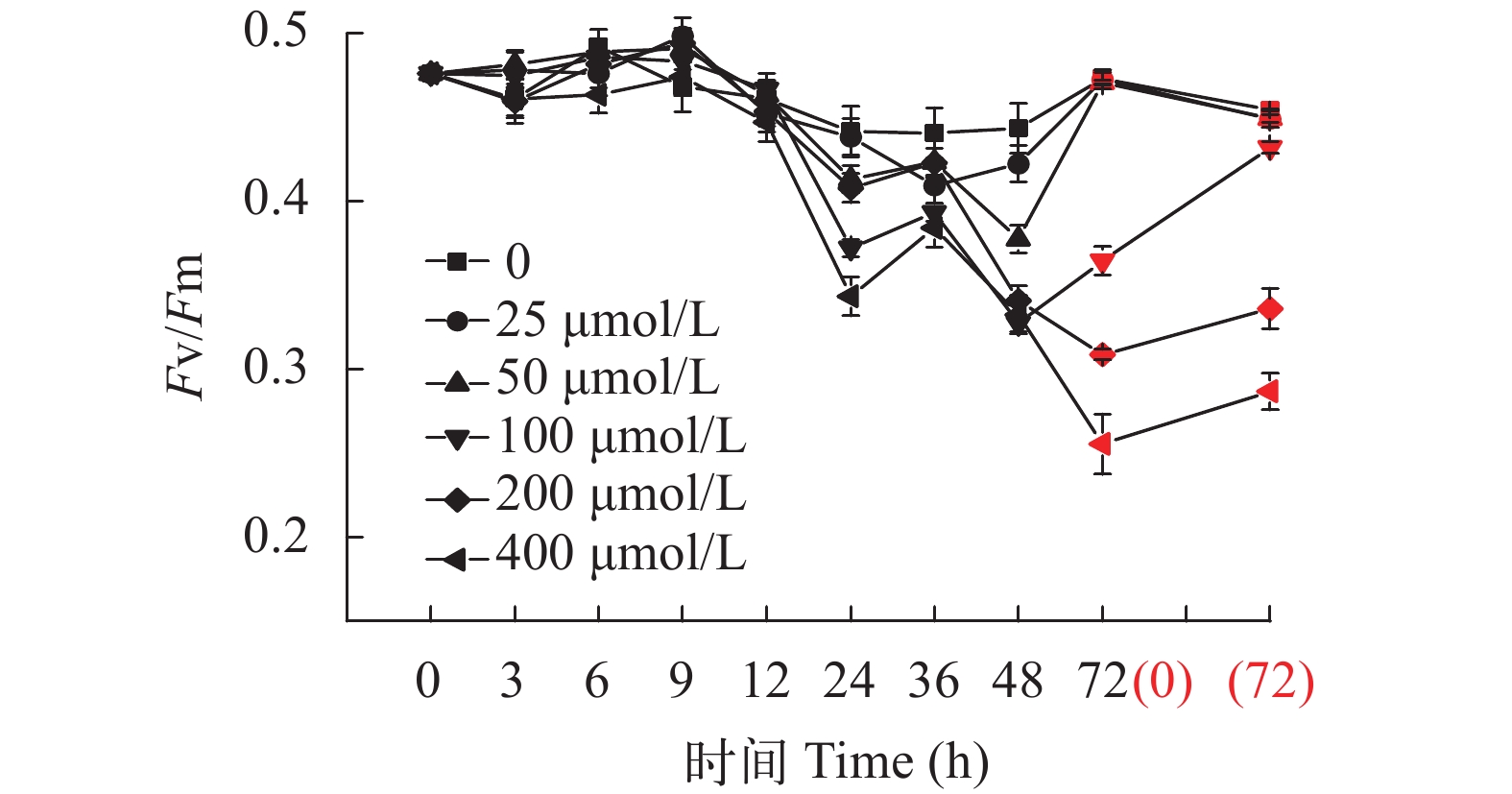
2.2 ABA对坛紫菜丝状体最大光量子效率Fv/Fm的影响
ABA抑制了坛紫菜自由丝状体的最大光量子效率Fv/Fm(图 2)。总体看, ABA对坛紫菜的抑制作用在24h之后表现得比较明显, 抑制强度也随着ABA浓度的升高而加强(P<0.05)。当ABA浓度≤100 μmol/L时, 去除ABA 72h后, Fv/Fm均可恢复至正常水平(P>0.05), 但高浓度ABA(>200 μmol/L)的抑制作用则难以恢复。
根据既能抑制藻体生长但又不会从根本上伤害藻体生理功能的原则, 选择100 μmol/L作为坛紫菜丝状体冻存前预处理的ABA作用浓度。
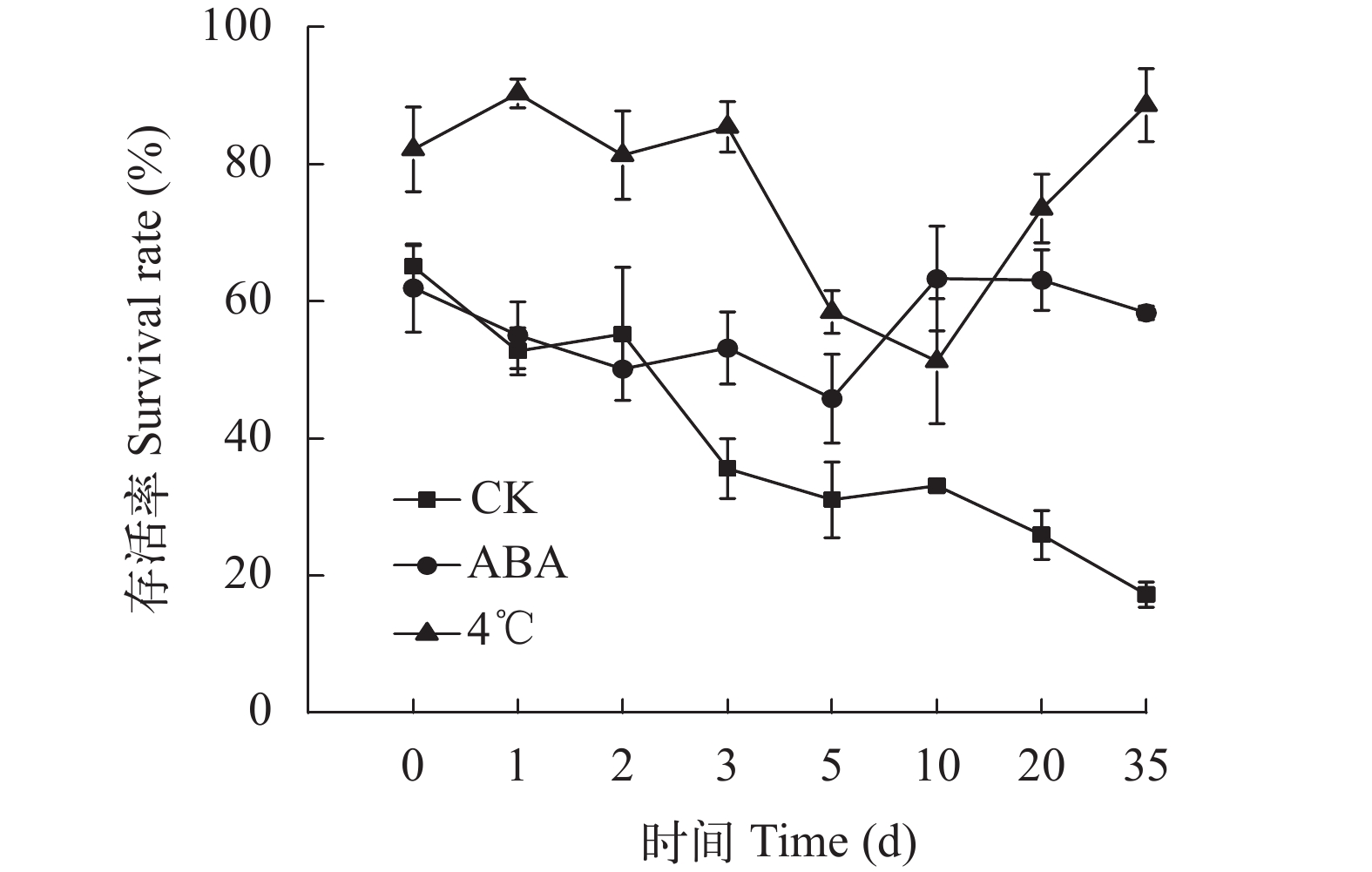
2.3 不同处理对冷冻保存的坛紫菜丝状体存活率的影响
在不同处理中, 坛紫菜丝状体经–80℃冻存后的存活率及显微形态如图 3和图 4所示。结果显示:经4℃冷适应6d和常温下添加外源ABA(100 μmol/L)处理48h后, 丝状体经冻存和解冻复苏后的实时存活率显著高于常规冻存组(CK; P<0.05)。ABA组存活率稳定在59%, 冷适应组存活率平均稳定在89%(图 3)。反观常规冻存组, 随着培养时间的延长, 存活率不断下降, 到35d时存活率仅为17%。可见即使有保护剂的保护, 冷冻仍旧会对藻体产生伤害。这些伤害会在后续培养中逐渐显现, 最终导致种质衰亡。经过4℃冷适应和ABA处理的坛紫菜丝状体在存活率和细胞状态等表现上均明显优于常规冻存组(P<0.01), 4℃冷适应组又显著优于ABA处理组(P<0.05), 4℃冷适应6d的丝状体细胞在冻存中受到的伤害最小, 恢复最快(图 4)。
![]() 图 4 不同处理下坛紫菜丝状体的显微观察CK. 对照组(无预处理);ABA. 100 μmol/LABA处理48h;4℃. 4℃下冷适应6d。所有实验组经–80℃冷冻24h,解冻复苏,并进行后续培养。分别于0、5d、10d、20d和35d进行显微观察。经0.01%伊文思蓝染液染色,死细胞呈现蓝色,活细胞呈现红色Figure 4. Microscopic observation of P. haitanensis conchocelis under different treatmentsCK. Control group (without pre-treatment); ABA. Treated with 100 μmol/L ABA for 48h; 4℃. Cooled at 4℃ for 6d. After pre-treatment, all experiment groups were frozen at –80℃ for 24h, then thawed and recovered. Microscopic observation was conducted at 0d, 5d, 10d, 20d and 35d of the subsequent culture. After staining with 0.01% Evans blue, the dead conchocelis appeared blue and the live conchocelis appeared red
图 4 不同处理下坛紫菜丝状体的显微观察CK. 对照组(无预处理);ABA. 100 μmol/LABA处理48h;4℃. 4℃下冷适应6d。所有实验组经–80℃冷冻24h,解冻复苏,并进行后续培养。分别于0、5d、10d、20d和35d进行显微观察。经0.01%伊文思蓝染液染色,死细胞呈现蓝色,活细胞呈现红色Figure 4. Microscopic observation of P. haitanensis conchocelis under different treatmentsCK. Control group (without pre-treatment); ABA. Treated with 100 μmol/L ABA for 48h; 4℃. Cooled at 4℃ for 6d. After pre-treatment, all experiment groups were frozen at –80℃ for 24h, then thawed and recovered. Microscopic observation was conducted at 0d, 5d, 10d, 20d and 35d of the subsequent culture. After staining with 0.01% Evans blue, the dead conchocelis appeared blue and the live conchocelis appeared red2.4 ABA和冷适应处理及冻存后坛紫菜丝状体的最大光量子效率Fv/Fm
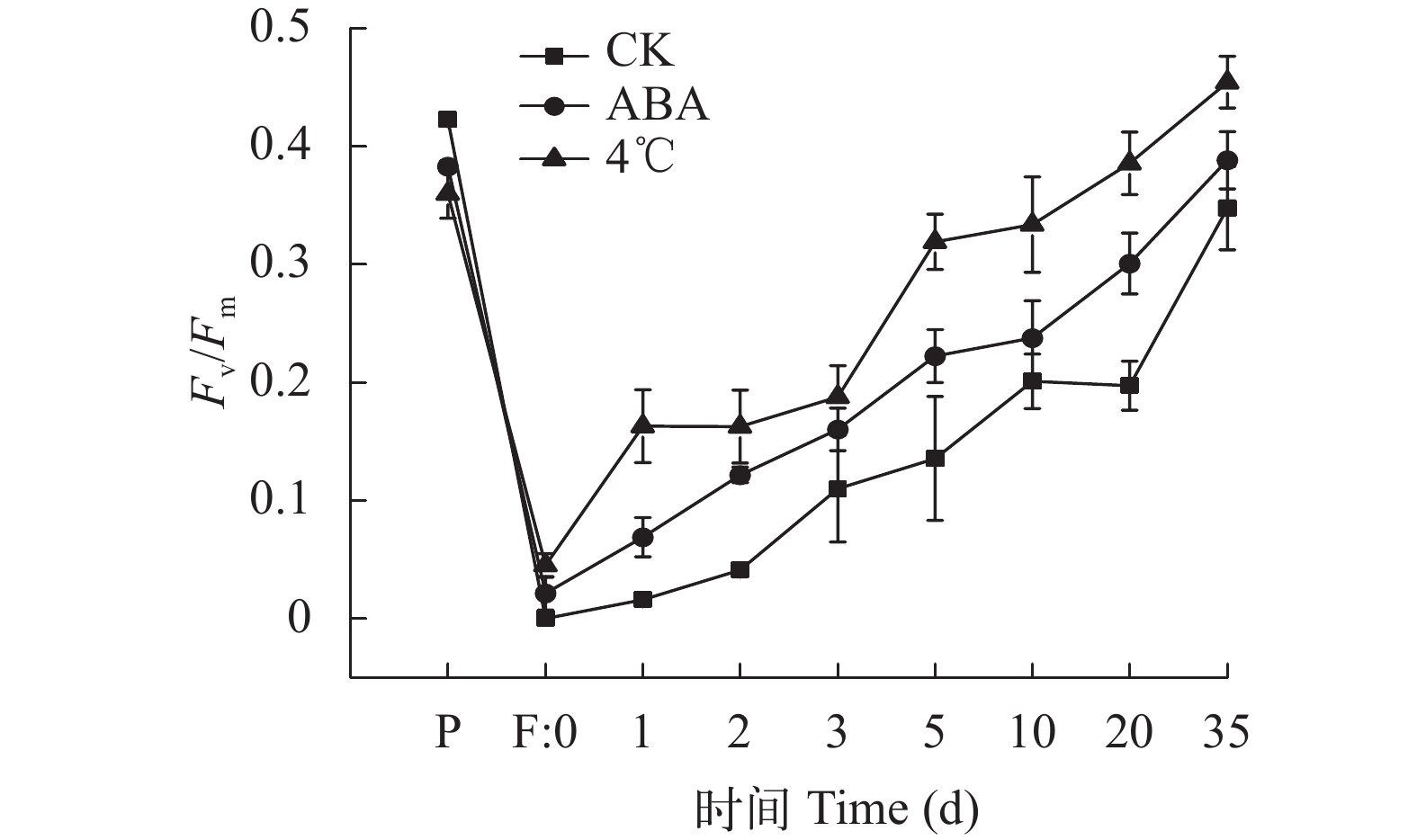
坛紫菜丝状体经–80℃冷冻保存及解冻后, 在20℃恢复培养并测量PSⅡ最大光量子效率(Fv/Fm;图 5)。随着培养时间的延长, 所有样本的Fv/Fm均逐步回升, 说明冻存过的丝状体在适宜条件下可以恢复光合作用。F: 0表明冻存完全抑制了坛紫菜丝状体的光合作用。经ABA和冷适应处理的丝状体在恢复过程中, 光合作用的恢复速率显著高于对照组(P<0.05)。在培养35d时, 4℃冷适应组Fv/Fm完全恢复正常。
![]() 图 5 不同处理组坛紫菜丝状体最大光量子效率Fv/FmP. 预处理(ABA处理48h、4℃黑暗6d);F: 0. –80℃冷冻处理,解冻复苏1h(对照);1—35d. 解冻复苏后培养天数Figure 5. Fv/Fm of P. haitanensis conchocelis under different treatmentsP. Pre-treatment (ABA treatment for 48h; darkness at 4℃ for 6d); F:0. –80℃ Freezing treatment, thawed and recovered for 1h determination (control), 1—35d. subsequent culture days after thaw and recovery
图 5 不同处理组坛紫菜丝状体最大光量子效率Fv/FmP. 预处理(ABA处理48h、4℃黑暗6d);F: 0. –80℃冷冻处理,解冻复苏1h(对照);1—35d. 解冻复苏后培养天数Figure 5. Fv/Fm of P. haitanensis conchocelis under different treatmentsP. Pre-treatment (ABA treatment for 48h; darkness at 4℃ for 6d); F:0. –80℃ Freezing treatment, thawed and recovered for 1h determination (control), 1—35d. subsequent culture days after thaw and recovery2.5 ABA和冷适应处理对坛紫菜丝状体抗冷相关基因表达的影响
我们以正常培养的丝状体为对照, 对9个冷适应及抗逆相关基因进行了qRT-PCR的检测(图 6)。结果显示:在ABA处理组和4℃冷适应组的丝状体中P(H+)-ATPase、Mn-sod A、Cu/Zn-sod 1、psy-2和 gapdh等基因的表达均显著上调(P<0.01), 且冷适应组上调的幅度远大于ABA处理组(P<0.01)。2个处理组ald的表达量均显著高于对照组(P<0.01), 但ABA处理组和冷适应组的差异不明显(P>0.05)。ABA处理组中的hsp70-4表达量显著高于对照组和4℃冷适应组(P<0.01)。ABA也上调了藻体apx-2基因的表达(P<0.01), 但在4℃冷适应组中该基因则表现为下调(P<0.05)。在所有组别中, gpxha表达量均无显著变化。
3. 讨论
3.1 强化藻体抗冷能力可提高冷冻保存的存活率
在已报道的紫菜冷冻保存研究中, 多种紫菜丝状体冻存复苏后的存活率最高达77%[30, 31], 也有部分研究表明冻存的丝状体存活率可达80%以上[15], 叶状体的冷冻存活率更是高达94.6%[32]。然而, 我们重复了这些方法, 发现经解冻复苏后, 丝状体的实时存活率虽然可以达到70%以上, 但是随着恢复培养时间的延长, 丝状体存活率呈显著下降的趋势。可见冻存对藻体的伤害可能会在复苏后期逐渐显现。马宁宁等[33]报道, 生长旺盛的紫菜丝状体冻存后存活率较低, 冷驯化的丝状体有一定的存活率, 低光高温诱导形成的壳孢子囊枝(即膨大藻丝)的冷冻存活率最高, 可达60%以上。然而, 在低温和低光照的保种条件下, 壳孢子囊枝的状态难以长期维持;且从细胞结构上看, 此阶段的藻细胞液泡增大、线粒体体积增大且数量增多[34], 并不适于作为种质保存的材料。此外, 初始的藻体状态及操作中的物理伤害(如剪碎丝状体)也可能会影响藻体的冷冻存活率。因此, 对于提高冻存效率, 增强藻体自身对冷冻胁迫的适应能力与改善冻存方法同等重要。
采用冷驯化(–1—4℃黑暗培养8—12h)可以提高植物在液氮中冷冻的存活率[35]。Ben-Amotz等[20]发现在4℃暴露4周以上可以诱导出微藻的抗寒性, 光周期和光强改变或者营养盐缺乏也可以增强藻的抗冻能力及提高存活率。ABA对植物抵御非生物逆境胁迫起着极其重要的作用, 通过外源添加ABA可以显著提高植物的抗逆能力[36]。例如ABA可以诱导水稻(Oryza sativa L.)[37]和莱茵衣藻(Chlamydomonas reinhardtii)[38]体内抗氧化基因的表达和抗氧化防护酶的活性, 来缓解渗透胁迫导致的氧化损伤, 从而提高整体的抗氧化防护能力。在本实验中, 4℃低温的抗寒锻炼和ABA预处理使得坛紫菜丝状体的生理状态得到了调整, 藻体的存活率较常规冻存组提高了35%—72%。
3.2 ABA和冷适应促进了紫菜抗冷相关基因的表达
在低温下, 细胞膜由液晶相过渡到凝胶相(玻璃化状态), 伴随着膜流动性降低、离子渗漏和膜蛋白失活等现象, 最终会导致细胞冷休克死亡[39]。研究发现, 嗜冷微生物和南极微藻可通过增加膜转运蛋白和不饱和脂肪酸的含量及提高抗氧化防护酶的合成等, 达到提升细胞膜流动性、降低细胞质冰点和增强抗氧化防护, 最终降低冷冻对细胞影响的目的[40, 41]。也有研究报道, 增加膜转运蛋白P(H+)-ATPase含量和使膜脂中的脂肪酸去饱和可以提高细胞膜流通性并调节细胞内外离子的平衡[42], 最终提高红藻的抗寒能力[43]。酰基脂质去饱和酶(Acyl-lipid-desaturase, ALD)在植物的抗寒性中亦有重要作用, 被认为是适应温度变化时最有效的调节膜脂不饱和程度的酶[44]。在拟南芥(Arabidopsis thaliana)和烟草(Nicotiana tabacum)中, ald基因上调能够增强植物的抗寒性[45, 46]。甘油醛-3-磷酸脱氢酶(GAPDH)不仅在糖酵解和光合作用中起重要作用, 还参与膜融合和膜转运等多种亚细胞水平的活动[47]。植物中的gapdh基因参与抑制氧化胁迫下活性氧的积累, 控制电子传递链中的电子转运应答氧化胁迫等, 帮助抵御不良环境对植物造成的伤害[48]。在本研究中, 经过ABA和冷适应处理, 坛紫菜丝状体的P(H+)-ATPase基因、ald基因及gapdh基因均显著上调;由此推测, 在坛紫菜丝状体中, 可能通过调控膜脂的饱和度和跨膜离子运输效率来调节藻体的渗透性, 从而增强抗冻能力。
类胡萝卜素是重要的光合色素, 在植物逆境调控中起重要作用。例如, 极地微藻可大量合成和积累类胡萝卜素来提高抗逆能力[49]。八氢番茄红素合成酶(PSY)是类胡萝卜素——番茄红素合成的关键酶之一[50], 已有研究表明, PSY的过表达可以提高类胡萝卜素的含量[51]。刘欣[52]发现外源ABA(100 μmol/L)处理坛紫菜48h, 对坛紫菜类胡萝卜素的积累有积极作用。在本研究中, ABA和冷适应均可以显著促进坛紫菜丝状体psy-2基因的表达, 有助于提高丝状体的抗冻能力。
植物在非胁迫状态下, 自由基处于动态平衡。当胁迫发生, 植物体内积累大量的活性氧(ROS), 导致膜脂过氧化, 造成细胞损伤[53]。植物中的抗氧化酶防御系统由超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化氢酶(POD)、谷胱甘肽过氧化物酶(GPX)及抗坏血酸过氧化氢酶(APX)等多种成分参与, 与非酶保护系统共同调节氧自由基代谢的平衡[54]。植物的抗寒能力与抗氧化酶系统的活性成正比[55]。藻类的SOD分为4种同工型:Fe-SOD、Mn-SOD、Cu/Zn-SOD和Ni-SOD。其中, Mn-SOD主要与光系统Ⅱ和线粒体相关联, Cu/Zn-SOD主要存在于叶绿体中[54]。SOD和APX是植物叶绿体中主要的ROS清除酶, 有研究表明ABA对光系统Ⅱ复合体有保护作用, 而且能够提高SOD、APX等抗氧化酶的活性[56], 这与我们的实验结果是一致的。谷胱甘肽过氧化物酶在很多动植物中起自由基清除作用。坛紫菜的gpx基因在高温胁迫下表现为先上调后下调的趋势, 当坛紫菜失水达到40%时, 该基因也明显下调[57]。然而, 在本研究中gpxha-1的表达未发生显著性变化。APX是利用抗坏血酸为电子供体的H2O2的清除剂, 在坛紫菜叶状体的光胁迫应答中发挥重要作用[58], 在高等植物中, APX也常用以提高植物对强光、极端温度和盐胁迫等的抗性[59]。但在本研究中, apx-2基因在冷适应后下调, 可能是因为冷适应是在黑暗条件下进行所导致, 具体原因有待进一步验证。
热激蛋白hsp70也是常见的抗逆相关基因, 在植物体内发挥分子伴侣的作用, 帮助合成防御及修复所需的各类物质, 增强植物的抗逆性[60]。ABA可以促进龙须菜hsp70大量表达, 帮助龙须菜应对高温胁迫, 而且在坛紫菜中hsp70基因对于热激胁迫的反应非常敏感[61]。在本研究中, ABA显著上调了坛紫菜丝状体hsp70-4的表达。但在冷适应组, hsp70-4基因表达变化不明显。这说明坛紫菜丝状体的hsp70基因对冷适应并不敏感。
hsp70-4和apx-2基因的表现提示, 坛紫菜丝状体对ABA和冷适应的响应机制是不同的。但综合而言, ABA处理和4℃冷适应均可提高坛紫菜丝状体的冷冻存活率。推测, 经两种方法预处理后, 坛紫菜丝状体可能通过提高质膜的离子运输效率及抗氧化酶的活性、促进细胞膜脂肪酸去饱和和增加保护色素的合成等方式调整藻体自身状态, 提前适应即将进入的超低温冷冻环境, 并在解冻后迅速恢复正常生理状态, 从而提高冻存藻体的存活率。
4. 结论
利用ABA(100 μmol/L)和4℃冷适应预处理坛紫菜丝状体, 然后进行–80℃常规冻存, 能够显著提高紫菜丝状体种质保存的效率。4℃冷适应法操作简单, 效果显著, 易于推广, 具有较好的应用潜力。
-
图 4 不同处理下坛紫菜丝状体的显微观察
CK. 对照组(无预处理);ABA. 100 μmol/LABA处理48h;4℃. 4℃下冷适应6d。所有实验组经–80℃冷冻24h,解冻复苏,并进行后续培养。分别于0、5d、10d、20d和35d进行显微观察。经0.01%伊文思蓝染液染色,死细胞呈现蓝色,活细胞呈现红色
Figure 4. Microscopic observation of P. haitanensis conchocelis under different treatments
CK. Control group (without pre-treatment); ABA. Treated with 100 μmol/L ABA for 48h; 4℃. Cooled at 4℃ for 6d. After pre-treatment, all experiment groups were frozen at –80℃ for 24h, then thawed and recovered. Microscopic observation was conducted at 0d, 5d, 10d, 20d and 35d of the subsequent culture. After staining with 0.01% Evans blue, the dead conchocelis appeared blue and the live conchocelis appeared red
图 5 不同处理组坛紫菜丝状体最大光量子效率Fv/Fm
P. 预处理(ABA处理48h、4℃黑暗6d);F: 0. –80℃冷冻处理,解冻复苏1h(对照);1—35d. 解冻复苏后培养天数
Figure 5. Fv/Fm of P. haitanensis conchocelis under different treatments
P. Pre-treatment (ABA treatment for 48h; darkness at 4℃ for 6d); F:0. –80℃ Freezing treatment, thawed and recovered for 1h determination (control), 1—35d. subsequent culture days after thaw and recovery
表 1 目标基因的RT-qPCR引物序列
Table 1 RT-qPCR primer sequence of the target genes
引物
Primer引物序列
Sequence (5′—3′)长度
Length (bp)psy-2-QF CCACTGATGGCGGGTGTTGT 109 psy-2-QR GGCGACTCGTAGGTACGCTTCT Mn-sod A-QF GGCGATCCGCAACAATG 159 Mn-sod A-QR CCACCCGCTCCCAAACA Cu/Zn-sod 1-QF GCACGGCTTCCACATCCA 132 Cu/Zn-sod 1-QR GTCGTCGCCCACCTCAAT apx-2-QF ATGGCATCATGGTGCGGGTAG 105 apx-2-QR CAATCGAGGCAAGCTGGTAGAGGT gpxha-1-QF CGGCACCAACGAGCAGA 149 gpxha-1-QR CAAAGTTCCACCCGCAGTC hsp70-4-QF TGGGCATCTGGCAGAATG 196 hsp70-4-QR CGACGGGTCCGAGAACTT ald-QF GTGCAGGATATTGTGGAGGT 212 ald-QR AGCCAGTAGCCAGTGGTAAA P(H+)-ATPase-QF CGTGTTTCCGCAGAGCA 225 P(H+)-ATPase-QR GCGTCCGTCGAGATGGT gapdh-QF TGGCGTTGAGGTTGTTGC 94 gapdh-QR CTTGTACGGGCCGTGGGT 18s-QF AGTTAGGGGATCGAAGACGA 150 18s-QR CAGCCTTGCGACCATACTC -
[1] Wade R, Augyte S, Harden M, et al. Macroalgal germplasm banking for conservation, food security, and industry [J]. PLoS Biology, 2020, 18(2): e3000641.
[2] Wernberg T, Smale D A, Fernando T, et al. An extreme climatic event alters marine ecosystem structure in a global biodiversity hotspot [J]. Nature Climate Change, 2012, 3(1): 78-82.
[3] Smale D A, Burrows M T, Moore P, et al. Threats and knowledge gaps for ecosystem services provided by kelp forests: a northeast Atlantic perspective [J]. Ecology and Evolution, 2013, 3(11): 4016-4038.
[4] Grout B. Introduction to the in Vitro Preservation of Plant Cells, Tissues and Organs [M]. Genetic Preservation of Plant Cells in Vitro. Berlin: Springer Berlin Heidelberg, 1995: 1-20.
[5] Engelmann F. Plant cryopreservation: Progress and prospects [J]. In Vitro Cellular Developmental Biology Plant, 2004, 40(5): 427-433.
[6] Vander Meer J P, Simpson F J. Cryopreservation of Gracilaria tikvahiae (Rhodophyta) and other macrophytic marine algae [J]. Phycologia, 1984, 23(2): 195-202.
[7] Zhuang Y, Gong X, Zhang W, et al. Cryopreservation of filaments of Scytosiphon lomentaria by vitrification [J]. Journal of Applied Phycology, 2014, 27(3): 1-6.
[8] 曲善村. 海带种质超低温保存技术的研究 [D]. 北京: 中国农业科学院, 2009: 2-3. Qu S C. Study on cryopreservation techniques of Laminaria germplasm [D]. Beijing: Chinese Academy of Agriculture Science, 2019: 2-3.
[9] Yang L, Deng Y, Xu G, et al. Redefining Pyropia (Bangiales, Rhodophyta): four new genera, resurrection of Porphyrella and description of Calidia pseudolobata sp. nov. from China [J]. Journal of Phycology, 2020, 56(4): 862-879.
[10] 田翠翠, 陆勤勤, 朱建一, 等. 温度对皱紫菜(Pyropia crispata)壳孢子萌发及叶状体形态建成的影响 [J]. 海洋与湖沼, 2020, 51(5): 182-188. Tian C C, Lu Q Q, Zhu J Y, et al. Effect of temperature on conchospore germination and blades morphogenesis of Pyropia crispata (Bangiales, Rhodophyta) [J]. Oceanologia et Limnologia Sinica, 2020, 51(5): 182-188.
[11] 田知海. 条斑紫菜的遗传多样性分析 [D]. 青岛: 中国海洋大学, 2013: 1-3. Tian Z H. Genetic diversity analysis of Pyropia yezoensis [D]. Qingdao: Ocean University of China, 2013: 1-3.
[12] Kuwano K, Aruga Y, Saga N. Cryopreservation of the conchocelis of the marine alga Porphyra yezoensis Ueda (Rhodophyta) in liquid nitrogen [J]. Plant Science, 1993, 94(1): 215-225.
[13] Hunt C J. Cryopreservation: Vitrification and Controlled Rate Cooling [M]. Stem Cell Banking, 2017: 1590.
[14] Mazur P. Kinetics of water loss from cells at subzero temperatures and the likelihood of intracellular freezing [J]. The Journal of General Physiology, 1963, 47(2): 347-369.
[15] Zhou W J, Li Y, Dai J X. Study on cryopreservation of Porphyra yezoensis conchocelis [J]. Journal of Ocean University of China, 2007, 6(3): 299-302.
[16] Kumari N, Gupta M K, Singh R K. Open encapsulation-vitrification for cryopreservation of algae [J]. Cryobiology, 2016, 73(2): 232-239.
[17] Day J G, Fleck R A, Benson E E. Cryopreservation-recalcitrance in microalgae: novel approaches to identify and avoid cryo-injury [J]. Journal of Applied Phycology, 2000, 12(3-5): 369-377.
[18] Farrant J, Walter C A, Lee H, et al. Use of two-step cooling procedures to examine factors influencing cell survival following freezing and thawing [J]. Cryobiology, 1977, 14(3): 273-286.
[19] Leibo S P, McGrath J J, Cravalho E G. Microscopic observation of intracellular ice formation in unfertilized mouse ova as a function of cooling rate [J]. Cryobiology, 1978, 15(3): 257-271.
[20] Ben-Amotz A, Gilboa A. Cryopreservation of marine unicellular algae. Ⅱ. induction of freezing tolerance [J]. Marine Ecology Progress, 1980, 2(3): 221-224.
[21] Benson E E. Plant Conservation Biotechnology-Conservation of Algae [M]. London: Taylor and Francis, 2002: 111-124.
[22] Tsai S, Chong G, Meng P J, et al. Sugars as supplemental cryoprotectants for marine organisms [J]. Reviews in Aquaculture, 2018, 10(3): 703-715.
[23] Taylor R, Fletcher R L. Cryopreservation of eukaryotic algae a review of methodologies [J]. Journal of Applied Phycology, 1998, 10(5): 481-501.
[24] Hartung W. The evolution of abscisic acid (ABA) and ABA function in lower plants, fungi and lichen [J]. Functional Plant Biology, 2010, 37(9): 806-812.
[25] Yoshida K, Igarashi E, Mukai M, et al. Induction of tolerance to oxidative stress in the green alga, Chlamydomonas reinhardtii, by abscisic acid [J]. Plant Cell & Environment, 2003, 26(3): 451-457.
[26] 杜莉, 杨锐, 骆其君, 等. 坛紫菜自由丝状体响应琼胶寡糖的激发 [J]. 水产学报, 2018, 42(7): 1077-1084. Du L, Yang R, Luo Q J, et al. Response of free-living conchocelis of Pyropia haitanensis to agaro-oligosaccharides [J]. Journal of Fisheries of China, 2018, 42(7): 1077-1084.
[27] Grime J P, Hunt R. Relative growth-rate: its range and adaptive significance in a local flora [J]. Journal of Ecology, 1975, 63(2): 393-422.
[28] Eilers P H C, Peeters J C H. A model for the relationship between light intensity and the rate of photosynthesis in phytoplankton [J]. Ecological Modelling, 1988, 42(3-4): 199-215.
[29] Saga N, Sakanishi Y, Ogishima T. Method for quick evaluation of cell viability in marine macroalgae [J]. Japanese Journal of Phycology, 1989, 37(2): 129-136.
[30] Kuwano K, Saga N, Aruga Y. Cryopreservation of clonal gametophytic thalli of Porphyra (Rhodophyta) [J]. Plant Science, 1996, 116(1): 117-124.
[31] Kuwano K, Saga N, Fingerman M, et al. Cryopreservation of marine algae: applications in biotechnology [J]. Recent Advances in Marine Biotechnology, 2000, 4(2): 23-40.
[32] Youn H C, Taek J N, Kuwano K. Cryopreservation of gametophytic thalli of Porphyra yezoensis (Rhodophyceae) by one-step fast cooling [J]. Journal of Applied Phycology, 2013, 25(2): 531-535.
[33] 马宁宁, 李梅. 培养条件对坛紫菜(Porphyra haitanensis) (Rhodophyta)自由丝状体超低温保存的影响 [J]. 辽宁师范大学学报(自然科学版), 2005, 28(1): 100-102. Ma N N, Li M. The effect of culture conditions on the cryopreservation of free living conchocelis of Porphyra haitanensis [J]. Journal of Liaoning Normal University (
Natural Science Edition ) , 2005, 28(1): 100-102. [34] 沈颂东, 戴继勋, 周立冉. 条斑紫菜(Porphyra yezoensis)丝状体的超微结构观察 [J]. 海洋通报, 2000, 3(3): 38-43. Shen S D, Dai J X, Zhou L R. Ultrastrycture of vegetative and reproductive conchocelis of Porphyra yezoensis [J]. Marine Science Bulletin, 2000, 3(3): 38-43.
[35] Martín C, Kremer C, González I, et al. Influence of the cryopreservation technique, recovery medium and genotype on genetic stability of mint cryopreserved shoot tips [J]. Plant Cell Tissue and Organ Culture, 2015, 122(1): 185-195.
[36] Li B, Takahashi D, Kawamura Y, et al. Comparison of plasma membrane proteomic changes of Arabidopsis suspension-cultured cells (T87 Line) after cold and ABA treatment in association with freezing tolerance development [J]. Plant & Cell Physiology, 2012, 53(3): 543-553.
[37] Wang G J, Miao W, Wang J Y, et al. Effects of exogenous abscisic acid on antioxidant systemin weedy and cultivated rice with different chilling sensitivity under chilling stress [J]. Journal of Agronomy and Crop Science, 2013, 199(3): 200-208.
[38] Yoshida K, Igarashi E, Wakatsuki E, et al. Mitigation of osmotic and salt stresses by abscisic acid through reduction of stress-derived oxidative damage in Chlamydomonas reinhardtii [J]. Plant Science, 2004, 167(6): 1335-1341.
[39] 刘华, 张建涛, 陈海燕, 等. 脂肪酸去饱和酶参与植物对胁迫的响应 [J]. 东北农业大学学报, 2013, 44(1): 154-160. Liu H, Zhang J T, Chen H Y, et al. Fatty acid desaturation and plant responses to biotic and abiotic stresses [J]. Journal of Northeast Agricultural University, 2013, 44(1): 154-160.
[40] Casanueva A, Tuffin M, Cary C, et al. Molecular adaptations to psychrophily: the impact of ‘omic’ technologies [J]. Trends in Microbiology, 2010, 18(8): 374-381.
[41] Blanc G, Agarkova I, Grimwood J, et al. The genome of the polar eukaryotic microalga Coccomyxa subellipsoidea reveals traits of cold adaptation [J]. Genome Biology, 2012, 13(5): 39.
[42] 邱丽丽, 赵琪, 张玉红, 等. 植物质膜蛋白质学的逆境应答研究进展 [J]. 植物学报, 2017, 52(2): 128-147. Qiu L L, Zhao Q, Zhang Y H, et al. Research advances in sress-responsive plant plasma membrane proteomic [J]. Chinese Bulletin of Botany, 2017, 52(2): 128-147.
[43] Cao M, Wang D M, Mao W X, et al. Integrating transcriptomics and metabolomics to characterize the regulation of EPA biosynthesis in response to cold stress in seaweed Bangia fuscopurpurea [J]. PLoS One, 2017, 12(12): e0186986.
[44] Murata N, Wada H. Acyl-lipid desaturases and their importance in the tolerance and acclimatization to cold of cyanobacteria [J]. Biochemical Journal, 1995, 308(1): 1-8.
[45] Kodama H, Hamada T, Horiguchi G, et al. Genetic enhancement of cold tolerance by expression of a gene for chloroplast [Omega]-3 fatty acid desaturase in transgenic tobacco [J]. Plant Physiology, 1994, 105(2): 601-605.
[46] Suzanne H, Chris S. A role for membrane lipid polyunsaturation in chloroplast biogenesis at low temperature [J]. Plant Physiology, 1992, 99(1): 194-202.
[47] 付国良, 黄晓红. 甘油醛-3-磷酸脱氢酶功能的研究进展 [J]. 生物物理学报, 2013, 29(3): 181-191. Fu G L, Huang X H. Progress on research of functions of glyceraldehyde-3-phosphate dehydrogenase [J]. Acta Biophysica Sinica, 2013, 29(3): 181-191.
[48] 梁颖, 李玉花. 植物中磷酸甘油醛-3-磷酸脱氢酶(GAPDH)在氧化胁迫下的生理功能 [J]. 植物生理学报, 2009, 45(10): 1027-1032. Liang Y, Li Y H. Physiological functions of glyceraldehyde-3-phosphate dehydrogenase in plants under oxidative stress condition [J]. Plant Physiology Communication, 2009, 45(10): 1027-1032.
[49] Dolhi J M, Maxwell D P, Morgan-Kiss R M. Review: the antarctic Chlamydomonas raudensis: an emerging model for cold adaptation of photosynthesis [J]. Extremophiles Life Under Extreme Conditions, 2013, 17(5): 711-722.
[50] Ma J, Li J W, Xu Z S, et al. Transcriptome profiling of genes involving in carotenoid biosynthesis and accumulation between leaf and root of carrot (Daucus carota L.) [J]. Acta Biochimica et Biophysica Sinica, 2018, 50(5): 481-490.
[51] Kang B S, Gu Q S, Tian P, et al. A chimeric transcript containing Psy1 and a potential mRNA is associated with yellow flesh color in tomato accession PI 114490 [J]. Planta, 2014, 240(5): 1011-1021.
[52] 刘欣. 坛紫菜萜类合成途径关键酶基因GGPS和PDS分子克隆及表达分 [D]. 苏州: 苏州大学, 2018: 1-10. Liu X. Molecular cloning and expression analysis of two key enzyme genes GGPS and PDS in the terpenoids metabolic pathway from Pyropia haitanensis [D]. Su zhou: Soochow University, 2018: 1-10.
[53] Nor'aini M F, Vera G, Robert P, et al. Chilling, oxidative stress and antioxidant responses in shoot cultures of rice [J]. Planta, 1996, 199(4): 552-556.
[54] 王孟强. 条斑紫菜功能基因组特性与抗逆相关基因表达分析 [D]. 青岛: 中国海洋大学, 2007: 171-172. Wang M Q. Analysis of the ESTs and anti-desiccation genes of Porphyra yezoensis Ueda [D]. Qingdao: Ocean University of China, 2007: 171-172.
[55] Fridovich. The biology of oxgen redical [J]. Science, 1975, 201(4359): 875-880.
[56] Saradhi P P, Suzuki I, Katoh A, et al. Protection against the photoinduced inactivation of the photosystem Ⅱ complex by abscisic acid [J]. Plant,Cell and Environment, 2000, 23(7): 711-718.
[57] 张晗晗, 徐燕, 纪德华, 等. 坛紫菜谷胱甘肽过氧化物酶基因的克隆及表达特征 [J]. 中国水产科学, 2016, 23(4): 791-799. Zhang H H, Xu Y, Ji D H, et al. Cloning and expression analysis of the glutathione eroxidase gene from Pyropia haitanensis [J]. Journal of Fishery Sciences of China, 2016, 23(4): 791-799.
[58] 陈陆丹, 许凯, 徐燕, 等. 坛紫菜应答高光强胁迫的生理指标分析 [J]. 应用海洋学学报, 2016, 35(3): 399-404. Chen L D, Xu K, Xu Y, et al. Analysis of physiological indexes in blades of Pyropia haitanensis under high light stress [J]. Journal of Applied Oceanography, 2016, 35(3): 399-404.
[59] Chen Z, Lu H, Hua S, et al. Cloning and overexpression of the ascorbate peroxidase gene from the yam (Dioscorea alata) enhances chilling and flood tolerance in transgenic Arabidopsis [J]. Journal of Plant Research, 2019, 132(6): 857-866.
[60] 陈玉婷, 徐燕, 纪德华, 等. 坛紫菜两种小分子热激蛋白(sHsp)基因的克隆及表达特征分析 [J]. 水产学报, 2015, 39(2): 182-192. Chen Y T, Xu Y, Ji D H, et al. Cloning and expression analysis of two small heat shock protein (sHsp) genes from Pyropia haitanensis [J]. Journal of Fisheries of China, 2015, 39(2): 182-192.
[61] 吕燕, 汪芳俊, 林丽春, 等. 龙须菜中rbc L和hsp70对高温和植物激素的响应 [J]. 水产学报, 2019, 43(4): 886-894. Lv Y, Wang F J, Lin L C, et al. Responses of rbc L and hsp70 to heat and phytohormone treatments in Gracilariopsis lemaneiformis [J]. Journal of Fisheries of China, 2019, 43(4): 886-894.
-
期刊类型引用(1)
1. 陈凌云,罗永华,徐青,杨伟,顾明生. 新型冷冻治疗笔的设计与初步研究. 医药前沿. 2024(20): 12-15 .  百度学术
百度学术
其他类型引用(2)



 下载:
下载: