THE EFFECT OF HYPOXIC STRESS ON TET1 EXPRESSION IN BLUNT SNOUT BREAM
-
摘要: 为研究团头鲂(Megalobrama amblycephala) 5-甲基胞嘧啶(5-methylcytosine, 5mC)羟基化酶TET1(Ten eleven translocation 1)基因的功能及其表达特性, 采用整胚原位杂交、qRT-PCR技术进行了胚胎、组织表达分析及其在急性低氧胁迫下的基因响应研究。序列分析结果表明, 团头鲂TET1基因全长为5526 bp, 编码1841个氨基酸。qRT-PCR结果表明, 团头鲂TET1广泛表达于各个组织中, 并在脑组织中高度表达。在胚胎发育过程中, TET1基因从受精卵开始就有表达, 并在受精后20—44h (20—44 hpf)都维持在一个较高水平。原位杂交结果表明, TET1基因在12 hpf信号相对微弱, 在24和36 hpf信号逐渐增强, 并且都集中在头部表达。通过qRT-PCR检测急性缺氧处理TET1的表达量, 结果表明, TET1基因在鳃和脾等组织中表达显著升高(P<0.01), 在脑、皮肤、眼和肾脏中表达显著降低(P<0.01)。在胚胎中, TET1基因相对表达量明显高于对照组, 尤其在24 hpf低氧处理组的表达量显著地高于对照组(P<0.001)。结果表明TET1基因在低氧应答反应中发挥着重要的作用。该研究结果为TET1基因在低氧响应及功能的保守与分化方面提供了新的视角。Abstract: Ten eleven translocation 1 (TET1) protein is a 5—methylcytosine (5mC) hydroxylase. To study the functions and expression characteristics of TET1 gene in blunt snout bream (Megalobrama amblycephala), the whole mount in situ hybridization (WISH) and qRT-PCR technique were analyzed its expression in embryos and tissues and its response under acute hypoxic stress. Sequence analysis results showed that TET1 gene is 5526 bp, encoding 1841 amino acids. The qRT-PCR results demonstrated that TET1 gene was extensively expressed in tissues of blunt snout bream, especially in brain. During embryonic development, the TET1 gene was expressed from the fertilized egg and was maintained at a high level of 20—44h (20—44 hpf) after fertilization. The WISH analysis results suggested that TET1 signal was relatively weak at 12 hpf, and gradually enhanced at 24 and 36 hpf, especially in the head. Hypoxia significantly induced the expression of TET1 gene in gill, spleen, and other tissues (P<0.01), and significantly decreased its expression in brain, skin, eyes, and kidneys (P<0.01). Hypoxia also increased the expression of TET1 gene in embryos, especially in the 24 hpf hypoxia treatment group (P<0.001). The above results indicated that TET1 gene plays an important role in hypoxia response. This study provides a new perspective on the TET1 gene in terms of hypoxia response and functional conservation and differentiation.
-
Keywords:
- Blunt snout bream /
- Hypoxia stress /
- TET1 /
- Expression analysis
-
水体中的溶氧水平是生物生存、生长、发育和能量代谢等过程中必不可少的因素。水体中的溶氧含量易受到外界因素(如天气状况)影响[1], 当水体氧含量不足以满足鱼体正常生存的需求时, 鱼体就会出现缺氧应激反应[2], 缺氧应激会影响鱼体生长、发育、繁殖和代谢等方面, 长时间的低氧胁迫或胁迫强度过大时, 甚至会引起个体死亡[3, 4]。
缺氧诱导因子(Hypoxia-inducible factors, HIFs)是缺氧应答反应的主要调控因子, 在维持动物体内氧稳态平衡的过程中起着至关重要的作用[5]。在常氧条件下, 脯氨酸羟基化酶家族(Prolyl hydroxylases, PHDs)在特定脯氨酸残基位点羟基化HIF-1和HIF-2, 并通过泛素蛋白酶系统迅速使HIF-1和HIF-2蛋白发生降解[6-8]。而在低氧条件下, PHDs的酶活性受到抑制, TET1与PHD2竞争与HIF-2结合, 导致PHD2降低HIF-2的羟基化, 增强低氧信号转导通路[9, 10]。TET(Ten eleven translocation) 1属于α- 酮戊二酸(alpha-ketoglutaric acid, α-KG)和Fe2+依赖的双加氧酶大家族, 是一种5mC羟基化酶, 是DNA去甲基化过程中不可或缺的一种酶[11], 在调控胚胎干细胞的发育, 肿瘤、血液系统等有重要作用。通过在斑马鱼(Danio rerio)和小鼠(Mus musculus)的研究, 肖武汉团队研究表明, DNA羟甲基化酶基因TET1参与缺氧应答反应, 并在缺氧应答反应中有重要作用[9]。Tsai等[12]研究表明, TET1是由低氧诱导因子(HIF-2)调控的。TET1作为HIF-1α的辅助激活物, 增强HIF-1的转录活性[12]。Chen等[13-15]研究表明, TET1参与了缺氧反应的改变并参与了肿瘤的发生。
团头鲂(Megalobrama amblycephala)是我国重要的淡水养殖经济鱼类, 草食性, 俗称武昌鱼。团头鲂与其他鲤科鱼类相比, 具有不耐低氧的特点, 在运输和养殖过程中, 容易因缺氧而引起应激反应, 甚至死亡, 影响了其养殖产量的提高。因此研究缺氧应答相关基因, 探究团头鲂缺氧应答基因的相关功能就显得尤为重要。
1. 材料与方法
1.1 实验材料
本实验所用材料均取自上海海洋大学农业部团头鲂遗传育种中心, 受精卵为团头鲂(F4代)卵细胞人工体外受精, 将受精卵培养于培养皿(直径15 cm)约100—120颗, 在室温(22±1)℃, 溶氧量(7.0±0.5) mg/L下培养, 使用经24h曝气的自来水, 每4—5h换水。每隔4h (0—40h)固定一批胚胎, 按照RNA保存液使用说明操作, 保存于–80℃至使用。原位杂交所用胚胎去卵膜后于4%磷酸缓冲液4℃、12h, 后转至甲醛中–20℃保存; 取体质量为150—160 g的F5代团头鲂暂养在实验室的塑料水族箱(35 cm×55 cm×45 cm)中, 暂养7d, 温度(24.5±1.0)℃、溶氧量(7.0±0.5) mg/L, 每2日换水(24h曝气的自来水)1/3, 每日投喂两次(8:00和16:00), 保持自然光照。
1.2 实验设计与样品采集
取30尾F5代团头鲂幼鱼于3个自动循环系统的水箱(50 L)各10尾, 共设2个溶氧水平, 低氧处理方法参考Zhang等[16], 根据预实验设其中两组为低氧组(1.5±0.5) mg/L; 对照组(7.0±0.5) mg/L, 急性缺氧处理4h, 各实验组随机取3尾鱼, MS-222(100 mg/L)麻醉, 取组织(心、肝脏、脑、鳃、肌肉、皮肤、眼睛、肾和脾脏) –80℃保存, 而后将缺氧处理组恢复至常氧(7.0±0.5) mg/L, 24h后取组织–80℃保存, 每个实验组3个重复。团头鲂极不耐低氧, 胚胎在低氧条件下极易死亡, 故根据预实验, 胚胎低氧处理组设两个实验组, 每组200颗胚胎, 低氧组(3.5±0.5) mg/L; 对照组(7.0±0.5) mg/L, 低氧处理6h, 低氧处理组在6、12、18、24及30 hpf取样, 放入RNA保存液, 对照组也及时在对应的各个发育阶段取样, 每组设置3个重复, 每个重复200颗胚胎。水体溶氧水平通过氮气和增氧棒的气阀通气大小来控制, 并及时用溶氧仪检测氧含量。
1.3 TET1基因扩增及序列测定
通过与GenBank中预测的多种鲤科鱼类TET1 mRNA序列比对, 根据根据本实验室前期获得的团头鲂转录组中已有TET1序列, 设计引物F1/R1(表 1), 以团头鲂脑组织cDNA第一链为模板进行PCR, 分别扩增获得TET1基因片段序列。PCR产物经胶回收后连接至pGEM-T载体, 筛选获得阳性克隆送上海生工测序, 测序结果经整合确认其为目的条带。
表 1 所用引物序列Table 1. Primers sequences used in this study引物名称
Primer name引物序列Primer sequence (5′—3′) 实验技术Assay technique RT-F1 ACGATGTGCTAAATCCTGGTG Fragment PCR RT-R1 TTCCCTACAGCCCAGACGAC Fragment PCR 3′RT-F1 GAATCCGAAATGCTCACCC Fragment PCR 3′RT-R1 GGATGACGAACTCCTATTGC Fragment PCR qRT-F1 TGGAGGTGTTACGGTGTTGTC qRT-PCR qRT-R1 ACACAGTCACAGGAGGGCAG qRT-PCR In situ-F CGCATCTCTCTGGTCTTCTAC Fragment PCR-WISH In situ-R GGATGACGAACTCCTATTGC Fragment PCR-WISH 18S-F AGAAACGGCTACCACATCCA qRT-PCR 18S-R TCCCGAGATCCAACTACGAG qRT-PCR 1.4 序列及进化树分析
利用BioEdit 7.0.0.1、NCBI BLAST等软件对所得序列比对获得TET1基因序列。用NCBI BLAST对不同物种的TET1蛋白预测序列进行比较[17]。用Clustal X1.81同源比对蛋白序列, Phyre2、Pymol软件预测TET1蛋白的二级结构[18]。MEGA 6.06构建TET1系统发育进化树[19]。
1.5 整胚原位杂交(WISH)分析
根据原位杂交探针的设计原则, 探针的引物(表 1), 用Primer5.0软件在ORF与3′UTR之间设计探针引物(700—1000 bp), 进行常规TA克隆, 送测, 将质粒用内切酶进行单酶切, 酶切产物作为模板进行体外转录, 体外转录使用的地高辛作为标记[20]。
原位杂交实验[21]主要包括胚胎赋水、蛋白酶K处理、固定胚胎、去除固定、预杂交和杂交, 然后探针的去除洗涤和抗体血清的封闭及抗体血清的去除、洗涤胚胎、罗氏BM染料显色和拍照等关键步骤。
1.6 荧光定量(qRT-PCR)分析
实时定量PCR使用PCR荧光定量仪(BioRad, Hercules, CA, USA), 以18S[21]为内参基因, 引物序列(表 1), Mix使用SYBR Green Premix Ex Taq (TaKaRa)。所得数据以Mean±SE的形式表示, 用SPSS进行单因素方差法分析。
2. 结果
2.1 团头鲂TET1基因的序列分析
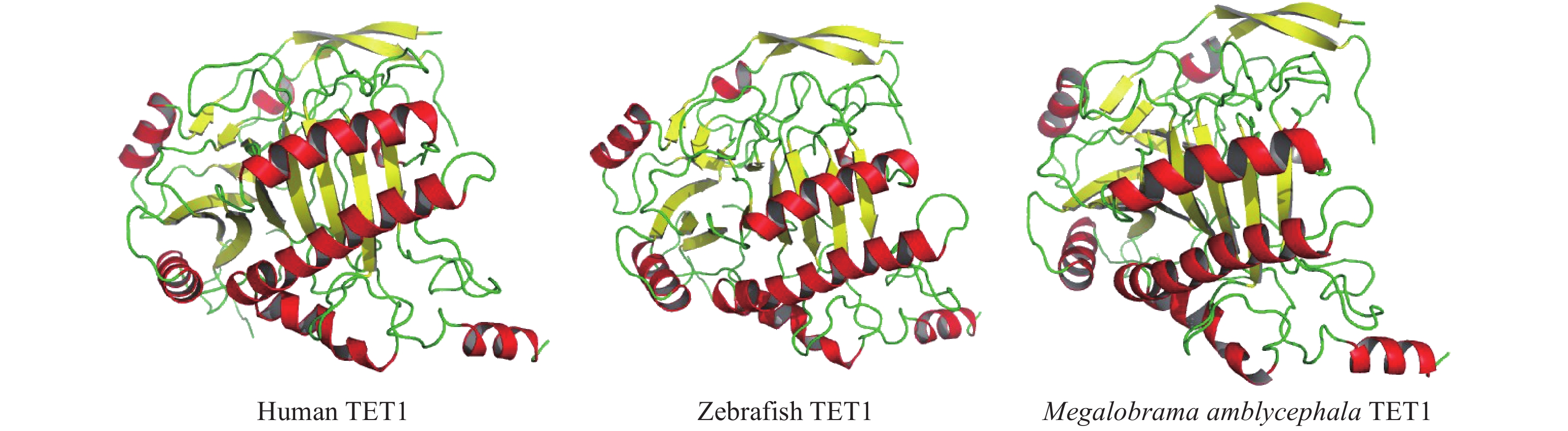
团头鲂TET1基因全长为5526 bp, 编码1841个氨基酸, 通过Phyre2、Pymol软件模拟预测TET1蛋白二级结构, 将团头鲂TET1与人类TET1、斑马鱼TET1对比, 发现人类、斑马鱼与团头鲂TET1二级结构相似, 都主要包括无规则卷曲及α螺旋(图 1)。
通过MEGA 6.06软件构建系统发育树分析表明, TET1与对应的物种聚合度良好, 团头鲂的TET1基因与无脊椎动物的TET1基因聚为一支, 而人类、小鼠、虎鲸等脊椎动物聚为一支。在鱼类分支中, 团头鲂的TET1与金线鲃、露斯塔野鲮和斑马鱼聚为一个小分支(图 2)。
![]() 图 2 团头鲂TET1基因序列构建的系统进化树基因序列号从基因文库检索, 团头鲂TET1用下划线标出, 显示值来自1000次的重复试验所得Figure 2. Phylogenetic tree of blunt snout bream TET1 sequences in vertebratesThe gene serial number was retrieved from GenBank; The blunt snout bream TET1 is indicated by underline; The bootstrap values derived from 1000 replications are shown
图 2 团头鲂TET1基因序列构建的系统进化树基因序列号从基因文库检索, 团头鲂TET1用下划线标出, 显示值来自1000次的重复试验所得Figure 2. Phylogenetic tree of blunt snout bream TET1 sequences in vertebratesThe gene serial number was retrieved from GenBank; The blunt snout bream TET1 is indicated by underline; The bootstrap values derived from 1000 replications are shown2.2 TET1在胚胎和组织中的表达模式
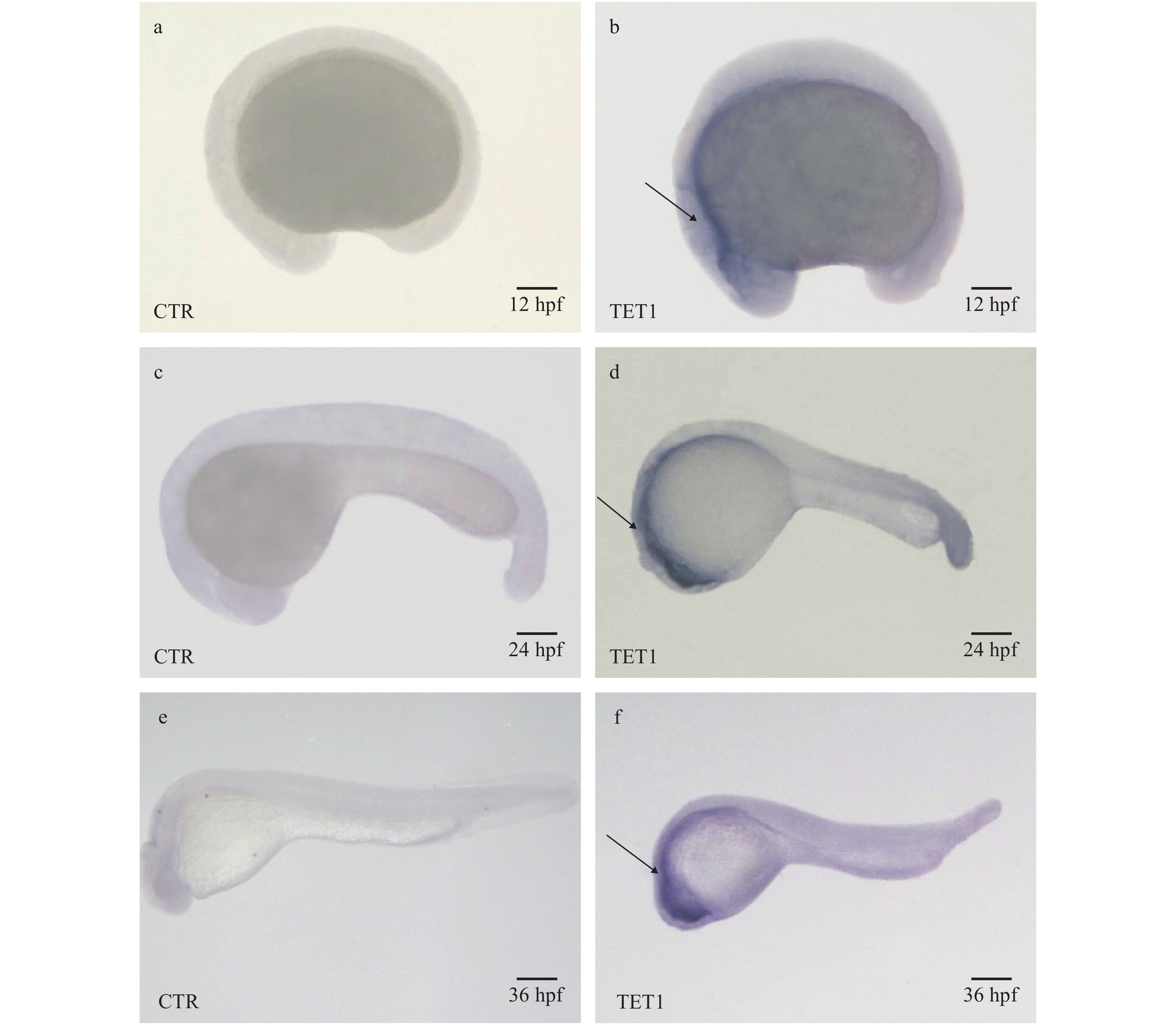
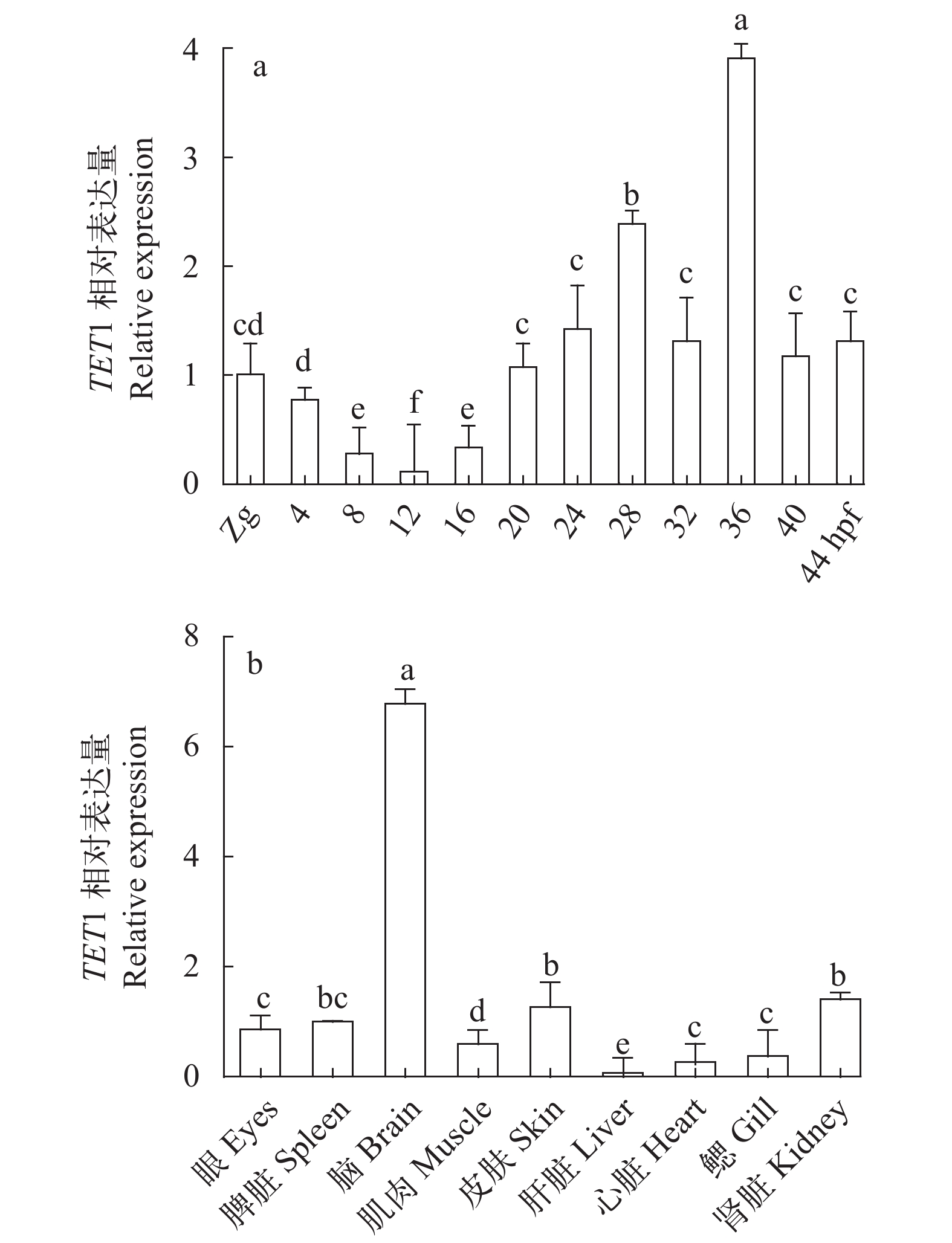
整胚原位杂交结果显示, TET1基因在12 hpf时在头部检测到相对较弱信号(图 3b), 在24和36 hpf胚胎时期, TET1基因主要在头部强烈表达(图 3d和3f); qRT-PCR检测结果显示, 团头鲂TET1基因从受精卵开始就有表达, 随着胚胎不断发育它们的表达水平明显的提高, 在20 hpf处显著升高, 并在20—44 hpf都维持在一个较高水平(图 4a), 这与原位杂交结果基本一致。如图 4b所示, 团头鲂TET1广泛表达于各个组织中, 并在脑组织中高度表达, 在肝、心和鳃组织中表达相对较低。
![]() 图 3 团头鲂TET1基因各时期的原位杂交结果hpf表示受精后的小时数, 胚胎12 hpf为图 (a, b), 24 hpf (c, d), 36 hpf (e, f), 箭头指示头部位置, 比例尺: 500 μmFigure 3. Whole-mount embryo in situ hybridization analysis of blunt snout bream TET1 mRNAshpf, hours post-fertilization, Embryos at 12 hpf (a, b), 24 hpf (c, d) and 36 hpf (e, f) were analyzed using TET1 probe, arrows show the head. Scale bar = 500 μm
图 3 团头鲂TET1基因各时期的原位杂交结果hpf表示受精后的小时数, 胚胎12 hpf为图 (a, b), 24 hpf (c, d), 36 hpf (e, f), 箭头指示头部位置, 比例尺: 500 μmFigure 3. Whole-mount embryo in situ hybridization analysis of blunt snout bream TET1 mRNAshpf, hours post-fertilization, Embryos at 12 hpf (a, b), 24 hpf (c, d) and 36 hpf (e, f) were analyzed using TET1 probe, arrows show the head. Scale bar = 500 μm![]() 图 4 团头鲂TET1基因在胚胎各时期(a)及成鱼各组织(b)的荧光定量表达分析相对表达量以18S mRNA做内参, 试验结果用Mean±SD表示, 不同的字母表示差异显著(P<0.01), Zg表示受精卵, hpf表示受精后的小时数; 下同Figure 4. qRT-PCR analysis of blunt snout bream TET1 mRNAs levels during embryogenesis (a) and in adult tissues (b)The relative expression levels of TET1 were calculated based on the standard curve and normalized to 18S levels. The results are given as mean±SE for separate fish (n=3). Columns marked with different letters are significantly different (P<0.01). Zg, zygote; hpf, hours post-fertilization. The same applies below
图 4 团头鲂TET1基因在胚胎各时期(a)及成鱼各组织(b)的荧光定量表达分析相对表达量以18S mRNA做内参, 试验结果用Mean±SD表示, 不同的字母表示差异显著(P<0.01), Zg表示受精卵, hpf表示受精后的小时数; 下同Figure 4. qRT-PCR analysis of blunt snout bream TET1 mRNAs levels during embryogenesis (a) and in adult tissues (b)The relative expression levels of TET1 were calculated based on the standard curve and normalized to 18S levels. The results are given as mean±SE for separate fish (n=3). Columns marked with different letters are significantly different (P<0.01). Zg, zygote; hpf, hours post-fertilization. The same applies below2.3 TET1在胚胎和组织中的低氧表达分析
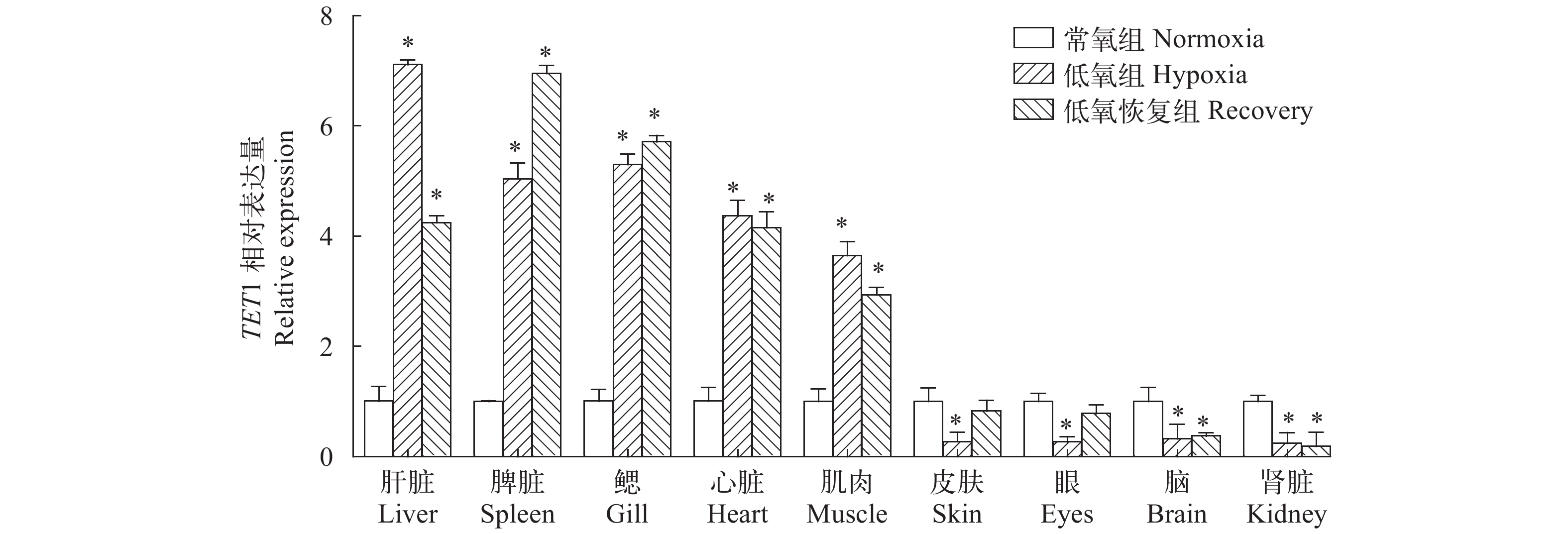
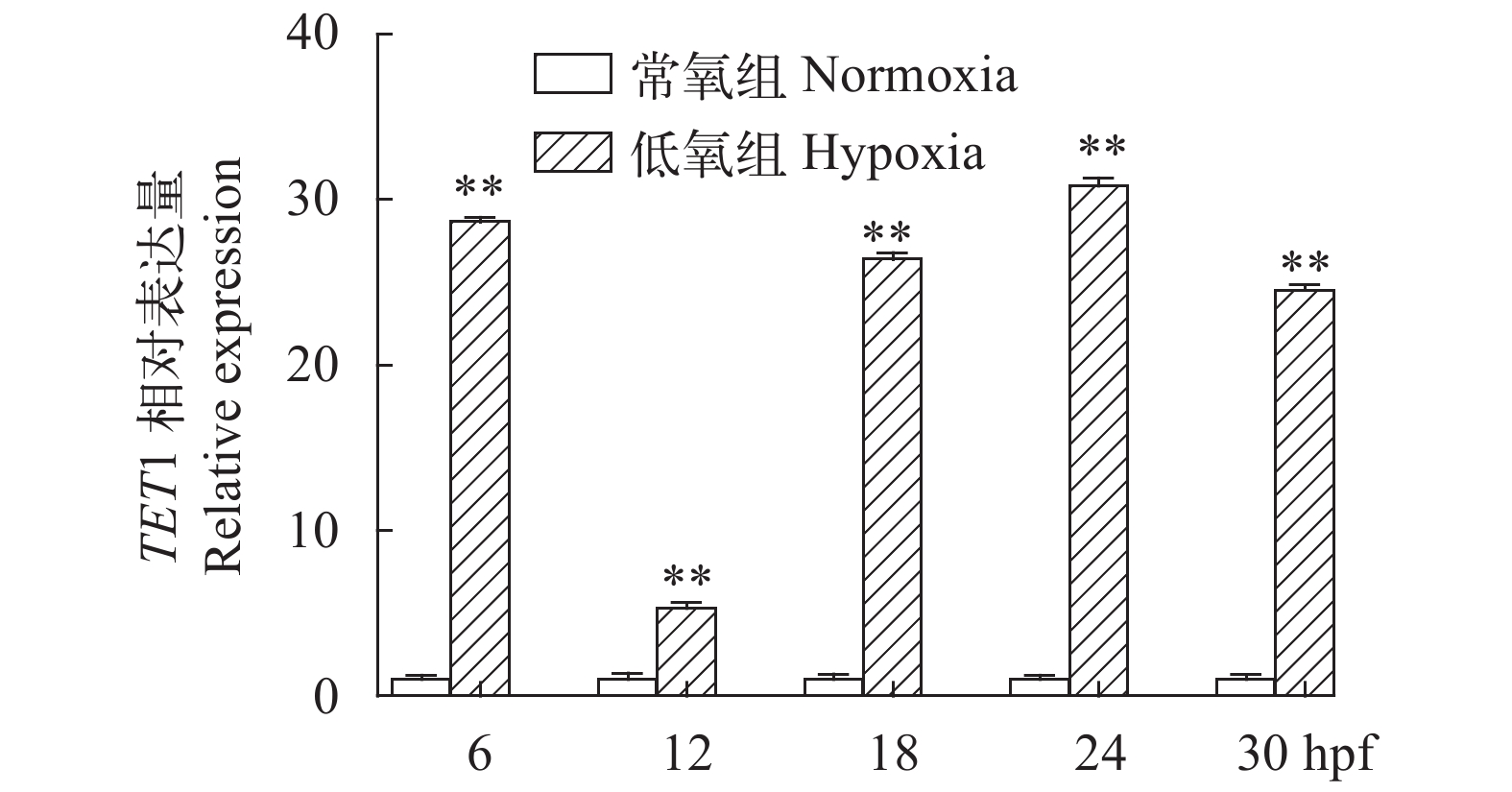
通过qRT-PCR检测急性低氧胁迫处理团头鲂各组织中TET1的表达量, 结果显示在低氧胁迫下, TET1基因在鳃、肝脏、心和脾组织中极显著地升高(P<0.01), 但在脑、皮肤、眼和肾脏中显著地降低(P<0.01), 氧含量恢复24h后, 各个组织均有恢复的趋势, 但大多尚未恢复到正常表达水平(图 5)。胚胎低氧胁迫的检测结果显示, 低氧处理组胚胎TET1基因相对表达量明显高于对照组(图 6), 尤其在24 hpf低氧处理组的表达量极显著地高于对照组(P<0.001)。
3. 讨论
团头鲂是一种不耐低氧的经济养殖鱼类。本研究中对团头鲂TET1的序列结构进行了分析研究, TET1序列比对及结构分析结果显示团头鲂TET1在3′ 端催化结构域高度保守, 包括富含半胱氨酸区域(Cys-rich domain)和DSBH结构域, 两者构成具有双加氧酶活性的结构。DSBH结构域包含3个保守的铁离子结合区和1个酮戊二酸结合区(2-oxoglutarate (2OG)-Fe(II)-dependent dioxygenases), 参与将5mC羟化为5-羟甲基胞嘧啶(5-hydroxymethylcytosine, 5hmC)、5-甲酰基胞嘧啶(5-formylcytosine, 5fC)、5-羧甲基胞嘧啶(5-carboxylcytosine, 5caC)的主动去甲基化过程。另外, 我们发现人类TET家族3′ 端都具有保守的催化结构域, 这种结构可能决定了TET家族都具有催化5mC羟基化的酶活性。TET1 5′ 端有典型的CXXC zinc finger domain, CXXC结构域能增强对DNA CpG岛(富含胞嘧啶(C)和鸟嘌呤(G)的DNA区域)的定向结合能力, 从而完成主动去甲基化的过程。二级结构预测结果显示, 团头鲂与人类、斑马鱼的TET1结构相似, 说明团头鲂TET1基因在长期进化过程中具有高度的保守性。进化树分析结果显示团头鲂TET1与其他硬骨鱼类具有良好的聚类关系, 这些结果说明团头鲂TET1是硬骨鱼特异基因组复制产生。TET1基因保守的功能性结构域和氨基酸序列暗示着在进化过程中可能具有保守的生物学功能。
葛亮[22]在斑马鱼中的研究发现, 斑马鱼TET1基因在22 hpf及36 hpf主要在头部表达。与在斑马鱼中研究相符, 我们的研究结果显示, 团头鲂TET1基因在早期表达相对微弱, 中期和后期表达信号显著增强, 都主要在头部表达。团头鲂TET1基因从受精卵开始就有表达, 随着胚胎不断发育它们的表达水平有显著的提高但有一定的波动性, 与原位杂交结果基本一致。这表明TET1可能参与胚胎发育过程, 并在胚胎发育过程起着重要作用。有研究表明TET1在小鼠ES细胞的维持和囊胚期内细胞团特化相关[23, 24]。团头鲂TET1基因在各个组织都有广泛的表达, 并在脑组织中高度表达, 这与在小鼠中的研究相吻合。Kriaucionis和Heintz[25]的研究发现, 5hmC在小鼠脑组织高度分布。也有研究表明, TET1对小鼠脑部神经元的发育有重要相关性[26, 27]。另外, 我们发现除脑组织外, TET1基因在脾和肾等重要组织中也高度表达。
氧含量对生物体的生存与生长至关重要, 氧含量易受天气等的影响而发生变化, 生活在氧含量易变化的鱼类在进化过程中发展出适应低氧的复杂机制[28, 29], 在适应低氧应激的过程中, 低氧应答相关基因的表达水平会发生变化[16, 30]。在斑马鱼缺氧胁迫实验中, 发现低氧条件下诱导了TET1的mRNA水平, 引起5hmC水平增高[9]。本研究发现, 团头鲂TET1基因在低氧胁迫环境处理的胚胎中显著的诱导表达, 此结果表明, 团头鲂胚胎期的TET1基因可以受到低氧胁迫的诱导。在幼鱼的急性低氧胁迫实验中, 我们发现团头鲂TET1基因在鳃、肝和脾等组织中表达显著上调, 在脑和皮等组织中表达显著下调, 这可能暗示着TET1基因在低氧应答有重要作用。另外, 我们发现随着溶氧的恢复鳃、脾和肝等组织中TET1的表达量并没有恢复到正常水平, 说明24h恢复期不足以让团头鲂TET1基因在低氧胁迫中完全恢复。Jing等[9]的研究发现, 与野生型相比, TET1敲除鱼对低氧更为敏感。根据在低氧胁迫下胚胎及组织中这些表达特征可以推断团头鲂TET1基因可能参与低氧胁迫响应, 进而增强其对低氧的适应性。
4. 结论
本文主要探究了团头鲂TET1的功能结构和胚胎各时期的时空表达模式, 及在低氧应激条件下胚胎及幼鱼各组织中的差异表达分析。我们认为低氧胁迫下TET1基因的差异表达暗示这可能是一种潜在的低氧调控机制, 需要我们进一步挖掘探究。本研究主要为TET1基因的功能探究提供参考依据, 为参与低氧应答机制的研究提供了新的线索。
-
图 2 团头鲂TET1基因序列构建的系统进化树
基因序列号从基因文库检索, 团头鲂TET1用下划线标出, 显示值来自1000次的重复试验所得
Figure 2. Phylogenetic tree of blunt snout bream TET1 sequences in vertebrates
The gene serial number was retrieved from GenBank; The blunt snout bream TET1 is indicated by underline; The bootstrap values derived from 1000 replications are shown
图 3 团头鲂TET1基因各时期的原位杂交结果
hpf表示受精后的小时数, 胚胎12 hpf为图 (a, b), 24 hpf (c, d), 36 hpf (e, f), 箭头指示头部位置, 比例尺: 500 μm
Figure 3. Whole-mount embryo in situ hybridization analysis of blunt snout bream TET1 mRNAs
hpf, hours post-fertilization, Embryos at 12 hpf (a, b), 24 hpf (c, d) and 36 hpf (e, f) were analyzed using TET1 probe, arrows show the head. Scale bar = 500 μm
图 4 团头鲂TET1基因在胚胎各时期(a)及成鱼各组织(b)的荧光定量表达分析
相对表达量以18S mRNA做内参, 试验结果用Mean±SD表示, 不同的字母表示差异显著(P<0.01), Zg表示受精卵, hpf表示受精后的小时数; 下同
Figure 4. qRT-PCR analysis of blunt snout bream TET1 mRNAs levels during embryogenesis (a) and in adult tissues (b)
The relative expression levels of TET1 were calculated based on the standard curve and normalized to 18S levels. The results are given as mean±SE for separate fish (n=3). Columns marked with different letters are significantly different (P<0.01). Zg, zygote; hpf, hours post-fertilization. The same applies below
表 1 所用引物序列
Table 1 Primers sequences used in this study
引物名称
Primer name引物序列Primer sequence (5′—3′) 实验技术Assay technique RT-F1 ACGATGTGCTAAATCCTGGTG Fragment PCR RT-R1 TTCCCTACAGCCCAGACGAC Fragment PCR 3′RT-F1 GAATCCGAAATGCTCACCC Fragment PCR 3′RT-R1 GGATGACGAACTCCTATTGC Fragment PCR qRT-F1 TGGAGGTGTTACGGTGTTGTC qRT-PCR qRT-R1 ACACAGTCACAGGAGGGCAG qRT-PCR In situ-F CGCATCTCTCTGGTCTTCTAC Fragment PCR-WISH In situ-R GGATGACGAACTCCTATTGC Fragment PCR-WISH 18S-F AGAAACGGCTACCACATCCA qRT-PCR 18S-R TCCCGAGATCCAACTACGAG qRT-PCR -
[1] 徐贺, 陈秀梅, 王桂芹, 等. 低氧胁迫在水产养殖中的研究进展 [J]. 饲料工业, 2016(2): 33-37. Xu H, Chen X M, Wang G Q, et al. Research progress of hypoxia on aquaculture [J]. Feed Industry, 2016(2): 33-37. [
[2] 陈德举, 强俊, 陶易凡, 等. 不同溶氧水平对吉富罗非鱼幼鱼生长、血液生化、脂肪酸组成及其抗海豚链球菌病的影响 [J]. 淡水渔业, 2019, 49(4): 83-89. Chen D J, Qiang J, Tao Y F, et al. Effects of different dissolved oxygen levels on the growth, blood biochemistry, fatty acid composition and against Streptococcus iniae infection of GIFT juvenile (Oreochromis niloticus) [J]. Freshwater Fisheries, 2019, 49(4): 83-89. [
[3] 杨明, 孙盛明, 傅洪拓, 等. 低氧和复氧对日本沼虾抗氧化酶活力及组织结构的影响 [J]. 中国水产科学, 2019, 26(3): 493-503. doi: 10.3724/SP.J.1118.2019.18285 Yang M, Sun S M, Fu H T, et al. Hypoxia and reoxygenation on antioxidant enzyme activities and histological structure of Macrobrachium nipponense [J]. Journal of Fishery Sciences of China, 2019, 26(3): 493-503. [ doi: 10.3724/SP.J.1118.2019.18285
[4] Nordlie F G. Influences of body mass, temperature, oxygen tension, and salinity on respiratory oxygen consumption of cyprinodontoid fishes of three families [J]. Reviews in Fish Biology and Fisheries, 2014, 24(1): 269-315. doi: 10.1007/s11160-013-9331-9
[5] 沈睿杰. 团头鲂缺氧诱导因子的结构和功能研究 [D]. 上海: 上海海洋大学, 2011: 9-31 Shen R J. Structural and functional studies of hypoxia inducible factors in Megalobrama amblycephala [D]. Shanghai: Shanghai Ocean University, 2011: 9-31
[6] Bishop T, Ratcliffe P J. HIF hydroxylase pathways in cardiovascular physiology and medicine [J]. Circulation Research, 2015, 117(1): 65-79. doi: 10.1161/CIRCRESAHA.117.305109
[7] Ivan M, Kondo K, Yang H, et al. HIFalpha targeted for VHL-mediated destruction by proline hydroxylation: implications for O2 sensing [J]. Science, 2001, 292(5516): 464-468. doi: 10.1126/science.1059817
[8] Ohh M, Park C W, Ivan M, et al. Ubiquitination of hypoxia-inducible factor requires direct binding to the beta-domain of the von Hippel-Lindau protein [J]. Nature Cell Biology, 2000, 2(7): 423-427. doi: 10.1038/35017054
[9] Jing W, Zhang D W, Du J, et al. Tet1 facilitates hypoxia tolerance by stabilizing the HIF-α proteins independent of its methylcytosine dioxygenase activity [J]. Nucleic Acids Research, 2017, 45(22): 12700-12714. doi: 10.1093/nar/gkx869
[10] Liu X, Chen Z, Xu C X, et al. Repression of hypoxia-inducible factor alpha signaling by Set7-mediated methylation [J]. Nucleic Acids Research, 2015, 43(10): 5081-5098. doi: 10.1093/nar/gkv379
[11] 叶志安. 利用基因编辑技术构建tet基因家族斑马鱼突变体 [D]. 广东: 南方医科大学, 2017: 9-17 Ye Z A. Establish tet mutant in zebrafish by gene editing technology [D]. Guangdong: Southern Medical University, 2017: 9-17
[12] Tsai Y P, Chen H F, Chen S Y, et al. TET1 regulates hypoxia-induced epithelial-mesenchymal transition by acting as a co-activator [J]. Genome Biology, 2014, 15(12): 1-13.
[13] Chen H F, Wu K J. Epigenetics, TET proteins, and hypoxia in epithelial-mesenchymal transition and tumorigenesis [J]. BioMedicine, 2016, 6(1): 1-8. doi: 10.7603/s40681-016-0001-9
[14] Thienpont B, Steinbacher J, Zhao H, et al. Tumour hypoxia causes DNA hypermethylation by reducing TET activity [J]. Nature, 2016, 537(7618): 63-68. doi: 10.1038/nature19081
[15] Kao S H, Wu K J, Lee W H. Hypoxia, epithelial-mesenchymal transition, and TET-mediated epigenetic changes [J]. Journal of Clinical Medicine, 2016, 5(2): 1-14.
[16] Zhang X L, Sun Y W, Jiang X Y, et al. Gene duplication, conservation and divergence of Heme oxygenase 2 genes in blunt snout bream (Megalobrama amblycephala) and their responses to hypoxia [J]. Gene, 2017(610): 133-139.
[17] 杜尚可, 沈睿杰, 陈杰, 等. 团头鲂MSTN基因cDNA结构、表达及过表达对胚胎发育的影响 [J]. 水生生物学报, 2017, 41(3): 573-580. Du S K, Shen R J, Chen J, et al. Molecular structure and expression of myostatin in Megalobrama amblycephala and its overexpression effects in embryo [J]. Acta Hydrobiologica Sinica, 2017, 41(3): 573-580. [
[18] 李杰, 许国绿, 沈和定, 等. 石磺钙调蛋白Os-IP3R和Os-RyR基因的克隆、相对表达量及进化关系 [J]. 水产学报, 2018, 42(12): 3-14. Li J, Xu G L, Shen H D, et al. Clone and relative expression of Os-IP3R and Os-RyR to discuss the evolutionary relationship in Onchidiidae [J]. Journal of Fisheries of China, 2018, 42(12): 3-14. [
[19] Tamura K, Stecher G, Peterson D, et al. MEGA6: Molecular evolutionary genetics analysis version 6.0 [J]. Molecular Biology and Evolution, 2013, 30(12): 2725-2729. doi: 10.1093/molbev/mst197
[20] Jiang X Y, Du X D, Tian Y M, et al. Goldfish transposase Tgf2 presumably from recent horizontal transfer is active [J]. The FASEB Journal, 2012, 26(7): 2743-2752. doi: 10.1096/fj.11-199273
[21] 濮剑威, 孙成飞, 蒋霞云, 等. 草鱼两个肌肉生长抑制素cDNA克隆、表达及过量表达对胚胎发育的影响 [J]. 生物技术通报, 2011(8): 153-160. Pu J W, Sun C F, Jiang X Y, et al. Two cDNAs Cloning, expression and overexpression in embryo of myostatin from grass carp (Ctenopharyngodon idellus) [J]. Biotechnology Bulletin, 2011(8): 153-160. [
[22] 葛亮. TET在斑马鱼早期造血发育中的功能研究 [D]. 杭州: 浙江大学, 2014: 50-89 Ge L. Functional study of TET1 in early hematopoietic development of zebrafish [D]. Hangzhou: Zhejiang University, 2014: 50-89
[23] Ito S, D'Alessio A C, Taranova O V, et al. Role of Tet proteins in 5mC to 5hmC conversion, ES-cell self-renewal and inner cell mass specification [J]. Nature, 2010, 466(7310): 1129-1133. doi: 10.1038/nature09303
[24] Wu H, D'Alessio A C, Ito S, et al. Dual functions of Tet1 in transcriptional regulation in mouse embryonic stem cells [J]. Nature, 2011, 473(7347): 389-393. doi: 10.1038/nature09934
[25] Kriaucionis S, Heintz N. The nuclear DNA base 5-hydroxymethylcytosine is present in Purkinje neurons and the brain [J]. Science, 2009, 324(5929): 929-930. doi: 10.1126/science.1169786
[26] Zhang R R, Cui Q Y, Murai K, et al. Tet1 regulates adult hippocampal neurogenesis and cognition [J]. Cell Stem Cell, 2013, 13(2): 237-245. doi: 10.1016/j.stem.2013.05.006
[27] Dzitoyeva S, Chen H, Manev H. Effect of aging on 5-hydroxymethylcytosine in brain mitochondria [J]. Neurobiology Aging, 2012, 33(12): 2881-2891. doi: 10.1016/j.neurobiolaging.2012.02.006
[28] Meer D L M V D, Witte F, Bakker M A G D, et al. Gene expression profiling of the long-term adaptive response to hypoxia in the gills of adult zebrafish [J]. The American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2005, 289(5): R1512-R1519. doi: 10.1152/ajpregu.00089.2005
[29] Nikinmaa M, Rees B B. Oxygen-dependent gene expression in fishes [J]. The American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2005, 288(5): R1079-R1090. doi: 10.1152/ajpregu.00626.2004
[30] Terova G, Rimoldi S, Corà S, et al. Acute and chronic hypoxia affects HIF-1α mRNA levels in sea bass (Dicentrarchus labrax) [J]. Aquaculture, 2008, 279(1): 150-159.
-
期刊类型引用(1)
1. 张阿鑫,陈康,王伟峰,刘红,王焕岭. 团头鲂foxO基因家族的序列特征及表达分析. 水生生物学报. 2022(11): 1684-1693 .  本站查看
本站查看
其他类型引用(2)



 下载:
下载: