SCREEN OF DISINFECTANT AGAINST VIBRIO PARAHAEMOLYTICUS AND THE APPLICABLE EVALUATION OF PHMG IN PREVENTING LITOPENAEUS VANNAMEI AHPNS
-
摘要: 为寻找凡纳滨对虾急性肝胰腺坏死综合症(AHPNS)重要致病菌——副溶血弧菌的高效低毒消毒剂, 选取了包括苯扎溴铵、聚六亚甲基胍盐酸盐(PHMG)等22种水产或医学上常用的消毒剂, 比较分析其对副溶血弧菌的杀灭效果。悬液定量杀菌试验发现, 22种消毒剂中PHMG对副溶血弧菌的杀灭效果最好。接着, 进一步分析PHMG的有效杀菌浓度, 结果显示, PHMG浓度达到0.2 mg/L时作用48h即能100%地杀死副溶血弧菌。对7种常见病原菌和凝结芽孢杆菌的杀灭试验显示, PHMG对弧菌的杀灭效果最好, 0.5 mg/L PHMG能100%地杀灭四种弧菌, 对迟钝爱德华菌、嗜水气单胞菌和海豚链球菌的杀灭效果较差, 对凝结芽孢杆菌的杀灭效果最差。急性毒性试验得出PHMG 24h的LC50=80.28 mg/L; 48h的LC50=23.32 mg/L, 安全浓度SC=0.59 mg/L。对攻毒副溶血弧菌凡纳滨对虾的保护试验显示, PHMG浓度达到0.5 mg/L时, 24h对对虾的相对保护率达(77.78±5.01)%左右, 且与三个高浓度组相对保护率差异不显著。随着PHMG浓度的升高, 凡纳滨对虾肝胰腺所含副溶血弧菌数量明显减少, 48h后1.1及1.4 mg/L组副溶血弧菌数量降为0。降解试验结果显示: 0.5 mg/L的PHMG在第5、第6天浓度有所下降, 1 mg/L的PHMG在试验7d中基本保持稳定。研究证明了PHMG具有高效、低毒、低降解的特性, 是防治凡纳滨对虾AHPNS的理想消毒剂。Abstract: To find a highly effective and low-toxic disinfectant on Vibrio parahaemolyticus, twenty-two kinds of disinfectants including commonly used benzalkonium bromide and polyhexamethylene guanidine hydrochloride (PHMG) in the field of aquaculture and medicine were used for evaluating the killing ability on Vibrio parahaemolyticus. The results showed that the germicidal efficacy of PHMG had the best germicidal efficacy among 22 disinfectants against V. parahaemolyticus. The results indicated that 100% of V. parahaemolyticus was killed when the PHMG concentration reached 0.2 mg/L. The killing effects for 7 common pathogens and 1 probiotic (Bacillus coagulans) indicated that PHMG had high efficacy in killing Vibrio, modest ability in killing Streptococcus iniae etc., and the worst killing efficacy on B. coagulans. The acute toxicity test showed that the LC50 of PHMG was 80.28 mg/L at 24h and 23.32 mg/L at 48h, and the safety concentration (SC) was 0.59 mg/L. The protective test of PHMG for L. vannamei infected by V. parahaemolyticus showed that the survival rate of L. vannamei was (77.78±5.01)% when the PHMG reached 0.5 mg/L, and there was no significant difference with the other three high-density groups. With the increase of PHMG concentration, the number of V. parahaemolyticus in hepatopancreas decreased significantly, and the number of V. parahaemolyticus in 1.1 mg/L and 1.4 mg/L groups decreased to 0 after 48h. The results of the PHMG degradation test showed that 0.5 mg/L PHMG slightly decreased on the 5th and 6th days, and 1 mg/L PHMG was generally stable during the experiment of the 7d. This study demonstrated that PHMG has the characteristics of high efficiency, low toxicity and low degradation, and is an ideal disinfectant for preventing L. vannamei AHPNS infected by V. parahaemolyticus.
-
Keywords:
- PHMG /
- Vibrio parahaemolyticus /
- Litopenaeus vannamei /
- Acute toxicity /
- Degradation
-
凡纳滨对虾(Litopenaeus vannamei) 具有含肉率高、生长快、抗逆性强、耐低盐度和高密度养殖等优点, 成为世界对虾养殖的三大品种之一[1]。但因其免疫系统以天然免疫为主, 缺乏特异性免疫[2], 自2009年以来, 凡纳滨对虾急性肝胰腺坏死综合症(Acute Hepatopancreas Necrosis Syndrome, AHPNS)在中国、泰国、越南、印度尼西亚、印度和墨西哥等地对虾养殖场中爆发并蔓延[3, 4], 造成养殖对虾大量死亡, 对全球对虾养殖产业造成严重损失[5, 6]。该病主要的病理特征是肝胰腺坏死, 症状表现为昏睡、厌食、生长缓慢、颜色苍白、软壳等[7], 据研究其主要致病菌为副溶血弧菌(Vibrio parahaemolyticus)[8, 9]。
副溶血弧菌是一种革兰氏阴性嗜盐菌, 通过分泌溶血素使多种海水养殖鱼类、甲壳类发生疾病[10], 能引起对虾体表溃疡和出血性败血等症状[11, 12], 具有使对虾死亡速度快、传播广泛等特点。该致病菌也可导致人类食物中毒或肠胃炎, 主要由于人食用了未煮熟的海产品或污染的腌渍食物而感染发病[13]。
在水产养殖中常用的消毒剂主要有卤素类、季铵盐类和醛类等, 主要应用于清塘消毒、苗种消毒、预防和控制养殖过程中的微生物病害等[14]。有研究者分别用三氯异氰脲酸、苯扎溴铵[15]、季铵盐[16]、聚维酮碘[17]等消毒剂杀灭对虾养殖池中的副溶血弧菌, 但效果不甚理想, 因此急需找到能高效杀灭该病原菌的消毒剂。本文选取了22种常见消毒剂进行试验, 以期筛选出一种杀灭副溶血弧菌的高效低毒消毒剂, 并对该药物的安全性进行分析, 以及确定该药物对人工感染副溶血弧菌并有发病症状的凡纳滨对虾的治疗效果, 为AHPNS的防治提供有效的方法和途径。
1. 材料与方法
1.1 试验动物与养殖
试验凡纳滨对虾: 体长9.30—11.70 cm, 养殖在40 L的聚氯乙烯塑料桶中, 养殖密度为0.5只/L, 养殖用水经二氧化氯消毒、曝气处理后使用, 水体pH8.0, 盐度6.3, 水温(25±2)℃。
1.2 菌悬液的制备
所用菌种为副溶血弧菌(20130629002S01), 由中国水产科学研究院黄海水产研究所黄倢教授惠赠, 其他为本试验室保存的菌种。取少许菌种滴入5—10 mL TCBS培养基中, 置37℃振荡培养18—24h后离心弃上清液, 加入无菌生理盐水振荡重悬成菌悬液。细菌浓度比浊测定法测菌悬液浓度, 然后稀释至所需浓度, 4℃冰箱保存备用。
1.3 悬液定量杀菌试验
采用悬液定量杀菌试验[18]研究不同消毒剂对副溶血弧菌的杀灭效果。将4 mL消毒液(待测浓度的1.25倍)与1 mL副溶血弧菌菌悬液(浓度为1×106 cfu/mL)混匀后立即计时。对照组加入等量的生理盐水, 每组设3个重复。室温下反应1h后, 吸取0.10 mL混合液接种到培养基上, 37℃恒温培养箱培养48h进行活菌计数, 计算活菌浓度(cfu/mL), 并换算为对数值(N), 然后按下式计算杀灭对数值: 杀灭对数值(KL)=对照组平均活菌浓度的对数值(No)−实验组活菌浓度对数值(Nx)。试验重复3次。
1.4 PHMG的急性毒性试验
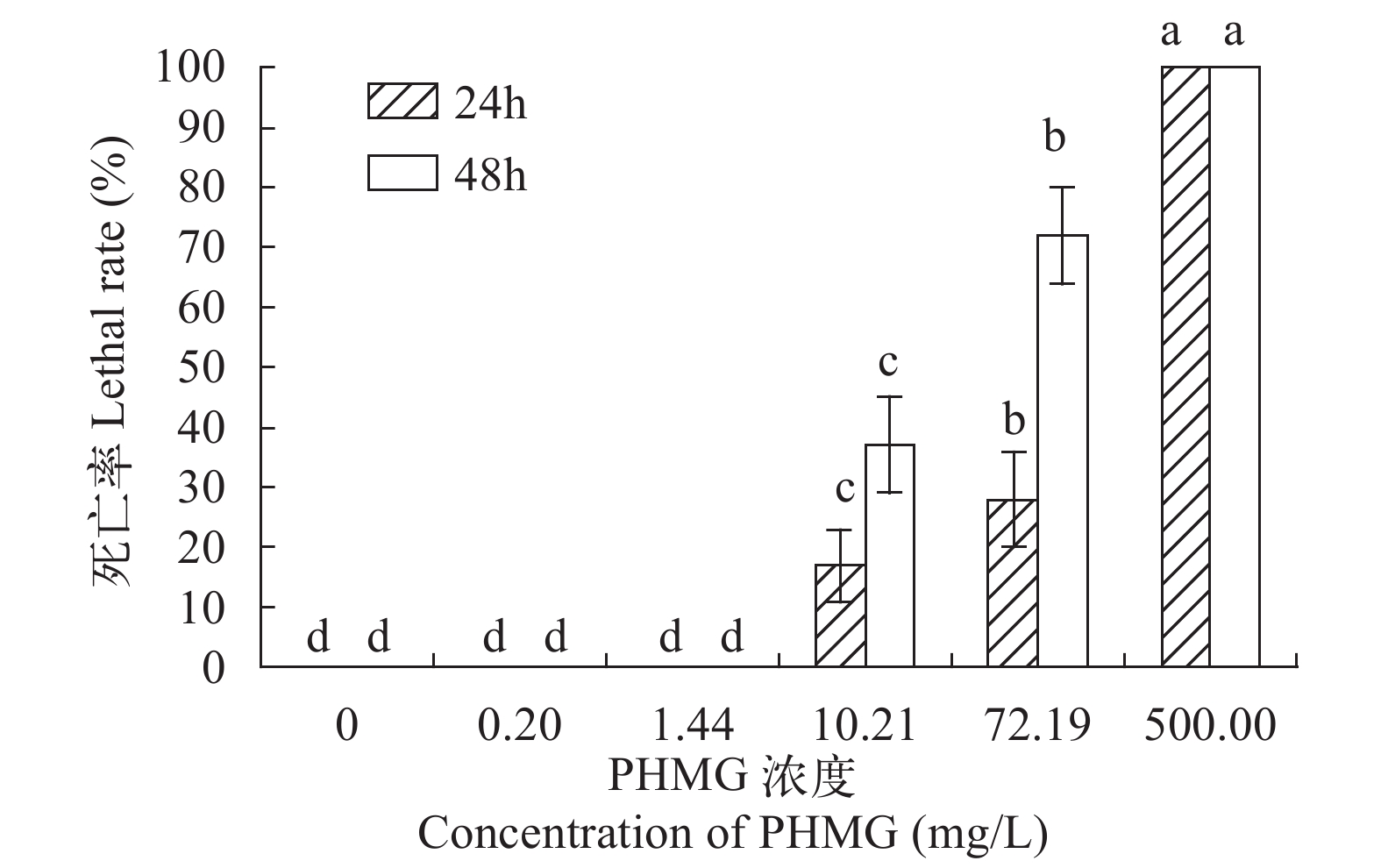
采用静水法药浴方式测定PHMG对凡纳滨对虾的半致死浓度和安全浓度。PHMG浓度按照等对数间距法设置, 共设置5个梯度, 对数值从0.70—2.70进行5等分, 间隔为0.85, 分别是0.70、0.15、1.00、1.85、2.70, 以10为底进行指数取值, 则对应的浓度梯度分别为: 0.20、1.44、10.21、72.19和500.00 mg/L, 对照组为0, 每组设3个重复。观察记录24h和48h死亡数并计算死亡率, 采用karber法计算半数致死浓度(LC50), 根据半致死浓度计算安全浓度(SC):
$SC = \frac{{48L{C_{50}} \times 0.3}}{{{{(24L{C_{50}}/48L{C_{50}})}^2}}} $
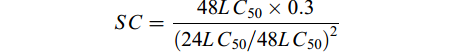
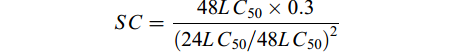
1.5 PHMG对攻毒副溶血弧菌凡纳滨对虾的保护作用
This page contains the following errors:
error on line 1 at column 1: Start tag expected, '<' not foundBelow is a rendering of the page up to the first error.
计算在水体中加入上述5个浓度梯度PHMG 24h和48h后凡纳滨对虾肝胰腺的弧菌数量。每组随机解剖10只对虾, 并剥离肝胰腺组织于灭菌研磨管中, 研磨成均匀混合液。用1.5%的灭菌生理盐水按1﹕1、1﹕10、1﹕100和1﹕1000四个稀释度进行稀释, 每个浓度取100 μL混合液涂于TCBS培养基上, 每个浓度设3个重复, 28℃倒置培养24—48h, 计数, 取平均值, 计算出每mL肝胰腺中的弧菌数量。
1.6 PHMG在水中的降解速率测定
PHMG的测定采用光电比色法[19], 首先绘制标准曲线: 配制不同浓度的PHMG溶液: 0、0.20、0.50、1.00、2.00和4.00 mg/L, 在535 nm波长处测定其吸光度值, 以PHMG含量与其对应的吸光值作图, 得出标准曲线, 建立回归方程。配制0.50和1.00 mg/L PHMG溶液, 在第0至第7天时, 每天取10 mL水样测定PHMG在水体中的浓度。
2. 结果
2.1 不同种类消毒剂对副溶血弧菌的杀灭能力研究
比较了22种消毒剂对副溶血弧菌的杀灭能力, 结果表明, 在22种消毒剂中, 杀灭效果最好的为聚六亚甲基胍盐酸盐(PHMG), 0.50 mg/L的PHMG作用48h, 杀灭对数值达到了6.00±0.89, 能100%杀灭受试的副溶血弧菌。其次为碘溴海因, 杀灭对数值为5.60±0.73。季铵盐类消毒剂中的双链季铵盐络合碘的杀灭效果也较好, 杀灭对数值达到5.52±0.58。杀灭能力最差的是醛类和醇类消毒剂, 杀灭对数值仅为1.00(表 1)。
表 1 不同消毒剂对副溶血弧菌的杀灭能力Table 1. The killing ability of different disinfectants to Vibrio parahaemolyticus消毒剂种类
Disinfectant type杀灭对数值
KL消毒剂种类
Disinfectant type杀灭对数值
KL苯扎溴铵Benzalkonium bromide 5.05±0.23 碘三氧Iodine trioxide 1.00±0.27 苯扎氯铵Benzalkonium chloride 3.83±0.12 四羟甲基硫酸磷Tetrahydroxymethyl sulfate 1.00±0.23 甲醛Formaldehyde 1.00±0.21 二氧化氯Chlorine dioxide 3.96±0.35 过氧乙酸Peracetic acid 3.96±0.43 二氯异氰尿酸钠Sodium dichloroisocyanurate 4.05±0.28 戊二醛Glutaraldehyde 1.00±0.19 三氯异氰脲酸Trichloroisocyanuric acid 4.61±0.19 双链季铵盐类络合碘Double-chain quaternary ammonium salts complex iodine 5.52±0.58 碘溴海因Iodine bromo hydantoin 5.60±0.73 溴硝醇Bromonite 1.00±0.29 溴氯海因Bromo chloro hydantoin 5.24±0.68 聚六亚甲基胍盐酸盐Polyhexamethylene guanidine hydrochloride 6.00±0.89 二溴海因Dibromo hydantoin 4.59±0.97 醋酸氯己定Chlorhexidine acetate 3.52±0.67 聚维酮碘Povidone iodine 3.78±0.38 异噻唑啉酮Isothiazolinone 1.00±0.34 过硫酸氢钾Potassium persulfate 1.00±0.23 过氧化氢Hydrogen peroxide 3.72±0.59 苯甲酸Benzoic acid 1.00±0.17 2.2 不同浓度PHMG对副溶血弧菌的杀灭效果研究
为了进一步研究PHMG对副溶血弧菌的杀灭能力, 本文比较了0.10—0.50 mg/L的PHMG对副溶血弧菌的杀灭效果。结果显示(表 2), 浓度为0.10 mg/L时对副溶血弧菌杀灭效果较差, 浓度为0.15 mg/L时能杀死一定数量的副溶血弧菌, 当浓度达到0.20 mg/L时就能100%杀死副溶血弧菌(杀灭对数值为6.00±0.58), 与0.50 mg/L组的杀灭效果没有差异。
表 2 不同浓度的PHMG对副溶血弧菌的杀灭效果Table 2. Killing effect of different concentrations of PHMG on Vibrio parahaemolyticus浓度Concentration (mg/L) 杀灭对数值KL 0.10 1.26±0.41 0.15 2.67±0.25 0.2 6.00±0.58 0.5 6.00±0.79 2.3 不同浓度PHMG对7种常见病原菌和1种芽孢杆菌的杀灭能力研究
为检测PHMG的广谱杀菌能力, 本文研究了PHMG作用48h对7种常见病原菌和1种益生菌(凝结芽孢杆菌)的杀灭能力。结果如表 3所示, PHMG对弧菌的杀灭作用非常强, 0.20 mg/L PHMG就能100%地杀灭副溶血弧菌和溶藻弧菌, 对其他两种弧菌的杀灭效果也较强(48h的杀灭对数值分别是4.37±0.91和5.32±0.25); 0.50 mg/L PHMG能100%地杀灭这四种弧菌, 显示了PHMG对弧菌具有较好的杀灭效果。PHMG对迟钝爱德华菌、嗜水气单胞菌和海豚链球菌的杀灭效果较差, 0.20和0.50 mg/L的PHMG都不能完全将其杀死, 1.00和2.00 mg/L的PHMG能100%地杀死迟钝爱德华菌和嗜水气单胞菌, 但仍然无法完全将海豚链球菌杀死。PHMG对凝结芽孢杆菌的杀灭效果最差, 这可能与凝结芽孢杆菌能形成芽孢, 抗逆能力较强有关。总体而言, PHMG不仅能杀灭对虾急性肝胰腺坏死症的主要病原之一: 副溶血弧菌, 也能防止其他致病菌特别是弧菌的感染, 从而预防其他疾病的发生。
表 3 不同浓度PHMG对不同病原菌和一种益生菌的杀灭能力Table 3. The killing ability of different concentrations of PHMG against different pathogenic bacteria and one kind of probioticsPHMG浓度
PHMG
concentration
(mg/L)副溶血弧菌G−
Vibrio
parahaemolyticus
G−需钠弧菌G−
Vibrio
natriegens G−溶藻弧菌G−
Vibrio
alginolyticus G−哈维氏弧菌G−
Vibrio
harveyi G迟钝爱德
华菌G−
Edwardsiella
tarda G−嗜水气单
胞菌G−
Aeromonas
hydrophila G−海豚链球菌
G+Streptococcus
iniae G+凝结芽孢杆菌
G+Bacillus
coagulans G+0.20 6.00±0.23 4.37±0.91 6.00±1.02 5.32±0.25 3.26±0.25 0.83±0.11 2.30±0.11 0.36±0.32 0.50 6.00±0.48 6.00±0.26 6.00±0.98 6.00±0.63 3.10±0.17 3.36±0.67 4.27±0.43 1.84±0.15 1.00 6.00±0.49 6.00±0.58 6.00±0.65 6.00±0.22 6.00±0.38 6.00±0.57 3.80±0.92 2.20±0.14 2.00 6.00±0.75 6.00±0.79 6.00±0.47 6.00±0.49 6.00±0.84 6.00±0.86 4.52±0.55 2.89±0.33 2.4 PHMG对凡纳滨对虾的急性毒性
为测试PHMG对凡纳滨对虾的安全性程度, 进行了PHMG对凡纳滨对虾的急性毒性试验。结果显示, 当PHMG的浓度低于1.44 mg/L时, 48h内无死亡现象; 当PHMG浓度达到10.21 mg/L时, 24h死亡率为(16.65±0.06)%, 48h的死亡率为(36.65±0.08)%; 浓度为72.19 mg/L时, 24h的死亡率为(28.35±0.08)%, 48h的死亡率为(71.65±0.08)%; 当浓度为500.00 mg/L时, 24h之内对虾全部死亡(图 1)。根据24h和48h的死亡率数据, 计算得出PHMG 24h的LC50=80.28 mg/L; 48h的LC50=23.32 mg/L, 安全浓度SC=0.59 mg/L。
2.5 PHMG对攻毒副溶血弧菌凡纳滨对虾的保护作用
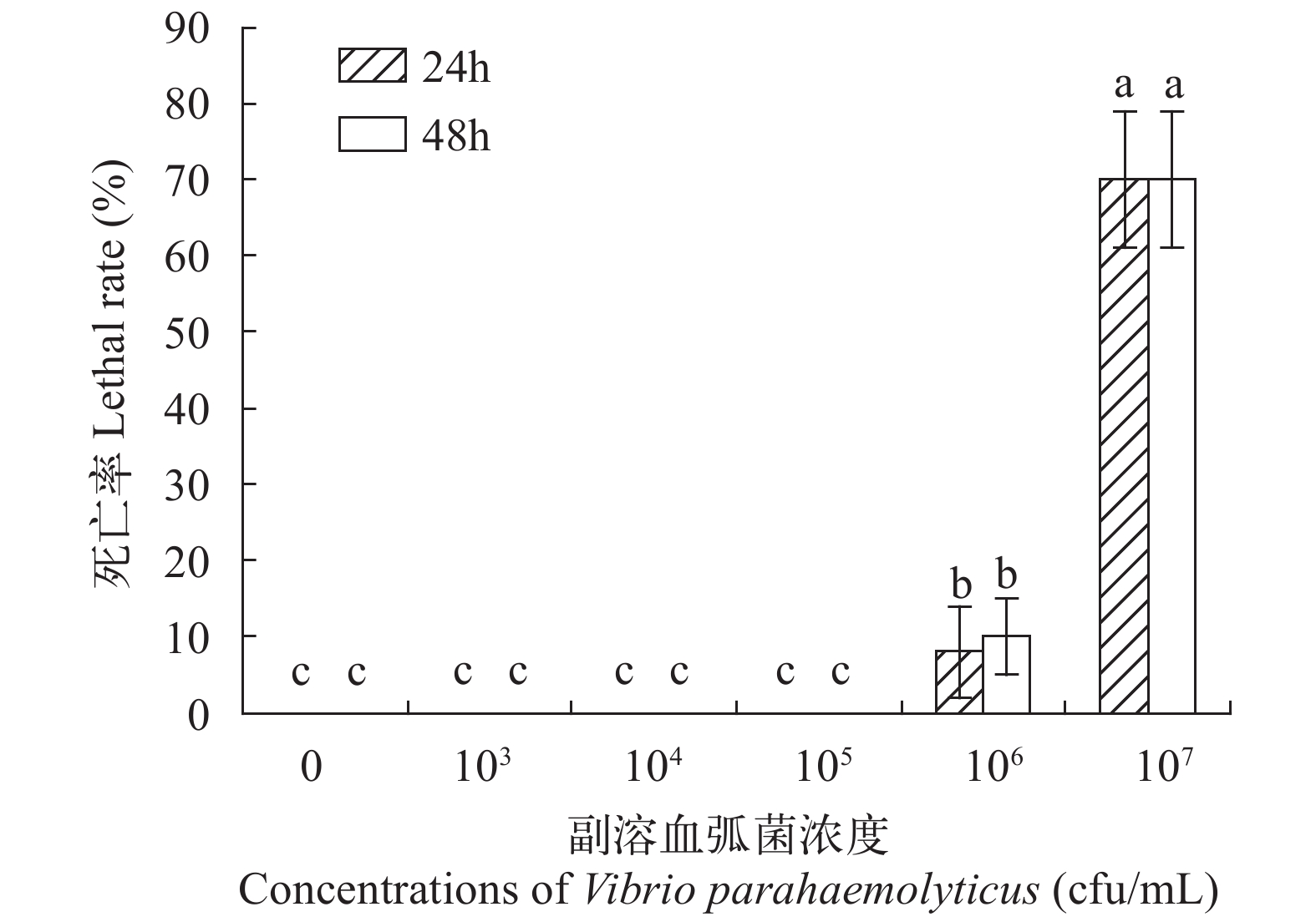
不同浓度的副溶血弧菌攻毒凡纳滨对虾后, 试验结果显示, 副溶血弧菌菌悬液浓度在1×107 cfu/mL时, 48h内可以使对虾死亡数量达到(70±1.73)%以上(图 2), 因此选择1×107 cfu/mL作为治疗试验中PHMG的侵染浓度。
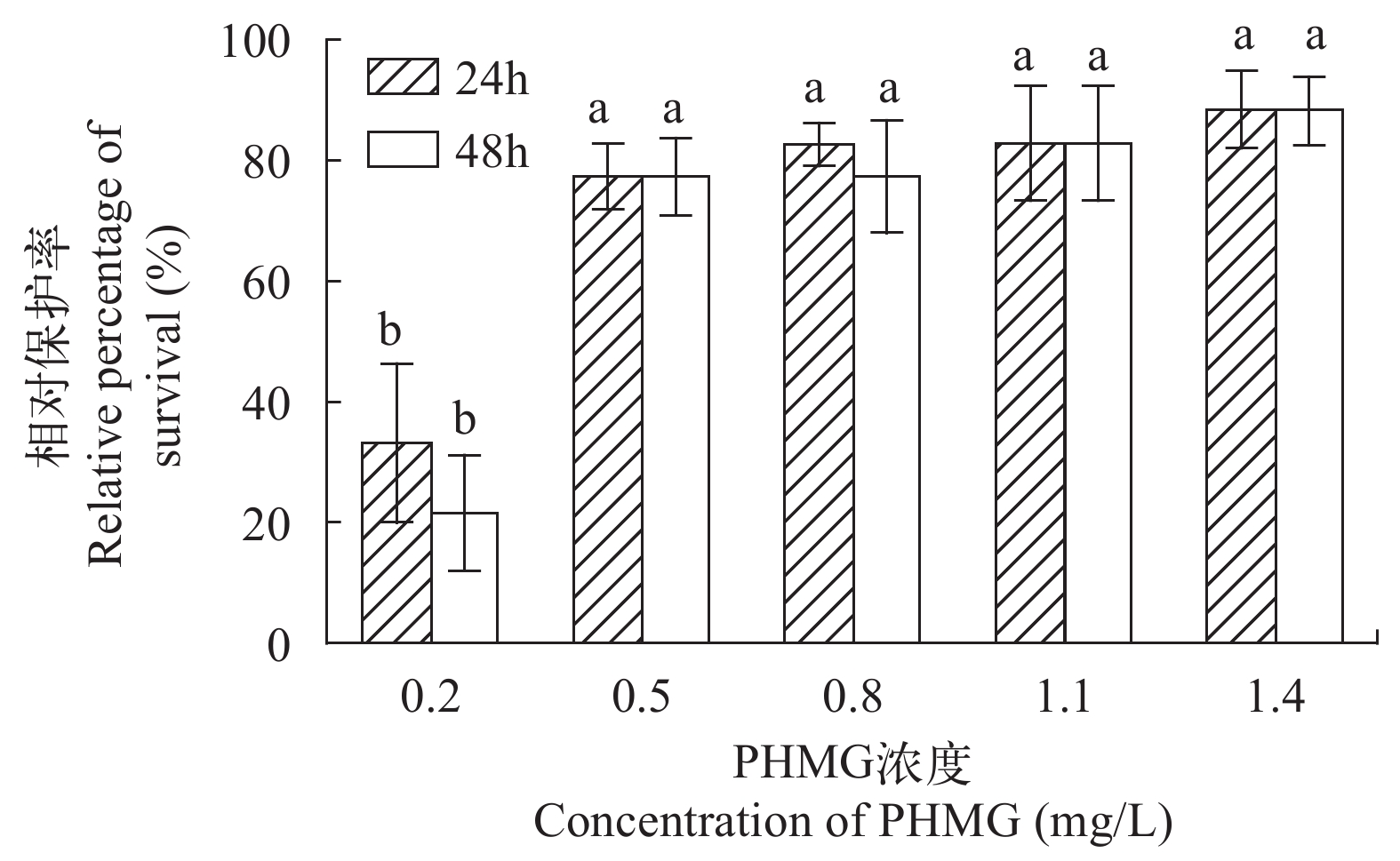
在对虾第四步足处注射10 μL 1×107 cfu/mL的副溶血弧菌菌悬液, 然后向水中分别加入PHMG, 使其在水中浓度达到0.2、0.5、0.8、1.1和1.4 mg/L。试验结果显示, PHMG浓度在0.2 mg/L时, 对被副溶血弧菌感染的病虾有明显的保护效果, 对虾相对保护率达到(33.33±13.00)%(24h)和(22.22±9.11)%(48h)左右; 浓度达到0.5 mg/L时, 24h及48h对对虾的相对保护率达(77.78±5.01)%、(77.78±5.89)%, 且与0.8 mg/L组24h(83.33±2.90)%及48h(77.78±9.17)%、1.1 mg/L组24h(83.33±8.99)%及48h(83.33±9.07)%、1.4 mg/L组24h(88.89±6.07)% 及48h(88.89±5.14)%组相对保护率没有显著差异(图 3)。
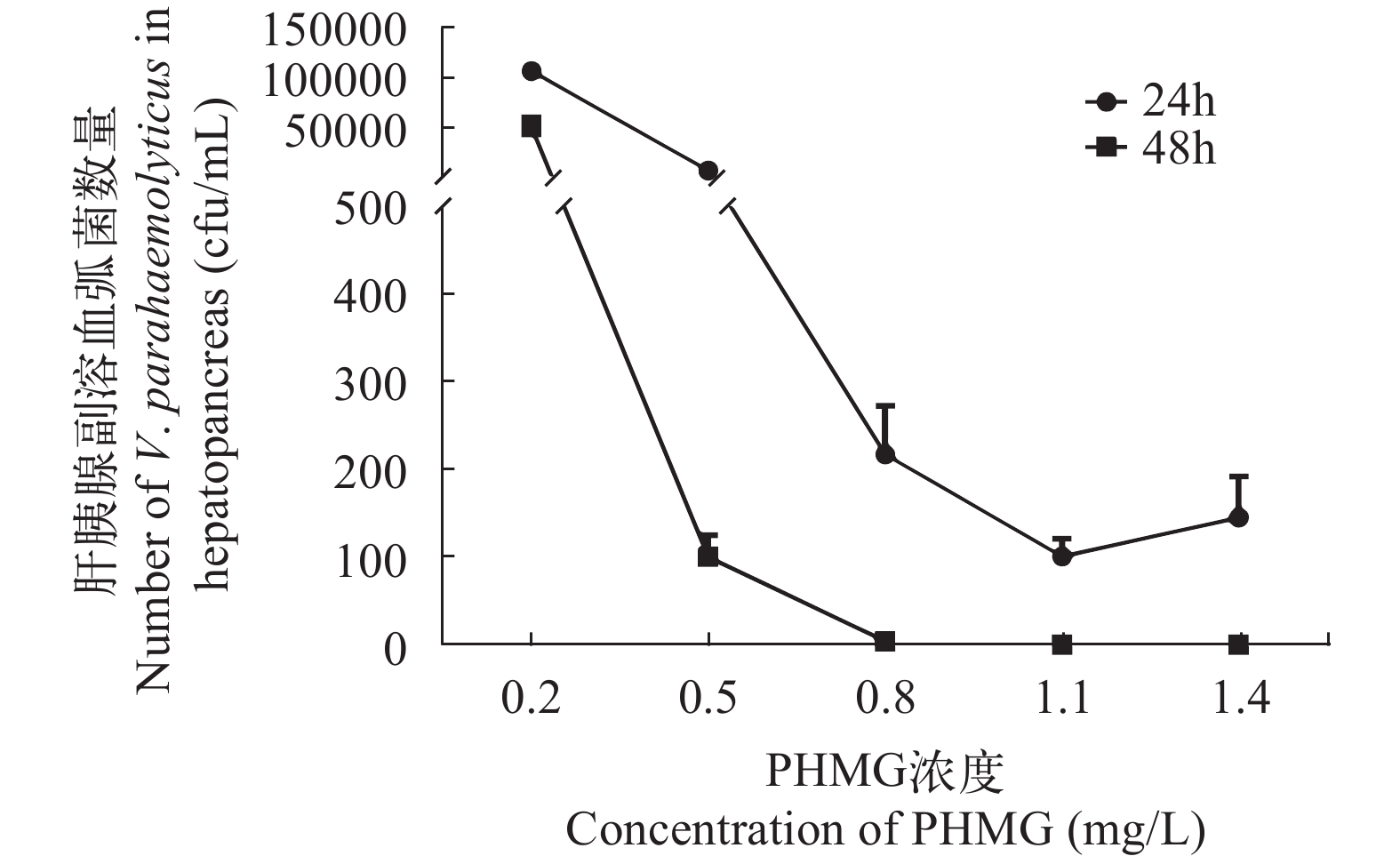
为了解PHMG对攻毒副溶血弧菌凡纳滨对虾的保护作用, 除计算上述相对保护率外, 还计算了水体中加入不同浓度梯度PHMG 24h和48h后凡纳滨对虾肝胰腺的副溶血弧菌数量。结果显示(图 4), 随着PHMG浓度的升高, 凡纳滨对虾肝胰腺所含副溶血弧菌数量明显减少, 48h后1.1 mg/L组及1.4 mg/L组肝胰腺内菌数量降为0。
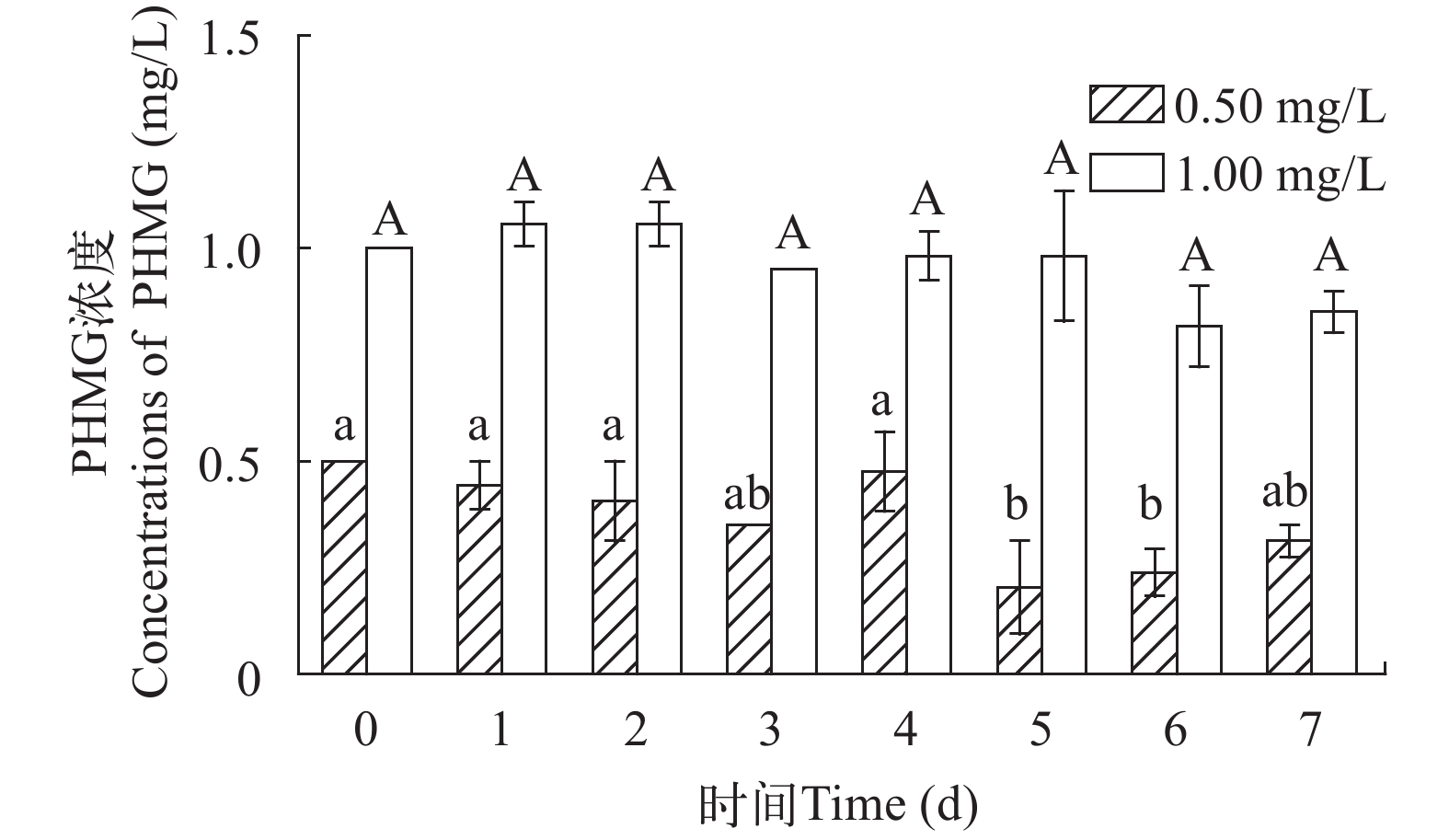
2.6 不同浓度PHMG在水体中的降解试验
第0至第7天, 每天测定PHMG在水体中的剩余浓度, 结果显示: 0.50 mg/L的PHMG组, 前4d都没有显著变化, 在第5和第6天浓度显著下降。1.00 mg/L的PHMG组, 在试验的7d中比较稳定, 浓度在(0.73±0.05)—(1.02±0.04) mg/L, 在后期虽略有下降, 但差异不显著(图 5), 这说明PHMG能在水体中长时间地存在, 具有性能稳定、低降解的优点。
3. 讨论
3.1 不同消毒剂对弧菌的杀灭效果
弧菌是一类革兰氏阴性、具极生鞭毛、能运动、无芽孢的短杆状细菌, 由弧菌引起的弧菌病在全球范围内广泛发生, 其爆发性流行给海水养殖鱼类、贝类及甲壳类等经济动物的养殖业造成巨大的经济损失[20], 副溶血弧菌导致凡纳滨对虾急性肝胰腺坏死症就是其中一个典型的例子。本试验结果显示, 不同种类的消毒剂对副溶血弧菌这一特定目标细菌的杀灭效果差异较大, 杀灭效果较低的主要有醛类、过氧化物类等。这与前人的各种消毒剂对弧菌杀灭效果的研究结果基本一致, 如研究发现戊二醛对创伤弧菌的最小抑菌浓度(MIC)为310 mg/L、最小杀菌浓度(MBC)为10000 mg/L[21]; 过氧乙酸对创伤弧菌的MIC为40 mg/L、MBC为310 mg/L, 对溶藻弧菌和副溶血弧菌的MIC均为32 mg/L, 对溶藻弧菌的MBC为64 mg/L, 对副溶血弧菌的MBC为128 mg/L[22]; 用200 mg/L过氧乙酸作用5min才能完全杀灭海水中的副溶血弧菌[23]。溴氯海因类对溶藻弧菌的 MIC、MBC均为2.32 mg/L[24]。这些结果都说明多数消毒剂对弧菌的杀灭效果较差。
本试验发现22种消毒剂中PHMG杀灭副溶血弧菌的效果最好, 其次是双链季铵盐络合碘, 杀灭对数值达到5.52±0.58。张玮等[25]用体外抑菌试验也发现PHMG对副溶血弧菌、溶藻弧菌、漂浮弧菌、哈维弧菌、鳗弧菌及沙蚕弧菌的杀灭能力较强, MIC和MBC分别为1.5和3.0 mg/L。PHMG溶于水后胍基带正电荷, 可以强烈且迅速地被细菌细胞表面带负电荷的含磷酸复合物吸附, 并进入细胞内部, 与细胞内的蛋白质和核酸发生作用, 使细胞分裂阻滞并产生染色体凝集反应, 从而杀灭细菌[26-29]。而季铵盐类属于阳离子表面活性剂类消毒剂, 其杀菌机理也是水解产物带有正电荷, 易于吸附在带有负电荷的细菌表面, 堵塞细菌的呼吸通道, 或者使细菌细胞膜发生破裂, 细胞内容物流出[30]。双链季铵盐络合碘不仅能较好的与细胞膜结合, 且含有高效杀灭细菌的络合碘, 能进一步增强其杀菌能力。这可能是PHMG和双链季铵盐络合碘杀灭副溶血弧菌能力比较强的原因。
3.2 PHMG对不同菌种杀灭能力差异
本研究中我们发现, 相同浓度PHMG对G–菌和G+菌的杀灭能力存在差异, 在1.00 mg/L时对四种弧菌和迟钝爱德华菌、嗜水气单胞菌等六种G–菌的杀灭率达到100%, 而对两种G+菌海豚链球菌和凝结芽孢杆菌的杀灭效果较差, 杀灭对数值仅为: 3.80±0.92和2.20±0.14。这种差异的存在可能与PHMG杀菌机理及细菌的细胞壁结构有关。首先, 根据杀菌机理, PHMG溶于水后胍基带正电荷, 可以强烈且迅速地被细菌细胞表面带负电荷的含磷酸复合物吸附, 并进入细胞内部, 与细胞内的蛋白质和核酸发生作用, 使细胞分裂阻滞并产生染色体凝集反应, 从而杀灭细菌[26-29]。因此, PHMG对表面带负电荷的G–菌的杀灭能力优于对G+菌杀灭能力。其次, G+菌和G–菌细胞壁结构有差异, 细菌细胞壁是细胞质膜外具有一定硬度和韧性的壁套, 主要由肽聚糖构成, 细胞壁的保护作用体现为细胞壁固定细胞外形和提高机械强度, 从而使其免受渗透压等外力的损伤。在化学组成上G+菌的细胞壁90%为肽聚糖, 可多达50层, G–菌则只含有1—2层[31], 因此估计这也是G+菌抗PHMG攻击能力更强些的原因之一。
在浓度较低时, PHMG对同是G–菌的六种细菌杀灭能力也存在差异, 0.50 mg/L PHMG对四种弧菌的杀灭率达到100%, 而对其他两种G–菌迟钝爱德华菌和嗜水气单胞菌杀灭能力较弱, 杀灭对数值仅为: 3.10±0.17和3.36±0.67。这是由于迟钝爱德华菌和嗜水气单胞菌皆可在浮游动物、甲壳动物及水草上形成生物被膜[32]。生物被膜是一种高度有组织的不均质性结构, 由同一种菌或不同种菌形成的三维结构, 基质包绕微菌落呈“蘑菇状”, 是细菌抵抗外界不良环境的一种自我保护形式, 对周围环境有较强的适应能力。在生物被膜状态下的微生物对消毒剂和抗生素都有很强的抗性, 消毒剂很难将其彻底杀灭[33]。
在任何浓度时, PHMG对益生菌凝结芽孢杆菌杀灭能力最差, 这可能是由于芽孢杆菌具有形成芽孢的特殊能力, 能够抵抗某些极端恶劣情况。这种现象表明该消毒剂对益生菌中的芽孢类是友好型的, 在对副溶血弧菌最小杀菌浓度下, 可以最可能的减少对益生菌的损伤。
3.3 PHMG的急性毒性和防治AHPNS研究
生产实践中, 消毒剂的安全性也是需要考虑的重要因素之一, 不同消毒剂对对虾的毒性大小不同。本研究发现PHMG对凡纳滨对虾24h的LC50=80.28 mg/L、48h的LC50=23.32 mg/L, 安全浓度SC=0.59 mg/L, 这与前人的研究结果基本一致[25]。张萍等[34]研究显示, PVP-碘对南美白对虾无节幼体的24h和40h半致死浓度分别为8.737和6.512 mg/L, 其安全浓度为0.65 mg/L。复方三氯异氰尿酸对短沟对虾和斑节对虾的安全浓度分别为0. 55和0. 53 mg/L[35]。过氧化氢对日本对虾的安全浓度为3.27 mg/L[36]。刘春花等[37]证明新型宝碘对凡纳滨对虾的安全浓度(SC)为8.2 mL/L。由此可见, PHMG对凡纳滨对虾的安全浓度与两种卤素类消毒剂对对虾的安全浓度值大小相似, 比过氧化氢安全浓度要小一些。此外, 张玮等[25]研究了PHMG对大菱鲆和刺参的48h LC50分别为: 179.91和6.67 mg/L, 而鲍在处理后48h未死亡。这说明了PHMG是一种低毒的消毒剂, 在杀灭目标病原菌的浓度范围内, 对水产生物的生存没有显著影响。
由于0.2 mg/L以上的PHMG就能较好地杀死副溶血弧菌, 且PHMG对凡纳滨对虾的安全浓度为0.59 mg/L, 大于其有效杀灭副溶血弧菌的浓度, 因此可以用PHMG用来防治由副溶血弧菌等导致的凡纳滨对虾AHPNS。本文的研究结果显示, 在注射副溶血弧菌菌悬液的同时, 在水体中添加不同浓度的PHMG, PHMG浓度在0.20 mg/L时, 对被副溶血弧菌感染的病虾有明显的治疗效果, 对虾相对保 护率达到(33.33±13.00)%(24h)和(22.22±9.11)% (48h)左右; 浓度达到0.5 mg/L时, 24h和48h对对虾的相对保护率达(77.78±5.01)%和(77.78±5.89)%, 与0.8 mg/L组24h(83.33±2.90)% 和48h(77.78±9.17)、1.1 mg/L组24h(83.33±8.99)%和48h(83.33±9.07)、 1.4 mg/L组24h(88.89±6.07)%和48h(88.89±5.14)组相对保护率没有显著差异。这进一步证明PHMG可以用来防治凡纳滨对虾AHPNS。2009年以来, AHPNS使得亚洲对虾产量大幅下降, 给亚洲养虾业带来了巨大的经济损失, 我国以凡纳滨对虾养殖为主的对虾养殖业亦受到冲击。AHPNS是由细菌感染引起的, 副溶血弧菌是一种重要的致病菌[38]。目前对于AHPNS的致病机制尚未研究清楚, 尚无有效的防治手段[39]。因此, 本研究找到了一种有效防治AHPNS的技术手段, 具有较大的应用价值。
3.4 PHMG在水体中的降解情况
水产养殖中使用的消毒剂不但要求高效、低毒, 而且要求性能稳定、有效成分不易降解, 才能更加高效地杀灭有害菌。消毒剂中的氯制剂在水体中降解速度较快, 李丽等[40]测定发现, 在水体中次氯酸钠的有效氯含量前6h从起始0.35% 急剧降至0.13%; 6—24h的降解速率明显减缓; 24h后, 有效氯含量基本保持在0.04% 左右。二氧化氯在水体中降解速度较快, 并且二氧化氯的降解速度与光照强度、紫外强度有密切关系, 在日光照射下, 120min后水体中的二氧化氯就衰减了83.1%, 而在365 nm紫外光的照射下, 仅经过40min水体中的二氧化氯就已经基本完全降解[41]。张静等[42]研究了戊二醛的降解特性, 结果表明: pH对戊二醛降解的影响较大, pH保持7—8, 20h后戊二醛降解率达90%以上。25℃和30℃时, 20h后戊二醛最终降解率分别为83.42%和83.99%, 并且氮存在时戊二醛的降解率比无氮时高出50%以上, 因此在养殖环境(一般情况氮含量很高)中戊二醛的降解率很高。周书春[43]、熊永忠等[44]研究指出, 溴氯海因在水环境中易发生水解: 在释放出活性Br– 和Cl–后, 自身形成5,5 -二甲基海因, 且很快在自然条件下被光、微生物等降解, 分解为氨和二氧化碳。在25℃自然条件下, 溴氯海因溶于水5d后的降解率即达到88.97%, 7d后低于初始浓度的1%[45]。但也有的消毒剂降解速度较慢, 李亚红等[46]研究了季铵盐的生物降解、光降解和水解特性, 结果证明, 在自然条件下季铵盐在海水中的降解速率较慢, 降解活动主要由光降解贡献, 强化某些反应条件(如紫外光辐照)可以加速季铵盐的降解速率; 其次为生物降解, 但生物降解性较低, 半衰期较长; 虽然有水解发生, 但水解速率极慢, 半衰期长达上百天。本文研究显示, 0.5 mg/L的PHMG组, 前4d都没有显著变化, 在第5和第6天浓度略有下降, 1 mg/L的PHMG组, 降解速度与0.5 mg/L的PHMG组没有显著差异, 由此可见PHMG具有低降解性、高稳定性的特点, 适合在水产养殖中作为消毒剂使用。而且, 通过研究发现假单胞菌可以利用PHMG作为生长氮源, 因此可以认为该消毒剂是一种可以生物降解的环境友好型消毒剂。在自然界中, 通过细菌的作用, 可以防止该消毒剂的长期积累而造成环境污染[47]。
-
表 1 不同消毒剂对副溶血弧菌的杀灭能力
Table 1 The killing ability of different disinfectants to Vibrio parahaemolyticus
消毒剂种类
Disinfectant type杀灭对数值
KL消毒剂种类
Disinfectant type杀灭对数值
KL苯扎溴铵Benzalkonium bromide 5.05±0.23 碘三氧Iodine trioxide 1.00±0.27 苯扎氯铵Benzalkonium chloride 3.83±0.12 四羟甲基硫酸磷Tetrahydroxymethyl sulfate 1.00±0.23 甲醛Formaldehyde 1.00±0.21 二氧化氯Chlorine dioxide 3.96±0.35 过氧乙酸Peracetic acid 3.96±0.43 二氯异氰尿酸钠Sodium dichloroisocyanurate 4.05±0.28 戊二醛Glutaraldehyde 1.00±0.19 三氯异氰脲酸Trichloroisocyanuric acid 4.61±0.19 双链季铵盐类络合碘Double-chain quaternary ammonium salts complex iodine 5.52±0.58 碘溴海因Iodine bromo hydantoin 5.60±0.73 溴硝醇Bromonite 1.00±0.29 溴氯海因Bromo chloro hydantoin 5.24±0.68 聚六亚甲基胍盐酸盐Polyhexamethylene guanidine hydrochloride 6.00±0.89 二溴海因Dibromo hydantoin 4.59±0.97 醋酸氯己定Chlorhexidine acetate 3.52±0.67 聚维酮碘Povidone iodine 3.78±0.38 异噻唑啉酮Isothiazolinone 1.00±0.34 过硫酸氢钾Potassium persulfate 1.00±0.23 过氧化氢Hydrogen peroxide 3.72±0.59 苯甲酸Benzoic acid 1.00±0.17 表 2 不同浓度的PHMG对副溶血弧菌的杀灭效果
Table 2 Killing effect of different concentrations of PHMG on Vibrio parahaemolyticus
浓度Concentration (mg/L) 杀灭对数值KL 0.10 1.26±0.41 0.15 2.67±0.25 0.2 6.00±0.58 0.5 6.00±0.79 表 3 不同浓度PHMG对不同病原菌和一种益生菌的杀灭能力
Table 3 The killing ability of different concentrations of PHMG against different pathogenic bacteria and one kind of probiotics
PHMG浓度
PHMG
concentration
(mg/L)副溶血弧菌G−
Vibrio
parahaemolyticus
G−需钠弧菌G−
Vibrio
natriegens G−溶藻弧菌G−
Vibrio
alginolyticus G−哈维氏弧菌G−
Vibrio
harveyi G迟钝爱德
华菌G−
Edwardsiella
tarda G−嗜水气单
胞菌G−
Aeromonas
hydrophila G−海豚链球菌
G+Streptococcus
iniae G+凝结芽孢杆菌
G+Bacillus
coagulans G+0.20 6.00±0.23 4.37±0.91 6.00±1.02 5.32±0.25 3.26±0.25 0.83±0.11 2.30±0.11 0.36±0.32 0.50 6.00±0.48 6.00±0.26 6.00±0.98 6.00±0.63 3.10±0.17 3.36±0.67 4.27±0.43 1.84±0.15 1.00 6.00±0.49 6.00±0.58 6.00±0.65 6.00±0.22 6.00±0.38 6.00±0.57 3.80±0.92 2.20±0.14 2.00 6.00±0.75 6.00±0.79 6.00±0.47 6.00±0.49 6.00±0.84 6.00±0.86 4.52±0.55 2.89±0.33 -
[1] 迟淑艳, 聂琴, 黄吴文, 等. 凡纳滨对虾饲料中酵母水解物替代鱼粉适宜比例的研究 [J]. 水生生物学报, 2016, 40(4): 728-735. doi: 10.7541/2016.96 Chi S Y, Nie Q, Huang W W, et al. Study on suitable proportion of yeast hydrolyzate replacement of fishmeal in feed of Litopenaeus vannamei [J]. Acta Hydrobiologica Sinica, 2016, 40(4): 728-735. doi: 10.7541/2016.96
[2] 高溳, 金春英, 王蔚. 对虾抗病毒免疫研究现状 [J]. 生命科学, 2011, 23(12): 1296-1299. Gao Y, Jin C Y, Wang W. Advances on antiviral immunity in shrimp [J]. Chinese Bulletin of Life Sciences, 2011, 23(12): 1296-1299.
[3] Flegel T. Historic emergence, impact and current status of shrimp pathogens in Asia [J]. Journal of Invertebrate Pathology, 2012(110): 166-173.
[4] Lea M, Mohan C. Early mortality syndrome threatens Asia’s shrimp farms [J]. Global Aquaculture Advocate, 2012(8): 38-39.
[5] Anderson J, Valderrama D. Production: Global shrimp review --disease drops production, but recovery anticipated [J]. Global Aquaculture Advocate, 2013(12): 12-13.
[6] Bondad-Reantaso G, Subasinghe P, Josupeit H, et al. The role of crustacean fisheries and aquaculture in global food security: past, present and future [J]. Journal of Invertebrate Pathology, 2012, (110): 158-165.
[7] Lomelí O, Martínez F. Phage therapy against Vibrio parahaemolyticus Infection in the whiteleg shrimp (Litopenaeus vannamei) larvae [J]. Aquaculture, 2014(434): 208-211.
[8] Tran L, Nunan L, Redman M, et al. Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp [J]. Diseases of Aquatic Organisms, 2013, (105): 45-55.
[9] Han E, Tang F, Tran H, et al. Photorhabdus insect-related (Pir) toxin-like genes in a plasmid of Vibrio parahaemolyticus, the causative agent of acute hepatopancreatic necrosis disease (AHPND) of shrimp [J]. Diseases of Aquatic Organisms, 2015, 113(1): 33-40. doi: 10.3354/dao02830
[10] 房海, 陈翠珍, 张晓君. 水产养殖动物病原细菌学 [M]. 北京: 中国农业出版社, 2010: 132 Fang H, Chen C Z, Zhang X J. Aquacultural Animal Pathogenic Bacteriology [M]. Beijing: China Agriculture Press, 2010: 132
[11] 张晓君, 陈翠珍, 阎斌伦, 等. 凡纳滨对虾(Litopenaeus vannamei)病原副溶血弧菌(Vibrio parahaemolyticus)的表型及分子特征 [J]. 海洋与湖沼, 2009, 40(5): 654-662. doi: 10.3321/j.issn:0029-814X.2009.05.021 Zhang X J, Chen C Z, Yan B L, et al. Phenotypic and molecular characterization of Pathogenic Vibrio parahaemolyticus isolated from Litopenaeus vannamei [J]. Oceanologia et Limnologia Sinica, 2009, 40(5): 654-662. doi: 10.3321/j.issn:0029-814X.2009.05.021
[12] 方磊, 石坚, 夏武强, 等. 浙江省患病凡纳滨对虾副溶血弧菌的分离、鉴定及毒力基因分析 [J]. 宁波大学学报(理工版), 2017, 30(1): 42-48. Fang L, Shi J, Xia W Q, et al. Isolation, identification and main virulence analysis of Vibrio parahaemolyticus from diseased Penaeus vannamei in Zhejiang province [J]. Journal of Ningbo University (
NSEE ) , 2017, 30(1): 42-48. [13] 效拟. 2007-2013年广东省腹泻病例副溶血弧菌分离株的病原特征分析 [D]. 广州: 南方医科大学, 2015: 35 Xiao N. Etiologic characteristics of Vibrio parahaemolyticus strains isolated from patients in Guangdong, 2007-2013 [D]. Guangzhou: Southern Medical University, 2015: 35
[14] Kim R, Park H, Kim W, et al. Antimicrobial effects of chemical disinfectants on fish pathogenic bacteria [J]. Food Science and Biotechnology, 2008, 17(5): 971-975.
[15] 姚小娟, 王元, 赵姝, 等. 三氯异氰脲酸和苯扎溴铵对海水养殖源弧菌的抑菌和杀菌效果 [J]. 南方水产科学, 2015, 11(1): 33-38. doi: 10.3969/j.issn.2095-0780.2015.01.005 Yao X J, Wang Y, Zhao S, et al. Inhibition and antibacterial effect of trichloroisocyanuric acid and benzalkonium bromide on Vibrio sp. from marine aquaculture [J]. South China Fisheries Science, 2015, 11(1): 33-38. doi: 10.3969/j.issn.2095-0780.2015.01.005
[16] 方苹, 陈辉, 邹勇, 等. 一种新型季铵盐消毒剂对水产致病菌的杀灭效果 [J]. 中国消毒学杂志, 2009, 26(1): 18-20. Fang P, Chen H, Zou Y, et al. Efficacy of a new quaternary ammonium salt disinfectant in killing aquatic pathogenic bacteria [J]. Chinese Journal of Disinfection, 2009, 26(1): 18-20.
[17] 吴岗, 周启良, 郭秀玲, 等. 聚维酮碘对凡纳滨对虾偷死综合征的防治研究 [J]. 水产养殖, 2016, 37(10): 23-28. doi: 10.3969/j.issn.1004-2091.2016.10.005 Wu G, Zhou Q L, Guo X L, et al. The prevention of povidone iodine to Litopenaeus vannamei AHPNS [J]. Journal of Aquaculture, 2016, 37(10): 23-28. doi: 10.3969/j.issn.1004-2091.2016.10.005
[18] 卫生部卫生法制与监督司. 消毒技术规范 [S]. 北京: 中华人民共和国卫生部, 2002: 19-23 Department of Health Legal System and Supervision, Ministry of Health. Technical specification for disinfection [S]. Beijing: Ministry of Health, PRC, 2002: 19-23
[19] 黄新宇. 聚六盐酸亚甲基胍消毒剂的研究 [D]. 上海: 第二军医大学, 2004: 8 Huang X Y. Study on disinfection of polyhaxemethylenguanidine hydrochloride [D]. Shanghai: the Second Military Medical University, 2004: 8
[20] 吴后波, 潘金培. 弧菌属细菌及其所致海水养殖动物疾病 [J]. 中国水产科学, 2001, 8(1): 89-93. Wu H B, Pan J P. Progress in studies of vibriosis in aquaculture [J]. Journal of Fishery Sciences of China, 2001, 8(1): 89-93.
[21] Wang G M, Chen Q, Shen H. The resistances of Vibrio vulnificus to 3 kinds of disinfectant [J]. Journal of Tropical Medicine, 2009(6): 634-636.
[22] 张帅, 潘连德, 郑串. 过氧乙酸对池塘水体的增氧抑菌抑藻效果研究 [J]. 大连海洋大学学报, 2016, 31(6): 651-657. Zhang S, Pan L D, Zheng C. Oxygenation, antimicrobial activity and algal control by acetic acid peroxide [J]. Journal of Dalian Ocean, 2016, 31(6): 651-657.
[23] 巴剑波, 陈双红, 徐雄利, 等. 创伤弧菌和副溶血弧菌对消毒剂敏感性研究 [J]. 中国消毒学杂志, 2009, 26(2): 123-125. Ba J B, Chen S H, Xu X L, et al. Study on susceptibility of V. parahaemolyticus and V. vulnificus to disinfectants [J]. Chinese Journal of Disinfection, 2009, 26(2): 123-125.
[24] 张文文. 常用渔药有效含量、杀菌效果比较及抗生素耐药性初步研究 [D]. 舟山: 浙江海洋学院, 2014: 20 Zhang W W. An investigation of the effective content and bactericidal efficacy in common fishery drugs and the antibiotics resistance of common aquaculture pathogens [D]. Zhoushan: Zhejiang Ocean University, 2014: 20
[25] 张玮, 于锋, 朱汉泉. 聚六亚甲基胍杀灭致病弧菌及其对海产养殖动物的毒性 [J]. 中国消毒学杂志, 2007, 24(6): 499-502. doi: 10.3969/j.issn.1001-7658.2007.06.003 Zhang W, Yu F, Zhu H Q. Efficacy of polyhexamethylene guanidine in killing pathogenic vibrio and its toxicity to marine breeding animals [J]. Chinese Journal of Disinfection, 2007, 24(6): 499-502. doi: 10.3969/j.issn.1001-7658.2007.06.003
[26] Mcdonnell G, Russell D. Antiseptics and disinfectants: activity, action, and resistance [J]. Clinical Microbiology Reviews, 1999, 12(1): 147-179. doi: 10.1128/CMR.12.1.147
[27] Allen J, Morby P, White F. Cooperativity in the binding of the cationic biocide polyhexa- methylene biguanide to nucleic acids [J]. Biochemical and Biophysical Research Communications, 2004, 318(2): 397-404. doi: 10.1016/j.bbrc.2004.04.043
[28] Gilbert P, Moore E. Cationic antiseptics: diversity of action under a common epithet [J]. Journal of Applied Microbiology, 2005, 99(4): 703-715. doi: 10.1111/j.1365-2672.2005.02664.x
[29] Kantaraja C, Manohar M, Ashwani S, et al. The antimicrobial polymer PHMB enters cells and selectively condenses bacterial chromosomes [J]. Scientific Reports, 2016, (3): 1-13.
[30] 赵进沛, 张凤云, 刘士敏, 等. 一种双链季铵盐消毒剂杀菌效果及其作用机理研究 [J]. 中国消毒学杂志, 2011, 28(4): 399-401. Zhao J P, Zhang F Y, Liu S M, et al. Study on the germicidal efficacy and mechanism of a double-chain quaternary ammonium salts disinfectant [J]. Chinese Journal of Disinfection, 2011, 28(4): 399-401.
[31] 杨秀山. 细菌细胞壁的结构 [J]. 微生物学通报, 1982, 2(16): 93-97. Yang X S. The structure of a bacterial cell wall [J]. Microbiology China, 1982, 2(16): 93-97.
[32] Truchado P, Gil-Izquierdo A, Tomás-Barberán F, et al. Inhibition by chestnut honey of N-Acyl-L-homoserine lactones and biofilm formation in Erwinia carotovora, Yersinia enterocolitica, and Aeromonas hydrophila [J]. Journal of Agricultural and Food Chemistry, 2009, 57(23): 11186-11193. doi: 10.1021/jf9029139
[33] 孙莉娜. 迟钝爱德华菌生物被膜状态下耐药相关基因与蛋白的硏究 [D]. 福建: 福建农林大学, 2016: 46-49 Sun L N. Studies on the genes and proteins related to the antibiotic resistance in Edwardsiella tarda biofilm [D]. Fujian: Fujian Agriculture and Forestry University, 2016: 46-49
[34] 张萍, 乔振国. PVP-碘对南美白对虾无节幼体的急性毒性试验 [J]. 海洋渔业, 2002(2): 68-69. doi: 10.3969/j.issn.1004-2490.2002.02.007 Zhang P, Qiao Z G. Test on acute toxicity of PVP-Lodophors to nauplii of white leg shrimp Penaeus vannamei [J]. Marine Fisheries, 2002(2): 68-69. doi: 10.3969/j.issn.1004-2490.2002.02.007
[35] 温为庚, 杨其彬, 黄建华, 等. 复方三氯异氰尿酸对短沟对虾各期幼体的毒性 [J]. 南方水产科学, 2011, 7(5): 68-72. doi: 10.3969/j.issn.2095-0780.2011.05.011 Wen W G, Yang Q B, Huang J H, et al. Acute toxicity of compound trichloroisocyanuric acid to Penaeus semisuicatus larvae [J]. South China Fisheries Science, 2011, 7(5): 68-72. doi: 10.3969/j.issn.2095-0780.2011.05.011
[36] 曾红, 林能锋, 张文焕, 等. 过氧化氢对日本对虾幼虾的急性毒性试验 [J]. 福建畜牧兽医, 2006, 28(6): 8-9. doi: 10.3969/j.issn.1003-4331.2006.06.038 Zeng H, Lin N F, Zhang W H, et al. Acute toxicity of hydrogen peroxide to shrimp larvae in Japan [J]. Fujian Animal Husbandry Veterinarian, 2006, 28(6): 8-9. doi: 10.3969/j.issn.1003-4331.2006.06.038
[37] 刘春花, 林明辉, 黄志斌, 等. 新型宝碘对草鱼、南美白对虾的急性毒性和抑菌效果研究 [J]. 广东农业科学, 2012, 39(7): 138-140. doi: 10.3969/j.issn.1004-874X.2012.07.046 Liu C H, Lin M H, Huang Z B, et al. Study on acute toxicity and bacteriostatic effect of the new type of bao-iodide to grass carp and South American white shrimp [J]. Guangdong Agricultural Science, 2012, 39(7): 138-140. doi: 10.3969/j.issn.1004-874X.2012.07.046
[38] 唐小千, 徐洪森, 战文斌. 对虾急性肝胰腺坏死综合症研究进展 [J]. 海洋湖沼通报, 2016(2): 90-93. Tang X Q, Xu H S, Zhan W B. Advance in study of shrimp acute hepatopancreas necrosis syndrome [J]. Transactions of Oceanology and Limnology, 2016(2): 90-93.
[39] 蒋葛, 沈辉, 万夕和, 等. 凡纳滨对虾急性肝胰腺坏死综合征研究进展 [J]. 动物医学进展, 2018, 39(4): 87-91. doi: 10.3969/j.issn.1007-5038.2018.04.018 Jiang G, Shen H, Wang X H, et al. Progress on acute hepatopancreas necrosis syndrome in Litopenaeus vannamei [J]. Progress in Veterinary Medicine, 2018, 39(4): 87-91. doi: 10.3969/j.issn.1007-5038.2018.04.018
[40] 李丽, 杨琼, 邢东旭. 次氯酸钠有效氯降解规律分析 [J]. 广东蚕业, 2013, 47(2): 25-30. Li L, Yang Q, Xing D X. Analysis on effective chlorine degradation of sodium hypochlorite [J]. Guangdong Sericulture, 2013, 47(2): 25-30.
[41] 崔超, 胡双启, 晋日亚, 等. 气体二氧化氯的光降解规律研究 [J]. 中国安全科学学报, 2011, 21(7): 52-56. doi: 10.3969/j.issn.1003-3033.2011.07.009 Cui C, Hu S Q, Jin R Y, et al. Research on photochemical decomposition of gaseous chlorine dioxide [J]. China Safety Science Journal, 2011, 21(7): 52-56. doi: 10.3969/j.issn.1003-3033.2011.07.009
[42] 张静. 微生物法降解戊二醛的研究 [D]. 成都理工大学硕士论文, 2013: 19-26 Zhang J. Study on the degradation of glutaraldehyde by microbial method [D]. Chengdu: Chengdu University of Technology, 2013: 19-26
[43] 周书春. 溴氯海因及含量测定 [J]. 卫生职业教育, 2005, 23(19): 80-82. doi: 10.3969/j.issn.1671-1246.2005.19.057 Zhou S C. The content determination of bromo-chloro-dimethyl hydantoin [J]. Health Vocational Education, 2005, 23(19): 80-82. doi: 10.3969/j.issn.1671-1246.2005.19.057
[44] 熊永忠, 杨林, 万文英. 一种新的消毒剂——溴氯海因 [J]. 畜牧兽医科技信息, 2005(1): 54. doi: 10.3969/j.issn.1671-6027.2005.01.054 Xiong Y Z, Yang L, Wan W Y. A new disinfectant-Bromo-Chloro - Dimethyl Hydantoin [J]. Scientific Information of Animal Husbamdry Veterinary Medicine, 2005(1): 54. doi: 10.3969/j.issn.1671-6027.2005.01.054
[45] 江敏, 吴昊, 罗春芳, 等. 溴氯海因在水环境中的降解及其对4种水生生物的急性毒性 [J]. 生态毒理学报, 2008, 3(6): 570-576. Jiang M, Wu H, Luo C F, et al. Study on the degradation rule of bromo-chloro-dimethyl hydantoin (BCDMH) and its acute toxicity to four aquatic organisms [J]. Asian Journal of Ecotoxicology, 2008, 3(6): 570-576.
[46] 李亚红, 赵小芳, 元昊, 等. 季铵盐在海水中的降解性 [J]. 海洋环境科学, 2016, 35(2): 238-242. Li Y H, Zhao X F, Yuan H, et al. Degradability of quaternary ammonium salt in seawater [J]. Marine Environmental Science, 2016, 35(2): 238-242.
[47] Wang H, Christopher V, Raup A, et al. Oligomeric dual functional antibacterial polycaprolactone [J]. Polymer Chemistry, 2014, 5(7): 2453-2460. doi: 10.1039/c3py01467c
-
期刊类型引用(2)
1. 蔡雪,黄雷,郑阿钦,褚宽,林华利,杨艳杰,原居林,宋大伟,姚嘉赟. 大蒜E素对副溶血弧菌的抑菌活性及机制. 水生生物学报. 2025(02): 108-117 .  本站查看
本站查看
2. 程安达,冯东岳,郑阿钦,孙艳霞,黄雷,赵宇杰,薛兴华,姚嘉赟,王秀敏. 甘胆口服液对副溶血性弧菌引起的对虾肝胰腺损伤坏死病防治效果. 科技通报. 2024(03): 36-40+78 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: