EFFECTS OF DIETARY CLA ON CYTOLOGICAL MORPHOLOGY, ACTIVITY OF ANTIOXIDANT ENZYMES, AND GENE EXPRESSIONS OF LIPID METABOLISM IN THE LIVER AND MUSCLE OF GRASS CARP
-
摘要: 采用65d的生长实验研究共轭亚油酸(CLA)对草鱼肝脏和肌肉细胞学形态、抗氧化能力以及脂肪代谢相关基因表达的影响。共配制7种近似等氮(粗蛋白: 36 g/100 g)等脂(粗脂肪: 4.5 g/100 g)的饲料: 0 (对照组)、0.5 (CLA0.5)、1 (CLA1)、1.5 (CLA1.5)、2 (CLA2)、2.5 (CLA2.5)和3 g/100 g CLA (CLA3)。每个饲料组均设置3个生物学重复, 实验鱼初始体重约为(5.08±0.08) g。实验结果显示: 与对照组相比, CLA0.5-CLA2.5组草鱼肝脏和肌肉组织细胞学形态均无明显异常, 但CLA3组肝细胞线粒体空泡化, 内质网肿胀, 排列过于紧密; 肌细胞肌节结构松散, 肌原纤维降解; 在CLA1.5-CLA2.5组肝脏和肌肉中超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)和谷胱甘肽过氧化物酶(GPx)活力均显著上升(P<0.05); 在CLA1.5-CLA3组中肝脏过氧化氢酶(CAT)活力均显著高于对照组(P<0.05), 但谷胱甘肽还原酶(GR)活力无显著变化(P>0.05), 且在CLA0.5-CLA3组中肌肉CAT和GR活力均无显著变化(P>0.05)。CLA1.5-CLA2组肝脏中MDA含量显著低于对照组(P<0.05), 而CLA2.5-CLA3组MDA含量显著高于对照组(P<0.05)。CLA3组肌肉中MDA含量显著高于对照组(P<0.05)。与对照组相比, 在CLA1.5-CLA2.5组肝脏和肌肉中乙酰辅酶A羧化酶(ACC) mRNA表达显著下调(P<0.05), 脂蛋白脂酶(LPL)、激素敏感性脂肪酶(HSL)和过氧化物酶体增殖物激活受体α (PPARα)均显著上调表达(P<0.05)。在CLA2-CLA3组肝脏以及CLA1.5-CLA2和CLA3组肌肉中脂肪酸去饱和酶2(FAD2)mRNA显著上调表达(P<0.05)。过氧化物酶体增殖物激活受体γ(PPARγ)mRNA在CLA1-CLA3组肝脏中显著下调表达(P<0.05), 而其在肌肉中均无显著变化(P>0.05)。综上所述, 结合2%CLA在不影响草鱼的生长和饲料利用, 且显著降低肝脏脂肪积累, 研究结果建议, 2% CLA在不影响草鱼肝脏和肌肉组织细胞学形态的前提下, 可有效提高其肝脏和肌肉组织抗氧化能力并促进其脂肪分解代谢以及抑制脂肪合成代谢相关基因表达。Abstract: A 65-day trial was conducted to investigate effects of CLA on cytological morphology, activity of antioxidant enzymes, and gene expressions of lipid metabolism in the liver and muscle of grass carp. Seven isonitrogenous (crude protein: 36 g/100 g) and isolipidic (crude lipid: 4.5 g/100 g) diets were formulated: 0 CLA (control), 0.5% (CLA0.5), 1% (CLA1), 1.5 (CLA1.5), 2 (CLA2), 2.5 (CLA2.5), and 3% CLA (CLA3). Three biological replicates of fish were assigned to each diet with the initial body weight at (5.08±0.08) g. Endoplasmic reticulum in the liver, and loose sarcolemma of myocyte and degradation of myofibril in the muscle when compared with the control fish. The activities of superoxide dismutase (SOD) and glutathione peroxidase (GPx), and the total antioxidant capacity (T-AOC) both in the liver and muscle of CLA1.5-CLA2.5 groups significantly (P<0.05) increased compared with control group. The activities of catalase (CAT) in the liver of CLA1.5-CLA3 groups were significantly (P<0.05) higher than that of control group, however, there was no significant (P>0.05) change in the glutathione reductase (GR) activity in the liver. The MDA contents in the liver of fish fed with CLA1.5-CLA2 diets were significantly (P<0.05) lower than that of control group, however, the MDA contents in the liver of fish fed with CLA2.5-CLA3 diets significantly (P<0.05) increased compared with control group. In contrast, fish fed with CLA3 had significantly higher MDA contents in the muscle (P<0.05) compared with control group. Compared with the control fish, the mRNA level of acetyl-CoA carboxylase (ACC) both in the liver and muscle of fish fed with CLA1.5-CLA2.5 diets were significantly (P<0.05) down-regulated; the mRNA levels of lipoprotein lipase (LPL), hormone-sensitive lipase (HSL), and peroxisome proliferator-activated receptor alpha (PPARα) of fish fed with CLA1.5-CLA2.5 diets were significantly (P<0.05) up-regulated; the mRNA levels of fatty acid desaturase 2 (FAD2) in the liver of fish fed with CLA2-CLA3 diets and in the muscle of fish fed with CLA1.5-CLA2 and CLA3 diets were significantly (P<0.05) up-regulated; the mRNA level of peroxisome proliferator-activated receptor gamma (PPARγ) in the liver of fish fed with CLA1-CLA3 diets was significantly (P<0.05) down-regulated. Conversely, there was no significant (P>0.05) difference for the PPARγ mRNA level in the muscle of fish fed with CLA0.5-CLA3 diets. In conclusion, supplementation of 2% CLA could significantly decrease the lipid contents in the liver and muscle without affecting cytological morphology of liver and muscle, the growth and feed utilization of grass carp by improving the antioxidant capacities in the liver and muscle.
-
Keywords:
- Grass carp /
- CLA /
- Cytological morphology /
- Antioxidant capacity /
- Gene expression
-
草鱼(Ctenopharyngodon idellus)作为我国淡水养殖产量最大的品种之一, 在2016年产量已达到5.89×109 kg, 占淡水水产品养殖总量的18.55%[1]。然而, 随着配合饲料在我国水产养殖中的使用越来越广泛, 养殖鱼类发生营养性脂肪肝的机率亦随之增加, 其中, 草食性鱼类, 如草鱼的发病率更高[2]。营养性脂肪肝可导致养殖鱼类体脂增加, 影响鱼肉品质; 同时, 肝脏上过多的脂肪沉积可导致肝细胞病变和坏死, 鱼体抗胁迫能力和免疫力下降, 鱼类极易暴发疾病甚至死亡, 在高温季节更为严重, 给水产养殖业带来巨大损失[3]。因此, 寻找有效防治鱼类营养性脂肪肝的绿色调节剂是当前水产养殖业亟待解决的关键科学问题之一。
CLA是一类含有共轭双键的十八碳二烯酸的总称, 其含有多种构型, 其中c9、t11 CLA和t10、c12 CLA是CLA最常见的活性异构体[4]。近年来, CLA因具有缓解动脉粥样硬化、降低炎症反应、降低肥胖发生率和改善糖尿病等作用而被广泛关注[5], 且CLA已于2009年被我国卫生部批准作为食品添加剂。研究表明, 在饲料中添加1%的CLA可显著降低杂交鲈(Morone saxatilis)、黄鲈(Perca flavescens)和黄颡鱼(Pelteobagrus fulvidraco)肝脂含量[6—8], 而对鲤鱼(Cypriniformes spp)、斑点叉尾鮰(Ictalurus punctatus)、虹鳟(Oncorhynchus mykiss)和欧洲鲈鱼(Dicentrarchus labrax)肝脂含量无显著影响[9—13], 这表明CLA对不同鱼类肝脏脂肪积累的生理效应不尽相同。
不仅如此, 即使是同种鱼类, 其规格不同, CLA对其肝脂、肌肉脂肪和体脂含量的生理效应也出现了不同的结果, 如: Zuo等[14]研究发现, 在均重为7.26 g的大黄鱼(Pseudosciaena crocea)饲料中添加0.84%—1.70% CLA, 其体脂和肌肉脂肪含量均显著上升, 而赵占宇等[15]研究表明, 在均重为150 g的大黄鱼饲料中添加1%—4% CLA替代鱼油, 其体脂、肝脂和肌脂有均呈下降的趋势, 但不显著; Kennedy等[16]研究发现, 在均重为87.5 g的大西洋鲑(Salmo salar)饲料中添加2% CLA替代鱼油可显著增加其肝脏和肌肉脂肪含量; 而Leaver等[17]研究表明, 在均重为132 g的大西洋鲑饲料中添加2% CLA替代鱼油对其体脂和肝脂含量无显著影响, 而添加量达到4%时, 显著降低其体脂和肝脏甘油三酯含量。上述研究表明, 同种鱼类不同生长阶段对CLA的生理效应不同。
另外, Dong等[18]的研究表明, 在饲料中添加2.5% CLA在不影响草鱼健康的前提下, 可显著降低其肝脏和肌肉脂肪含量。然而, 在该研究中, 饲料配方含有鱼粉和鱼油, 鱼粉和鱼油又含有其他已报道的具有降脂功效的多不饱和脂肪酸, 如EPA和DHA, 可能会干扰其实验结果。为进一步确定CLA可否显著降低草鱼肝脏和肌肉脂肪积累, 本实验采用无鱼粉和鱼油的饲料配方, 通过在草鱼饲料中添加不同浓度的CLA, 并采用成分单一的饱和脂肪酸-椰子油平衡总的脂肪含量, 研究CLA对草鱼肝脏和肌肉细胞学形态、抗氧化能力以及脂肪代谢相关基因表达的影响, 进一步确定不同浓度的CLA能否在不影响草鱼健康的前提下, 可增加其组织抗氧化能力并提高其组织脂肪分解代谢基因以及降低组织合成代谢相关脂肪代谢基因表达, 为确定CLA能否作为有效防治草鱼营养性脂肪肝的绿色添加剂提供理论依据。
1. 材料与方法
1.1 实验鱼与实验饲料
草鱼购自安徽省合肥市丙子养殖场, 实验鱼在进入实验室后, 在10个玻璃缸中驯养至少20d。驯养期间, 每天用对照组饲料(表 1)饱食投喂2次(09:00和15:00)。共配制7种近似等氮(粗蛋白: 36 g/100 g)等脂(粗脂肪: 4.5 g/100 g)饲料: 0 (对照组)、0.5 (CLA0.5)、1 (CLA1)、1.5 (CLA1.5)、2 (CLA2)、2.5 (CLA2.5)和3 g/100 g CLA (CLA3)。每组饲料中均添加1 g/100 g的亚油酸和0.5 g/100 g的亚麻酸作为草鱼必需脂肪酸源, 采用椰子油填充不同梯度的CLA以确保每组饲料中粗脂肪含量一致。饲料配方以及化学组成见表 1, 实验用CLA、椰子油以及饲料中脂肪酸组成见表 2。使用饲料制粒机将实验饲料挤压成直径为1—3 mm的颗粒, 60℃烘干, −10℃保存。
表 1 饲料配方和基本化学组成(g/100 g 干物质)Table 1. Formulation and chemical composition of the experimental diets (g/100 g in dry matter)原料 Ingredient 饲料 Diet CLA0 CLA0.5 CLA1 CLA1.5 CLA2 CLA2.5 CLA3 豆粕 Soybean meal (oil-extracted)a 48 48 48 48 48 48 48 菜籽粕 Rapeseed meal (oil-extracted)b 14 14 14 14 14 14 14 棉籽粕 Cottonseed meal (oil-extracted)c 11 11 11 11 11 11 11 α-淀粉 α-starch 8 8 8 8 8 8 8 玉米淀粉 Corn starch 7.69 7.69 7.69 7.69 7.69 7.69 7.69 矿物盐预混物 Mineral premixd 1 1 1 1 1 1 1 维生素预混物 Vitamin premixe 0.5 0.5 0.5 0.5 0.5 0.5 0.5 维生素C Vitamin Cf 0.1 0.1 0.1 0.1 0.1 0.1 0.1 椰子油 Coconut oilg 3 2.5 2 1.5 1 0.5 0 共轭亚油酸 CLAh 0 0.5 1 1.5 2 2.5 3 精炼亚油酸 Refined linoleic acidi 1 1 1 1 1 1 1 精炼亚麻酸 Refined linolenic acidj 0.5 0.5 0.5 0.5 0.5 0.5 0.5 氯化胆碱 Choline chloride 0.1 0.1 0.1 0.1 0.1 0.1 0.1 纤维素 Cellulose 5.11 5.11 5.11 5.11 5.11 5.11 5.11 化学组成(干物质) Chemical composition (in dry matter) 粗蛋白 Crude protein 36.02 36.24 36.3 35.98 36.08 36.11 36.25 粗脂肪 Crude lipid 4.52 4.48 4.50 4.43 4.60 4.55 4.52 灰分 Ash 6.16 6.01 5.98 5.98 5.86 5.86 5.84 总能 Gross energy (kJ/g) 15.2 15.33 15.28 15.22 15.39 15.44 15.48 注: a豆粕: 安徽华谊农牧科技有限公司, 中国合肥; b菜籽粕: 安徽华谊农牧科技有限公司, 中国合肥; c棉籽粕: 安徽华谊农牧科技有限公司, 中国合肥; d矿物盐预混物: (mg/kg预混料, H440): NaCl, 500; MgSO4·7H2O, 7500; NaH2PO4·2H2O, 12500; KH2PO4, 16000; Ca(H2PO4)·2H2O, 10000; FeSO4, 1250; C6H10CaO6·5H2O, 1750; ZnSO4·7H2O, 176.5; MnSO4·4H2O, 81; CuSO4·5H2O, 15.5; CoSO4·6H2O, 0.5; KI, 1.5; starch, 225; e维生素预混物: (mg/kg预混料, NRC, 2011): 硫胺素, 20; 核黄素, 20; 吡哆醇, 20; 氰钴胺, 2; 叶酸, 5; 泛酸钙, 50; 肌醇, 100; 烟酸, 100; 生物素, 5; 淀粉, 3226; 维生素A (维生素A乙酸酯和维生素A棕榈酸酯, 1 鲶1), 110; 维生素D3 (胆钙化固醇), 20; 维生素E (dl-α-生育酚乙酸酯), 100; 维生素K3 (亚硫酸氢钠), 10; f维生素C: L-抗坏血酸-2-多磷酸酯, 35%抗坏血酸等价物, 北京桑普生化科技有限公司, 中国北京; g椰子油: SUPERCOCO, G.G. Alliance Pte Ltd, 菲律宾; h共轭亚油酸: 青岛澳海生物技术有限公司, 中国青岛; i精制亚油酸(LA): 西安康隆化工有限公司, 中国西安, 纯度> 98%; j精制亚麻酸(LNA): 西安康龙化工有限公司, 中国西安, 纯度>98%Note: aSoybean meal: Anhui Huayi Agr-livestock Technology Co., Ltd., Hefei, China; bRapeseed meal: Anhui Huayi Agr-livestock Technology Co., Ltd., Hefei, China; cCottonseed meal: Anhui Huayi Agr-livestock Technology Co., Ltd., Hefei, China; dMineral premix: (mg/kg premix:, H440): NaCl, 500; MgSO4·7H2O, 7500; NaH2PO4·2H2O, 12500; KH2PO4, 16000; Ca(H2PO4)·2H2O, 10000; FeSO4, 1250; C6H10CaO6·5H2O, 1750; ZnSO4·7H2O, 176.5; MnSO4·4H2O, 81; CuSO4·5H2O, 15.5; CoSO4·6H2O, 0.5; KI, 1.5; starch, 225; eVitamin premix (mg/kg diet, NRC, 2011): Thiamin, 20; riboflavin, 20; pyridoxine, 20; cyanocobalamine, 2; folic acid, 5; calcium pantothenate, 50; inositol, 100; niacin, 100; biotin, 5; starch, 3226; vitamin A (as vitamin A acetate and vitamin A palmitate, 1鲶1), 110; vitamin D3 (cholecalciferol), 20; vitamin E (dl-α-tocopherol acetate), 100; vitamin K3 (as menadione sodium bisulphite), 10; fVitamin C: L-ascorbyl-2-polyphosphate, 35% ascorbic acid equivalent, Beijing Sunpu Biochemical and Technology Co., Ltd., Beijing, China; gCoconut oil: SUPERCOCO, G.G. Alliance Pte Ltd, Philippines; hQINGDAO AUHAI Biotech. Co. Ltd., Qingdao, China; iRefined linoleic acid (LA): Xi’an Kanglong Chemical Industry Co., Ltd., Xi’an, China; purity>98%; jRefined linolenic acid (LNA): Xi’an Kanglong Chemical Industry Co., Ltd., Xi’an, China; purity>98% 表 2 脂肪原料(g/100 g油) 和饲料(g/100 g干物质)的脂肪酸组成Table 2. Fatty acid compositions of oils (g/100 g of oil) and experimental diets (g/100 g in dry matter)脂肪酸Fatty acid 饲料Diet 椰子油Coconut oil CLA oil CLA0 CLA0.5 CLA1 CLA1.5 CLA2 CLA2.5 CLA3 C8:0 6.7 - - - - - - - - C10:0 5.8 - - - - - - - - C12:0 50.78 - 1.5 1.25 1.01 0.75 0.51 0.25 0.03 C14:0 196 - 0.588 0.49 0.392 0.294 0.196 0.098 0.06 C16:0 82 0.5 0.246 0.207 0.169 0.13 0.09 0.0534 0.015 C18:0 - 0.5 - 0.02 0.01 0.05 0.03 0.06 0.01 ∑SFAa 91.08 1 2.334 1.967 1.581 1.224 0.826 0.4614 0.115 C16:1n-7 - - - - - - - - - C18:1n-9 - 2.5 - 0.012 0.021 0.032 0.053 0.022 0.061 C20:1 - - - - - - - - - C24:1n-9 - - - - - - - - - ∑MUFAb - 2.5 - 0.012 0.021 0.032 0.053 0.022 0.061 C18:2n-6 - - 1.02 1.01 0.99 0.98 1.05 0.14 1.03 C18:2 - 1.6 - 0.008 0.016 0.024 0.032 0.04 0.048 C18:2 - 46.5 - 0.233 0.465 0.6975 0.93 1.1625 1.395 C18:2 - 47.2 - 0.236 0.472 0.708 0.944 1.18 1.416 C18:3n-3 - - 0.495 0.490 0.501 0.489 0.510 0.499 0.500 C20:5n-3 - - - - - - - - - C22:6n-3 - - - - - - - - - ∑PUFAc - 95.3 1.515 1.977 2.444 2.899 3.466 3.922 4.389 n-3PUFAd - - 0.495 0.49 0.501 0.489 0.51 0.499 0.5 n-6PUFAe - - 1.02 1.01 0.99 0.98 1.05 1.04 1.03 n-3/n-6 - - 0.485 0.485 0.506 0.499 0.486 0.480 0.485 ∑CLAf - 93.7 - 0.469 0.937 1.406 1.874 2.343 2.811 注: “-”: 未检测出; a∑饱和脂肪酸, 总饱和脂肪酸: C8:0, C10:0, C12:0, C14:0, C16:0, C18:0; b∑单不饱和脂肪酸, 总单不饱和脂肪酸: C16:1n-7, C18:1n-9, C20:1, C24:1n-9; c∑多不饱和脂肪酸, 总多不饱和脂肪酸: C18:2n-6, C18: 2 Cis-9 and Cis-12, C18:2 Cis-9 and Trans-11, C18: 2 Trans-10 and Cis-12, C18: 3n-3, C20: 5n-3, C22: 6n-3; dn-3多不饱和脂肪酸: C18: 3n-3, C20: 5n-3 and C22: 6n-3总量; en-6多不饱和脂肪酸: C18: 2n-6总量; f∑共轭亚油酸, 总共轭亚油酸: C18: 2 Cis-9 and Trans-11; C18: 2 Trans-10 and Cis-12Note: “-”: not detected; a∑SFA, total saturated fatty acids: C8:0, C10:0, C12:0, C14:0, C16:0, C18:0; b∑MUFA, total monoun-saturated fatty acids: C16:1n-7, C18:1n-9, C20:1, C24:1n-9; c∑PUFA, total polyunsaturated fatty acids: C18:2n-6, C18: 2 Cis-9 and Cis-12, C18: 2 Cis-9 and Trans-11, C18: 2 Trans-10 and Cis-12, C18: 3n-3, C20: 5n-3, C22: 6n-3; dn-3PUFA: the sum of C18: 3n-3, C20: 5n-3 and C22: 6n-3; en-6PUFA: the sum of C18: 2n-6; f∑CLA, total conjugated linoleic acid: C18: 2 Cis-9 and Trans-11; C18: 2 Trans-10 and Cis-12 1.2 生长实验及取样方法
本实验的生长实验与Zou等[19]的生长实验为同一个实验。生长实验在21个圆形塑料缸(直径为: 60 cm, 容积为: 190 L)的循环系统中进行。实验开始前, 将初始体重为(5.08±0.08) g (平均值±标准误)的实验鱼禁食24h, 然后随机选取体质健壮、规格一致的实验鱼, 每缸40尾, 每个饲料组设置3个实验缸, 同时取3组鱼(每组10尾)作为初始鱼体组成样本。养殖实验持续65d。投喂方法和养殖条件均与Zou等[19]相同。生长实验结束前1天, 将实验鱼停喂24h, 采用MS-222 (200 mg/L, Sigma-Aldrich, St Louis, MO, USA)将实验鱼麻醉并称重。然后, 随机从每个实验缸中选取15尾实验鱼, 冰盘上解剖, 取其肝脏和背部白肌, 用于其细胞学形态观察、抗氧化酶活力和脂肪代谢相关基因表达分析。
1.3 生化成分分析
采用Zou等[19]描述的方法测定饲料中的干物质、粗蛋白、粗脂肪和灰分含量及总能量。将7种饲料冷冻干燥后研磨成粉末, 随后提取总脂质, 甲基化成脂肪酸甲酯, 依据Zou等[19]描述的方法测定脂肪酸甲酯并计算出脂肪酸含量。以上每项检测至少3个重复。
1.4 肝脏和肌肉组织细胞学形态观察
将肝脏和肌肉样品于2.5%戊二醛中固定48h, 随后, 切成1 mm3的块状并用0.1 mol/L磷酸缓冲液(pH 7.4)漂洗3次, 然后在1%四氧化锇水溶液固定1h后取出, 再用磷酸缓冲液冲洗, 然后在50%—100%梯度酒精中脱水并包埋在Epon 812中。用UCT8切片机制作超薄切片, 然后用醋酸铀-柠檬酸铅双重染色, 透射电镜(FEI Tecnai, G2 F20 S-TWIN, Eindhoven, The Netherlands)观察。
1.5 肝脏和肌肉组织抗氧化酶类的酶活力、总抗氧化能力和丙二醛含量检测
将肝脏和肌肉样品在0.65%的冷生理盐水中匀浆。随后在4℃, 6000 r/min, 离心15min, 取上清液, 用于测定超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)、谷胱甘肽还原酶(GR)、总抗氧化能力(T-AOC)和丙二醛(MDA)。所有检测均采用南京建成生物工程研究所试剂盒及相关说明测定, 对应试剂盒编号分别为: No. A001、No. A007、No. A005、No. A062、No. A015和No. A003。组织匀浆的总蛋白含量依据Bradford[20]的方法以牛血清白蛋白为标准蛋白测定。每项测定至少有3个生物学重复。
1.6 肝脏和肌肉组织脂肪代谢相关基因mRNA相对表达量的检测
根据Zou等[19]描述的方法用Trizol提取肝脏和肌肉总RNA, 然后测定其浓度并鉴定其质量。草鱼的乙酰辅酶A羧化酶(ACC)、脂肪酸脱氢酶2 (FAD2)、脂蛋白脂肪酶(LPL)、激素敏感性脂肪酶(HSL)、过氧化物酶体增殖物激活受体α(PPARα)、过氧化物酶体增殖物激活受体γ(PPARγ)和β-actin (内参)的引物序列如表 3所示, 然后由宝生物工程(大连)有限公司合成。
表 3 实时荧光定量PCR(qRT-PCR)引物序列Table 3. Primers used for real-time quantitative PCR (qRT-PCR)基因Gene 正向引物Forward primer 反向引物Reverse primer PPARα TCAGGATACCACTATGGAGTTCAC TACAGCGGCGTTCACACTTG PPARγ CGCTCATCTCCTACGGTCAG ATGTCGCTGTCGTCCAACTC FAD2 AGGTCTTCTCTTGGTACTTGACTCC GCACCATCTCTTCCCCACA LPL ATTGTGGTGGACTGGTTG CTACATGAGCACCAAGACTG ACC TGGCTGCACTGCACTCTCACT GGTCCAGCTTCCCTGCGGTC HSL GTGGTCCAATCCTGCGTCAT CACAGGGCACTACAGTATGCTTCTA β-actin CGTGACATCAAGGAGAAG GAGTTGAAGGTGGTCTCAT 1.7 数据统计与分析
所有实验数据先经过正态性检验和同质性检验, 然后对平均值进行单因素方差分析(one-way ANOVA)后, 再进行Duncan’s多重比较, 在P<0.05时检验差异的显著性。方差分析以及饲料中CLA水平与其肝脏和肌肉中抗氧化酶活力以及脂肪代谢相关基因mRNA表达水平的相关性分析均由SPSS18.0 (SPSS PASW Statistics, SPSS Inc., Chicago, IL, USA)完成。
2. 结果
本实验与Zou等[19]的生长实验为同一个实验, 其中, 共轭亚油酸对草鱼生长性能和饲料利用的影响已发表。其结果简述如下: 在饲料中添加0.5%—3% CLA不影响草鱼的存活率(P>0.05, 表 4)。1%CLA组的摄食率显著高于对照组(P<0.05), 而2.5%—3%CLA组的摄食率显著低于对照组(P<0.05, 表 4)。饲料中0.5%—2% CLA对草鱼特定生长率、饲料转化效率、蛋白储积率和能量储积率均无显著性影响(P>0.05), 但2.5%—3% CLA分别显著降低其上述指标(P<0.05, 表 4)。如表 5所示(该数据已发表, 见Zou等[19]), 饲料中添加0.5%—3%CLA对草鱼全鱼干物质、粗蛋白、粗脂肪、灰分和能量含量均无显著性影响(P<0.05)。饲料中1.5%—3%CLA、1%—3%CLA和1.5%—3%CLA分别显著降低肝脏、腹腔脂肪组织和肌肉中的脂肪含量(P<0.05)。
表 4 饲料中共轭亚油酸对生长和饲料利用的影响(平均值±标准误, n=3)*Table 4. Effects of dietary CLA on growth and feed utilization of grass carp (mean ± SE, n = 3)*指标Index 饵料Diet CLA0 CLA0.5 CLA1 CLA1.5 CLA2 CLA2.5 CLA3 SR1 98.89±1.11 97.78±1.11 100±0.0 97.78±2.22 98.89±1.11 96.67±1.93 97.78±1.11 IBW2 5.08±0.08 5.25±0.25 4.97±0.16 4.95±0.20 5.19±0.23 5.07±0.29 5.06±0.25 FBW3 25.96±0.41a 25.42±0.26a 26.82±0.57a 26.52±0.48a 25.94±0.49a 24.03±0.48b 23.45±0.46b FR4 2.59±0.03b 2.61±0.04ab 2.62±0.05ab 2.74±0.05a 2.62±0.03ab 2.37±0.03c 2.29±0.05c SGR5 2.11±0.05a 2.07±0.04ab 2.12±0.05a 2.10±0.05ab 2.08±0.05ab 1.95±0.03bc 1.86±0.04c FCE6 71.26±0.35a 70.23±0.61ab 71.54±0.58a 70.33±0.60ab 70.01±0.49ab 69.04±0.55b 68.85±0.47b PRE7 47.18±0.62a 47.10±0.41a 47.78±0.42a 46.80±0.50a 46.82±0.19a 44.23±0.61b 44.63±0.68b ERE8 41.53±0.53ab 41.32±0.79ab 42.06±0.82a 41.44±0.78ab 40.54±0.54ab 39.06±1.01bc 37.05±0.68c 注: 1存活率(SR, %) =100×终末实验鱼个数/初始实验鱼个数; 2初始体重; 3终末体重; 4摄食率(FR, % /d) = 100% ×饲料摄入量(干物质, g)/天数× {[初始体重(湿重, g) +终末体重(湿重, g)]/2}; 5特定生长率(SGR, %/d) = 100% × [ln终末体重(湿重, g) –ln初始体重(wet weight, g)]/天数; 6饲料转化效率(FCE, %) = 100% × [终末体重(湿重, g) – 初始体重(湿重, g)]/饲料摄入量(dry matter, g); 7蛋白储积率(PRE, %) = 100% × 鱼体蛋白储积量/蛋白摄入量(干物质, g); 8能量储积率(ERE, %) = 100% × 鱼体能量储积量/能量摄入量(干物质, kJ/g); *表中同行均值不同上标英文字母表示差异显著(P< 0.05); 下同Note: 1Survival rate (SR, %) =100×final fish number/initial fish number; 2IBW: Initial body weight; 3FBW: Final body weight; 4Feeding rate (FR, % /d) = 100% × feed intake (dry matter, g)/days × {[initial body weight (wet weight, g) + final body weight (wet weight, g)]/2}; 5Specific growth rate (SGR, %/d) = 100% × [ln final body weight (wet weight, g) – ln initial body weight (wet weight, g)]/days; 6Feed conversion efficiency (FCE, %) = 100% × [final body weight (wet weight, g) – initial body weight (wet weight, g)]/food intake (dry matter, g); 7Protein retention efficiency (PRE, %) = 100% × protein gain in fish/protein intake (dry matter, g); 8Energy retention efficiency (ERE, %) = 100% × energy gain in fish/energy intake (dry matter, kJ/g); *Means with the different superscripts within the same row are significantly different at P < 0.05; the same applies below 表 5 饲料中共轭亚油酸对草鱼全鱼组成和组织脂肪含量的影响(平均值±标准误, n = 3)Table 5. Whole body composition and tissue lipid content of grass carp fed with the experimental diets (mean ± SE, n = 3)指标 Index 饲料组 Diet 初始Initial CLA0 CLA0.5 CLA1 CLA1.5 CLA2 CLA2.5 CLA3 全鱼组成(g/100 g, 湿重) Whole body (g/100 g, wet weight) 干物质 Dry matter 18.77±0.12 23.02±0.24 22.70±0.33 23.28±0.29 22.60±0.35 22.67±0.41 22.75±0.39 22.78±0.13 粗蛋白 Crude protein 10.22±0.26 12.74±0.27 13.01±0.14 13.32±0.28 13.18±0.29 12.67±0.26 12.85±0.20 12.68±0.18 粗脂肪 Crude lipid 3.43±0.13 5.11±0.17 5.06±0.47 5.20±0.31 5.22±0.23 4.63±0.29 4.84±0.35 4.66±0.20 灰分 Ash 2.67±0.24 3.20±0.19 3.22±0.27 3.08±0.13 3.19±0.17 3.05±0.11 3.44±0.29 3.28±0.24 能量 Gross energy 3.03±0.15 4.28±0.19 3.34±0.32 3.56±0.32 3.58±0.34 3.63±0.29 3.73±0.26 3.55±0.28 脂肪含量(g/100 g, 湿重) Lipid content (g/100 g, wet weight) 肝脏 Liver 14.52±0.25a 14.36±0.08a 14.17±0.19a 13.26±0.22b 12.02±0.06c 10.94±0.04d 10.64±0.18d 腹腔脂肪 Intraperitoneal fat 32.31±0.25a 32.10±0.18a 31.12±0.25b 30.08±0.23c 29.19±0.14d 28.66±0.32d 28.48±0.32d 肌肉 Muscle 2.47±0.22a 2.26±0.12ab 2.22±0.10ab 1.94±0.07bc 1.86±0.02c 1.77±0.04c 1.73±0.04c 2.1 饲料中不同CLA添加水平对草鱼肝脏和肌肉组织中细胞学形态的影响
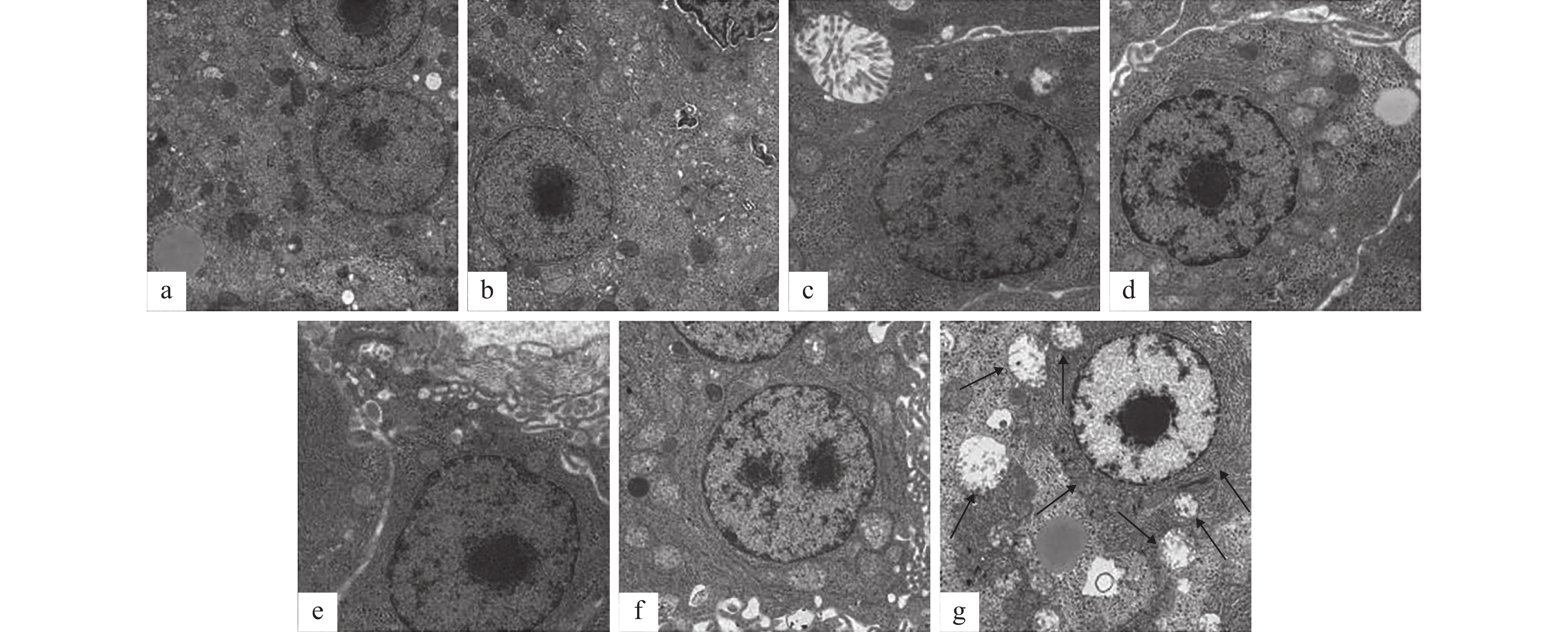
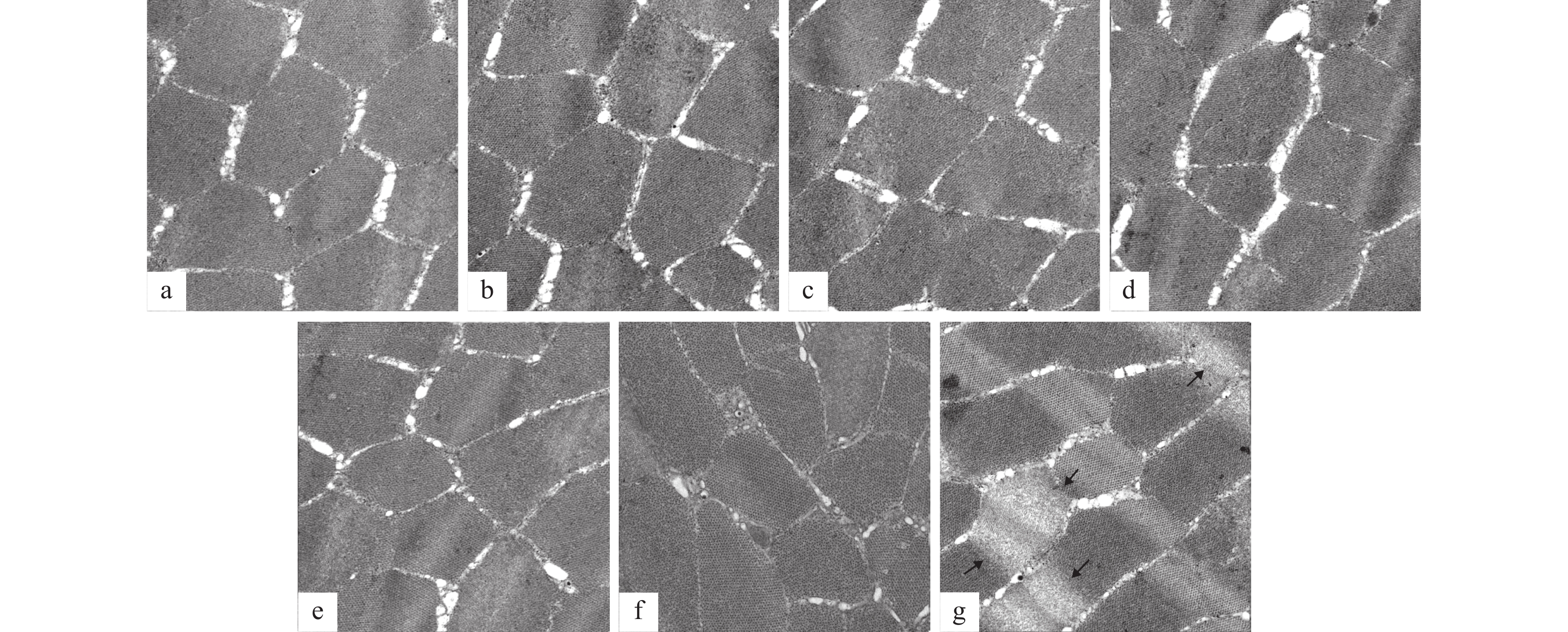
不同CLA添加水平对草鱼肝组织细胞超微结构的影响如图 1所示。对照组草鱼肝细胞的超微结构正常(图 1a)。细胞双层膜结构完整, 细胞核、线粒体和内质网等亚细胞器均清晰可见。CLA0.5-CLA2.5组肝细胞双层膜结构完整, 细胞核呈球形, 染色质均一; 线粒体呈囊状结构, 内嵴清晰; 粗面内质网排列整齐, 核糖体附着均匀(图 1b—f)。而CLA3组肝细胞线粒体空泡化, 内嵴大部分消失; 内质网肿胀, 排列过于紧密, 结构异常(图 1g)。不同CLA添加水平对草鱼肌细胞超微结构的影响如图 2所示。对照组草鱼肌细胞超微结构正常(图 2a)。肌节结构紧密, 肌原纤维结构清晰。CLA0.5-CLA2.5组草鱼肌细胞结构与对照组一致, 未出现异常(图 2b—f)。而CLA3组肌细胞肌节结构松散, 肌原纤维降解, 结构异常(图 2g)。
2.2 饲料中不同CLA添加水平对草鱼肝脏和肌肉中抗氧化酶类活力、T-AOC和MDA含量的影响
由表 6可知, 与对照组相比, CLA1-CLA3组肝脏中SOD活力显著上升(P<0.05), 其中在CLA2和CLA3组最为显著; 在CLA1.5-CLA3组肝脏中CAT、GPx和T-AOC活力显著高于对照组(P<0.05), 且这3种酶酶活力在CLA2组均达到最高, 而GR活力在CLA0.5-CLA3组无显著变化(P>0.05)。CLA0.5-CLA1组肝脏中MDA含量与对照组MDA含量接近(P>0.05), 但CLA1.5-CLA2肝脏中组MDA含量显著低于对照组(P<0.05), 而CLA2.5-CLA3组MDA含量显著高于对照组(P<0.05)。由表 7可知, 与对照组相比, 在CLA1.5-CLA3组肌肉中SOD活力显著提高(P<0.05), 且在CLA2组达到最高; GPx活力在CLA1-CLA3组肌肉中显著提高(P<0.05), 且在CLA2.5组最为显著; 在CLA1.5-CLA2.5组肌肉中TAOC活力显著高于对照组(P<0.05), 且在CLA2组中达到最高, 而在CLA0.5-CLA3组肌肉中CAT和GR活力均无显著变化(P>0.05)。CLA0.5-CLA2.5组肝脏中MDA含量与对照组MDA含量均无显著性差异(P>0.05), 但CLA3组MDA含量显著高于对照组(P<0.05)。
表 6 饲料中CLA对草鱼肝脏中抗氧化酶类活力、总抗氧化能力和丙二醛含量的影响(平均值±标准误, n=3)*Table 6. Effects of dietary CLA on activity of antioxidant enzymes, T-AOC and MDA contents in the liver of grass carp (mean±SE, n=3)*酶活力Enzyme activity CLA0 CLA0.5 CLA1 CLA1.5 CLA2 CLA2.5 CLA3 SOD (U/mg prot) 509.71±7.38d 529.30±16.05cd 544.77±11.94c 597.49±7.42b 638.89±8.90a 634.66±9.01a 612.38±5.10ab CAT (U/mg prot) 61.53±5.64b 60.57±6.10b 77.69±8.08b 100.57±10.69a 122.66±5.10a 116.17±4.38a 111.89±6.13a GPx (U/mg prot) 386.87±19.00c 402.72±11.99c 435.68±12.14bc 476.08±28.06ab 520.50±9.09a 471.50±29.62ab 501.95±12.04a GR (U/g prot) 5.50±0.36 5.59±0.60 5.44±0.53 5.59±0.52 5.80±1.06 5.94±0.54 4.33±0.68 T-AOC (U/mg prot) 4.74±0.26c 4.56±0.47c 5.90±0.52bc 6.35±0.56b 9.36±0.40a 9.40±0.31a 8.24±0.44a MDA (nmol/mg prot) 2.25±0.19b 2.19±0.17b 2.16±0.13b 1.64±0.10c 1.20±0.10c 2.93±0.18a 4.16±0.22a 表 7 饲料中CLA对草鱼肌肉中抗氧化酶类活力、总抗氧化能力和丙二醛含量的影响(平均值±标准误, n =3)*Table 7. Effect of dietary CLA on activity of antioxidant enzymes, T-AOC and MDA contents in the muscle of grass carp (mean±SE, n=3)*酶活力Enzyme activity CLA0 CLA0.5 CLA1 CLA1.5 CLA2 CLA2.5 CLA3 SOD (U/mg prot) 83.03±4.26d 86.40±3.52d 95.22±5.01cd 106.09±5.93bc 143.37±6.67a 114.12±4.13b 118.53±7.67b CAT (U/mg prot) 10.40±0.52 9.34±0.90 10.09±1.45 11.94±0.88 10.04±1.18 11.50±0.51 11.92±1.20 GPx (U/mg prot) 75.05±3.21c 76.72±3.08c 94.43±4.51b 102.43±6.61ab 111.69±6.26ab 116.21±7.29a 105.10±5.75ab GR (U/g prot) 2.15±0.20 2.34±0.53 2.40±0.38 1.96±0.46 2.33±0.45 1.99±0.45 1.97±0.44 T-AOC (U/mg prot) 1.73±0.28c 1.94±0.26c 2.43±0.37bc 3.16±0.29ab 3.67±0.25a 3.01±0.42ab 2.20±0.29bc MDA (nmol/mg prot) 1.96±0.28b 1.91±0.16b 1.88±0.18b 1.89±0.28b 1.75±0.28b 2.32±0.28b 3.42±0.26a 2.3 饲料中不同CLA添加水平对草鱼肝脏和肌肉中脂肪代谢相关基因mRNA表达的影响
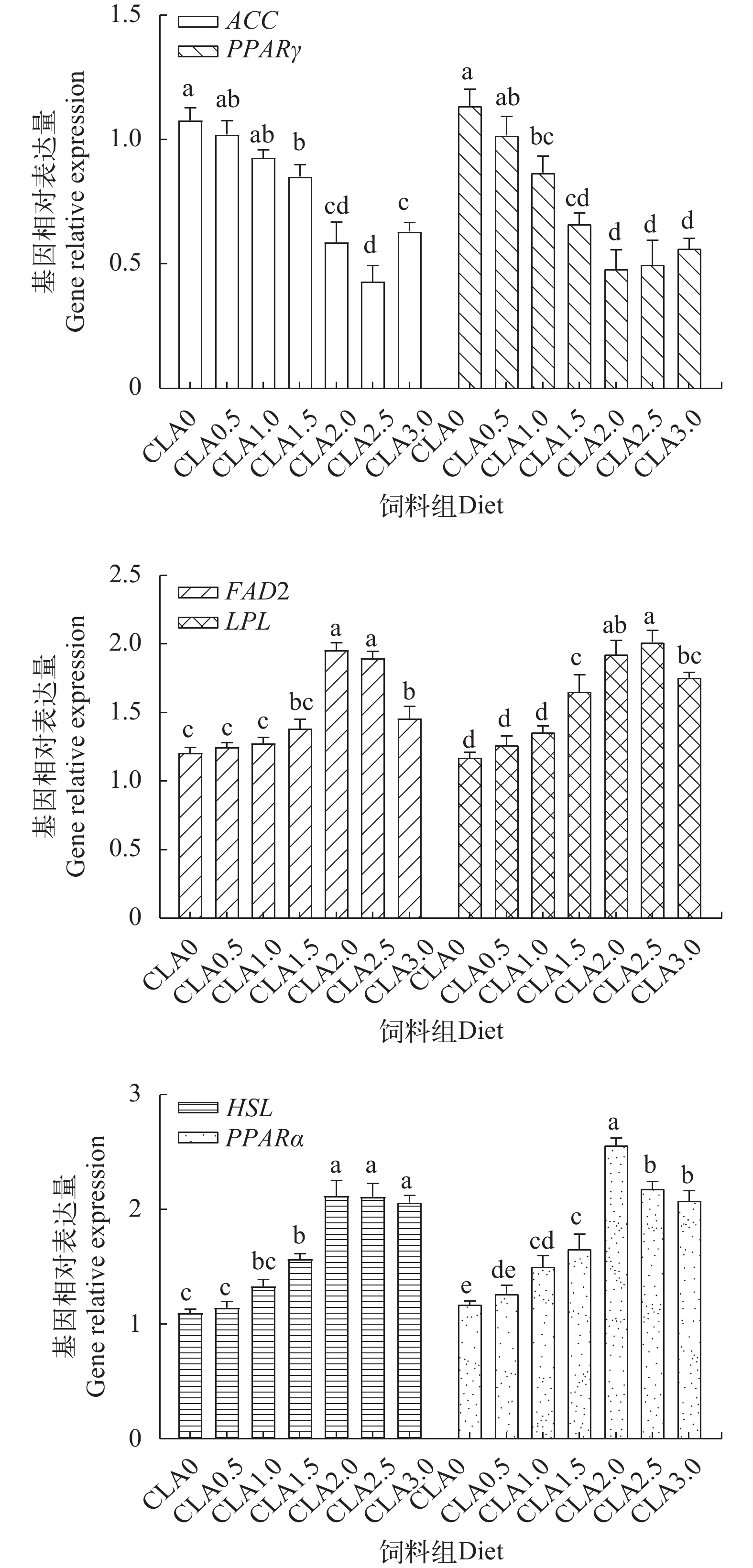
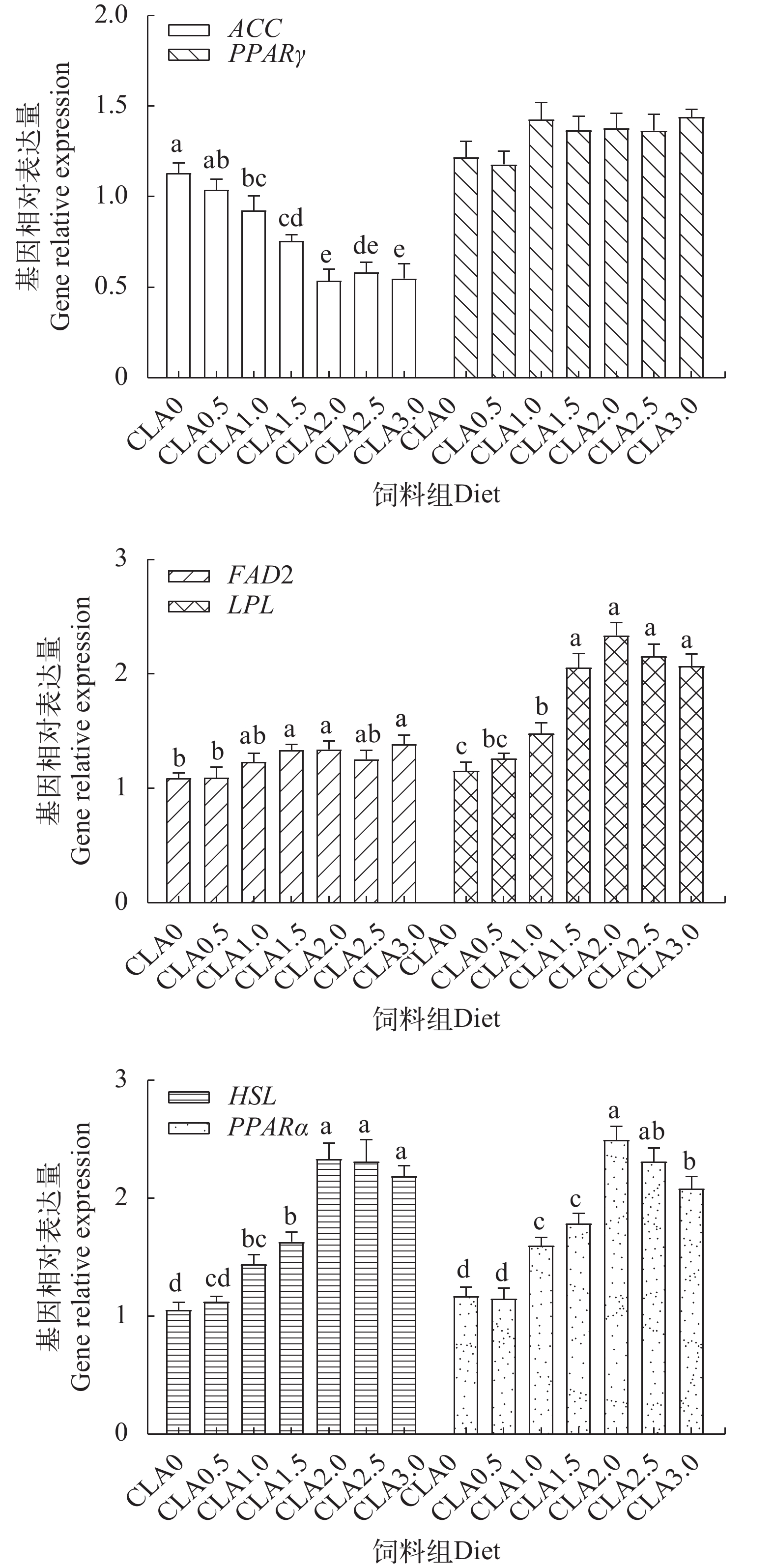
由图 3可知, 与对照组相比, 在CLA1.5-CLA3组肝脏中ACC mRNA表达显著下调(P<0.05), 而HSL mRNA表达显著上调(P<0.05), 且前者在CLA2.5组中达到最高, 而后者在CLA2-CLA3组降至最低; FAD2、LPL、PPARα mRNA分别在CLA2-CLA3组、CLA1.5-CLA2.5组和CLA1-CLA3组肝脏中显著上调表达(P<0.05), 而PPARγ mRNA在CLA1-CLA3组肝脏中显著下调表达(P<0.05), 且与对照组相比, 这4个基因mRNA表达量差异性分别在CLA2-CLA2.5、CLA2.5、CLA2和CLA2-CLA3组中最为显著。由图 4可知, 与对照组相比, 在CLA1-CLA3组肌肉中ACC mRNA表达显著下调(P<0.05), 而LPL、HSL和PPARα mRNA表达显著上调(P<0.05), 且依次在CLA2.5-CLA3、CLA1.5-CLA3、CLA2-CLA3和CLA2组肌肉中最为显著; 在CLA1.5-CLA2以及CLA3组肌肉中FAD2 mRNA表达量显著高于对照组(P<0.05), 而在CLA0.5-CLA3组肌肉中PPARγ mRNA表达无显著影响(P>0.05)。
2.4 饲料中CLA水平与其肝脏和肌肉中抗氧化酶活力以及脂肪代谢相关基因mRNA表达水平的相关性分析
饲料中CLA水平与其肝脏和肌肉中抗氧化酶类活力以及脂肪代谢相关基因mRNA表达水平的相关性分析分别见表 8—11。由表 8可知, 肝脏中所检测的5种酶中, GR活力和饲料中CLA水平呈负相关, 其他4种酶活力均和CLA水平呈正相关; 5种酶活力之间, 除GR与GPx、GR与T-AOC之间的酶活力呈负相关, 其他相关性均为正相关。饲料中CLA水平与肝脏中MDA含量呈负相关。由表 9可知, 在肌肉中所检测的5种酶中, GR活力和CLA水平呈负相关, 其他4种酶活力均和CLA水平呈正相关; 5种酶活之间, 除GR与CAT、GR与T-AOC之间的酶活力呈负相关, 其他相关性均为正相关。饲料中CLA水平与肌肉中MDA含量也呈显著负相关。由表 10可知, 在肝脏中所检测的6个基因(ACC、FAD2、LPL、HSL、PPARα和PPARγ) mRNA表达量中, ACCmRNA表达量和CLA水平呈负相关, 其余5个基因mRNA表达量均和CLA水平呈正相关。ACC与其他5个基因mRNA表达量均呈负相关, 而其他5个基因mRNA表达量之间相互均成正相关。由表 11可知, 在肌肉中, CLA水平和6个基因mRNA表达量互相之间的相关性与肝脏中的结果一致。
表 8 饲料中CLA水平与肝脏中抗氧化酶类活力、总抗氧化能力和丙二醛含量的相关性Table 8. Pearson correlations between dietary CLA level and the activity of antioxidant enzymes, T-AOC and MDA contents in the liver of grass carpCLA SOD CAT GPx GR T-AOC MDA CLA r 0.796a 0.791a 0.663a 0.204 0.806a −0.602a P 0.000 0.000 0.003 0.417 0.000 0.008 SOD r 0.872a 0.701a 0.202 0.844a −0.125 P 0.000 0.001 0.422 0.000 0.124 CAT r 0.702a 0.072 0.787a −0.216 P 0.001 0.776 0.000 0.635 GPx r −0.146 0.516a −0.314 P 0.564 0.028 0.545 GR r −0.017 −0.636 P 0.948 0.712 T-AOC r −0.354 P 0.217 MDA r P 注: “r”表示两个变量之间的相关系数, “−“表示两个变量之间负相关; a表示P<0.05, 有显著差异; 下同Note: “r” indicates correlation coefficient between the two variables; “−” indicates the negative correlation betweenthe two variables; a indicates the P value is significantly different at P<0.05; the same applies below 表 9 饲料中CLA水平与肌肉中抗氧化酶类活力、总抗氧化能力和丙二醛含量的相关性Table 9. Pearson correlations between dietary CLA level and the activity of antioxidant enzymes, T-AOC and MDA contents in the muscle of grass carpCLA SOD CAT GPx GR T-AOC MDA CLA r 0.624a 0.409 0.693a −0.197 0.232 −0.733a P 0.006 0.092 0.001 0.434 0.354 0.001 SOD r 0.143 0.523a 0.000 0.571a −0.247 P 0.572 0.026 0.999 0.013 0.124 CAT r 0.176 −0.313 0.166 −0.362 P 0.486 0.205 0.512 0.314 GPx r 0.028 0.458 −0.437 P 0.911 0.056 0.247 GR r −0.004 −0.334 P 0.988 0.627 T-AOC r P MDA r P 表 10 饲料中CLA水平与肝脏中脂肪代谢相关基因mRNA表达的相关性Table 10. Pearson correlations between dietary CLA level and mRNA levels in the liver of grass carpCLA ACC FAD2 LPL HSL PPARα PPARγ CLA r −0.818a 0.574a 0.768a 0.884a 0.746a −0.785a P 0.000 0.013 0.000 0.000 0.000 0.000 ACC r −0.790a −0.866a −0.875a −0.794a 0.751a P 0.000 0.000 0.000 0.000 0.000 FAD2 r 0.752a 0.795a 0.850a −0.786a P 0.000 0.000 0.000 0.000 LPL r 0.835a 0.821a −0.780a P 0.000 0.000 0.000 HSL r 0.863a −0.917a P 0.000 0.000 PPARα r −0.765a P 0.000 PPARγ r P 表 11 饲料中CLA水平与肌肉中脂肪代谢相关基因mRNA表达的相关性Table 11. Pearson correlations between dietary CLA level and mRNA levels in the muscle of grass carpCLA ACC FAD2 LPL HSL PPARα PPARγ CLA r −0.843a 0.525a 0.752a 0.857a 0.777a 0.399 P 0.000 0.025 0.000 0.000 0.000 0.101 ACC r −0.458 −0.699a −0.877a −0.849a −0.270 P 0.056 0.001 0.000 0.000 0.279 FAD2 r 0.613a 0.326 0.462 0.119 P 0.007 0.186 0.053 0.639 LPL r 0.795a 0.850a 0.334 P 0.000 0.000 0.176 HSL r 0.940a 0.408 P 0.000 0.093 PPARα r 0.342 P 0.165 PPARγ r P value 3. 讨论
本实验参考NRC[21]草鱼营养需求和Du等[22]配制粗蛋白含量为36%, 粗脂肪含量为4.5%等氮等脂饲料, 其中, 采用仅含饱和脂肪酸的椰子油替代CLA, 确保每组饲料粗脂肪含量一致, 并添加必需脂肪酸(1%亚油酸和0.5%亚麻酸)以满足其必需脂肪酸需求。经过65d的生长实验, 对照组实验鱼[体重为(5.08±0.08) g]的特定生长率约为2.11%/d, 高于Du等[22]已报道的草鱼特定生长率(摄食4%粗脂肪含量的精制饲料70d后, SGR约为1.30%/d)。上述数据表明, 本实验的饲料配方完全可满足草鱼正常生长的需求, 且本饲料配方适合用来研究CLA可否降低肝脏和肌肉中脂肪积累。
3.1 饲料中不同CLA添加水平对草鱼肝脏和肌肉组织细胞学形态的影响
丁志丽等[23]研究发现, 日本沼虾(Macrobrachium nipponense)在摄入高于4.5% CLA时, 其肝胰腺中MDA (丙二醛)含量显著增加, 而MDA是机体脂质过氧化的重要标志之一[24]。因此, 高剂量的CLA可通过引起日本沼虾肝胰脏中MDA含量的增加, 进而引起机体脂质过氧化, 从而导致鱼体的氧化应激, 并最终导致鱼体的组织损伤。本研究发现, CLA3组草鱼肝组织细胞线粒体空泡化; 内质网肿胀; 肌细胞肌节结构松散, 肌原纤维降解, 这表明CLA3组草鱼肝细胞和肌细胞形态均受损。同时, 本研究也发现, CLA3组肝脏和肌肉中MDA含量显著高于其他各组。这可能是由于CLA添加水平过高, 导致CLA通过Δ6和Δ5脂肪酸去饱和酶合成花生四烯酸, 而花生四烯酸能通过抑制线粒体呼吸链中的复合酶的活性等多种途径诱导氧化应激, 产生活性氧自由基[25], 导致草鱼肝脏和肌肉细胞受损。因此, 结合2%CLA在不影响草鱼的生长和饲料利用, 且显著降低肝脏脂肪积累, 建议草鱼饲料CLA的添加量应低于3%, 以确保鱼体正常生长。
3.2 饲料中不同CLA添加水平对草鱼肝脏和肌肉中抗氧化酶类活力、总抗氧化能力和MDA含量的影响
鱼类在长期的进化过程中, 已发展出完备的抗氧化酶系统(如SOD、CAT、GPx和GR), 并能利用抗氧化物质(如维生素C、维生素E和GSH)来清除机体氧化还原反应产生的活性氧自由基, 如超氧阴离子自由基和羟自由基等, 减轻机体的氧化应激[26, 27], 以维持细胞结构和功能的完整性[28]。SOD是机体抵御氧化应激的第一道防线, 将活性氧自由基还原成H2O2[29]。CAT则能够将SOD的还原产物H2O2转化为H2O和O2, GPx能通过氧化还原性质清除H2O2和脂质过氧化物从而保护机体不受氧化损伤[30]。本研究表明, 在CLA1.5-CLA3组草鱼肝脏和肌肉中, SOD和GPx活力均显著高于对照组, 在CLA1-CLA3组肝脏中, CAT活力显著高于对照组, 而在肌肉中, CAT活力无显著差异。与本实验结果相似, 在规格为146.25 g的大黄鱼饲料中添加1%—4% CLA可显著提高其肝脏和肌肉中SOD活力[15]。同样, Huang等[31]研究表明, 在黄姑鱼(Nibea coibor)幼鱼饲料中添加0.5%—2% CLA可显著提高其肝脏SOD、CAT和T-AOC活力。然而, 丁志丽等[23]研究发现, 在饲料中添加2% CLA替代鱼油显著降低日本沼虾肝胰腺SOD和GPx活力, 这可能是由于饲料中CLA替代鱼油所致, 因为鱼油含有其他多不饱和脂肪酸, 如n-3PUFA和n-6PUFA, CLA替代鱼油后导致n-3和n-6脂肪酸比例失衡。然而, Fracalossi等[32]认为当机体n-3和n-6 PUFA比例达到一定平衡时, 机体才具有最佳免疫力, 因此CLA替代鱼油后反而引起日本沼虾肝胰腺SOD和GPx活力下降。
T-AOC是用于评估机体抗氧化系统抗氧化功能的综合性指标, 其大小反映机体应对外来胁迫的代偿能力和体内自由基的代谢情况[33]。与Huang等[31]研究结果相同, 在CLA1.5-CLA2.5组中, 草鱼肝脏和肌肉T-AOC活力显著上调。本研究表明, 这5种酶活力在肝脏中, T-AOC活力与CLA相关性最强, 而在5种酶活力之间, T-AOC活力与SOD相关性最强; 这5种酶活力在肌肉中, GPx与CLA活力相关性最强, 而在5中酶活力之间, GPx活力与SOD相关性最强, 这表明在肝脏和肌肉组织中, CLA对同一抗氧化酶的影响并不一致, 但对SOD活力均有较大影响, SOD在CLA发挥抗氧化功效中有至关重要的作用。由于CLA2组肝脏SOD、CAT、GPx、T-AOC和肌肉SOD、T-AOC活力上调均最为显著, 因此, CLA2组为可显著提高草鱼应对胁迫, 清除体内过氧化应激产物(如超氧离子、过氧化氢和丙二醛等)的能力, 有利于鱼体应对氧化应激, 减少损伤的CLA最适添加组。
3.3 饲料中不同CLA添加水平对草鱼肝脏和肌肉脂肪代谢相关基因mRNA表达的影响
动物体内的脂质积累是体外脂质的摄入, 参与体内脂质合成(包括脂肪酸从头合成, 如ACC和脂肪酸去饱和酶, 如FAD2)、脂蛋白转运(如LPL)、脂肪酸β氧化(如HSL)等关键酶和脂肪酸代谢相关的转录因子(如PPARα、PPARγ)共同调控的结果。ACC是催化乙酰CoA形成丙二酰辅酶A的限速酶, 参与脂肪酸从头合成[34]。本研究表明, CLA1.5-CLA3组草鱼肝脏和肌肉ACC mRNA表达量显著下调。上述结果与Zou等[19]1.5%—3% CLA显著降低草鱼肝脏和肌肉中脂肪积累一致。Dong等[18]研究表明, 在草鱼饲料中添加1.5%—3% CLA可显著降低其肝脏和肌肉ACC mRNA表达量, 这与本实验结果一致。鱼类和哺乳动物都缺乏Δ12和Δ15去饱和酶, 不能从头合成LC-PUFA, 因此FAD2作为鱼类LC-PUFA合成第一限速酶受到广泛关注[35]。在饲料中添加CLA可调节鱼类FAD2 mRNA表达, 然而即使是相同的鱼类其规格不同, 研究结果也可能存在差异。Kennedy等[36]研究表明在均重87.5 g的大西洋鲑饲料中添加CLA可显著提高其肝脏FAD2 mRNA表达量, 然而Leaver等[17]研究表明在均重为132 g大西洋鲑饲料中添加CLA对其肝脏FAD2 mRNA表达量无显著影响。与前者研究结果相似, 本研究结果显示, 在草鱼幼鱼饲料中添加2% CLA可显著提高其肝脏和肌肉FAD2 mRNA表达量, 促进了草鱼组织LC-PUFA合成。在哺乳动物上的研究发现, 用含1.5% CLA的日粮饲喂小鼠(Mus musculus) 21d后, 其组织FAD2 mRNA表达量也显著上调[37]。
从体外摄入的脂质经消化道消化吸收后进入肝脏, 再和体内合成的脂肪酸一起被脂蛋白转运到机体各个组织分解供能或储存, 而LPL可将载脂蛋白分解成脂肪酸和单酰甘油酯, 再通过脂肪酸转运蛋白如CD36将细胞外的游离脂肪酸转运到细胞内分解供能或重新合成甘油三酯, 因此, LPL基因表达水平与机体营养状况、激素水平和组织对脂肪酸需求相关[34]。Dong等[18]研究表明, 在草鱼饲料中添加2.5% CLA可显著上调肝脏和肌肉LPL mRNA表达, 推测饲料中添加2.5% CLA导致草鱼通过增加脂肪酸β氧化将摄入的脂质分解为机体供能而非储存在组织内, 与之相对应, 2.5% CLA组草鱼肝脏和肌肉脂肪含量显著低于对照组。与上述实验结果相似, 本研究结果表明, CLA1.5-CLA2.5组草鱼肝脏和肌肉LPL mRNA表达量显著高于对照组, 同样可能是草鱼摄入CLA后导致机体脂肪酸β氧化能力增强所致, 从而导致其显著将肝脏和肌肉中脂肪积累。
转运到组织分解供能的脂肪酸则需要β氧化相关的酶类参与其氧化分解过程, 而HSL是脂肪动员的主要限速酶, 与脂肪酸β氧化密切相关[38]。LaRosa等[39]研究发现, 用含0.5% t10, c12 CLA日粮饲喂C57BL/6J小鼠3d后, 其脂肪组织HSL基因表达显著高于对照组, 然而, 持续饲喂17d后, HSL基因表达又显著下调。本实验研究表明, CLA1.5-CLA2.5组中草鱼肝脏和肌肉HSL mRNA表达显著上调。与本实验结果一致, Dong等[18]研究表明, 用在草鱼饲料中添加2.5% CLA同样可显著上调肝脏和肌肉HSL mRNA表达。出现以上不同结果可能是种属不同, 对CLA的生理效应不同导致的。脂肪代谢需要其代谢相关酶参与, 其基因表达受相应转录因子的调控。目前研究表明, PPARα和PPARγ是脂肪代谢调节关键的转录调节因子之一, 前者与甘油三酯分解密切相关, 有研究表明PPARα是肝脏β氧化和微粒体ω氧化的主要调控者[40], 后者被配体活化后可增强存进脂肪酸储存基因的表达, 如FATP (脂肪酸转运蛋白)、CD36/FAT (CD36/脂肪酸异位蛋白酶)、脂肪酸结合蛋白等[41]。本实验研究表明, CLA1.5-CLA2.5组草鱼肝脏和肌肉PPARα mRNA表达量均显著上调, 肝脏PPARγ mRNA表达显著下调。Dong等[18]研究表明, 用2% CLA替代鱼油可显著上调肝脏和肌肉PPARα mRNA表达, 而PPARγ mRNA显著下调表达, 这与本实验结果一致。同样, 有研究表明, 在小鼠日粮中添加0.5% CLA可显著提高其肝脏和肌肉PPARα mRNA的表达量[42]; 用1% CLA替代LA可显著减低雄性ICR小鼠肝脏PPARγ1 mRNA的表达[43]。本研究表明, 在肌肉和肝脏的这6种基因表达量中, 均为ACC与CLA负相关最为显著, HSL与CLA正相关最为显著; 这6种基因表达量之间, ACC与HSL负相关最为显著, HSL与PPARα正相关最为显著; 在肝脏中ACC与PPARγ正相关最为显著, HSL与PPARγ负相关最为显著, 而在肌肉中HSL与ACC负相关互为最为显著。这表明在不同组织中, CLA对同一基因表达的影响并不一致, 在肝脏中, CLA可能主要调控PPARα、PPARγ、HSL和ACC mRNA表达量来调控脂质代谢, 而在肌肉组织中, CLA可能主要调控PPARα、HSL和ACC mRNA表达量来调控脂质代谢。由于CLA2组肝脏和肌肉中FAD2、LPL、HSL和PPARα mRNA上调表达最为显著, 肝脏和肌肉ACC mRNA以及肝脏PPARγ mRNA表达下调最为显著, 因此, CLA2组为促进草鱼肝脏和肌肉脂肪分解代谢相关基因mRNA表达, 而抑制脂肪合成相关基因表达的CLA适宜添加组。综上所述, 结合2%CLA在不影响草鱼的生长和饲料利用, 且显著降低肝脏脂肪积累, 且CLA2组为可显著提高草鱼应对胁迫, 清除体内过氧化应激产物的能力, 有利于鱼体应对氧化应激, 减少机体损伤; 同时CLA2组也可促进草鱼脂肪分解代谢相关基因mRNA表达, 而抑制脂肪合成相关基因表达, 从而有助于减少草鱼机体脂肪沉积, 降低脂肪肝形成的风险的CLA适宜添加组。
致谢:
感谢中国科学院武汉病毒研究所电镜服务中心张配在电镜样品制作和图片拍摄中提供的技术支持。
-
表 1 饲料配方和基本化学组成(g/100 g 干物质)
Table 1 Formulation and chemical composition of the experimental diets (g/100 g in dry matter)
原料 Ingredient 饲料 Diet CLA0 CLA0.5 CLA1 CLA1.5 CLA2 CLA2.5 CLA3 豆粕 Soybean meal (oil-extracted)a 48 48 48 48 48 48 48 菜籽粕 Rapeseed meal (oil-extracted)b 14 14 14 14 14 14 14 棉籽粕 Cottonseed meal (oil-extracted)c 11 11 11 11 11 11 11 α-淀粉 α-starch 8 8 8 8 8 8 8 玉米淀粉 Corn starch 7.69 7.69 7.69 7.69 7.69 7.69 7.69 矿物盐预混物 Mineral premixd 1 1 1 1 1 1 1 维生素预混物 Vitamin premixe 0.5 0.5 0.5 0.5 0.5 0.5 0.5 维生素C Vitamin Cf 0.1 0.1 0.1 0.1 0.1 0.1 0.1 椰子油 Coconut oilg 3 2.5 2 1.5 1 0.5 0 共轭亚油酸 CLAh 0 0.5 1 1.5 2 2.5 3 精炼亚油酸 Refined linoleic acidi 1 1 1 1 1 1 1 精炼亚麻酸 Refined linolenic acidj 0.5 0.5 0.5 0.5 0.5 0.5 0.5 氯化胆碱 Choline chloride 0.1 0.1 0.1 0.1 0.1 0.1 0.1 纤维素 Cellulose 5.11 5.11 5.11 5.11 5.11 5.11 5.11 化学组成(干物质) Chemical composition (in dry matter) 粗蛋白 Crude protein 36.02 36.24 36.3 35.98 36.08 36.11 36.25 粗脂肪 Crude lipid 4.52 4.48 4.50 4.43 4.60 4.55 4.52 灰分 Ash 6.16 6.01 5.98 5.98 5.86 5.86 5.84 总能 Gross energy (kJ/g) 15.2 15.33 15.28 15.22 15.39 15.44 15.48 注: a豆粕: 安徽华谊农牧科技有限公司, 中国合肥; b菜籽粕: 安徽华谊农牧科技有限公司, 中国合肥; c棉籽粕: 安徽华谊农牧科技有限公司, 中国合肥; d矿物盐预混物: (mg/kg预混料, H440): NaCl, 500; MgSO4·7H2O, 7500; NaH2PO4·2H2O, 12500; KH2PO4, 16000; Ca(H2PO4)·2H2O, 10000; FeSO4, 1250; C6H10CaO6·5H2O, 1750; ZnSO4·7H2O, 176.5; MnSO4·4H2O, 81; CuSO4·5H2O, 15.5; CoSO4·6H2O, 0.5; KI, 1.5; starch, 225; e维生素预混物: (mg/kg预混料, NRC, 2011): 硫胺素, 20; 核黄素, 20; 吡哆醇, 20; 氰钴胺, 2; 叶酸, 5; 泛酸钙, 50; 肌醇, 100; 烟酸, 100; 生物素, 5; 淀粉, 3226; 维生素A (维生素A乙酸酯和维生素A棕榈酸酯, 1 鲶1), 110; 维生素D3 (胆钙化固醇), 20; 维生素E (dl-α-生育酚乙酸酯), 100; 维生素K3 (亚硫酸氢钠), 10; f维生素C: L-抗坏血酸-2-多磷酸酯, 35%抗坏血酸等价物, 北京桑普生化科技有限公司, 中国北京; g椰子油: SUPERCOCO, G.G. Alliance Pte Ltd, 菲律宾; h共轭亚油酸: 青岛澳海生物技术有限公司, 中国青岛; i精制亚油酸(LA): 西安康隆化工有限公司, 中国西安, 纯度> 98%; j精制亚麻酸(LNA): 西安康龙化工有限公司, 中国西安, 纯度>98%Note: aSoybean meal: Anhui Huayi Agr-livestock Technology Co., Ltd., Hefei, China; bRapeseed meal: Anhui Huayi Agr-livestock Technology Co., Ltd., Hefei, China; cCottonseed meal: Anhui Huayi Agr-livestock Technology Co., Ltd., Hefei, China; dMineral premix: (mg/kg premix:, H440): NaCl, 500; MgSO4·7H2O, 7500; NaH2PO4·2H2O, 12500; KH2PO4, 16000; Ca(H2PO4)·2H2O, 10000; FeSO4, 1250; C6H10CaO6·5H2O, 1750; ZnSO4·7H2O, 176.5; MnSO4·4H2O, 81; CuSO4·5H2O, 15.5; CoSO4·6H2O, 0.5; KI, 1.5; starch, 225; eVitamin premix (mg/kg diet, NRC, 2011): Thiamin, 20; riboflavin, 20; pyridoxine, 20; cyanocobalamine, 2; folic acid, 5; calcium pantothenate, 50; inositol, 100; niacin, 100; biotin, 5; starch, 3226; vitamin A (as vitamin A acetate and vitamin A palmitate, 1鲶1), 110; vitamin D3 (cholecalciferol), 20; vitamin E (dl-α-tocopherol acetate), 100; vitamin K3 (as menadione sodium bisulphite), 10; fVitamin C: L-ascorbyl-2-polyphosphate, 35% ascorbic acid equivalent, Beijing Sunpu Biochemical and Technology Co., Ltd., Beijing, China; gCoconut oil: SUPERCOCO, G.G. Alliance Pte Ltd, Philippines; hQINGDAO AUHAI Biotech. Co. Ltd., Qingdao, China; iRefined linoleic acid (LA): Xi’an Kanglong Chemical Industry Co., Ltd., Xi’an, China; purity>98%; jRefined linolenic acid (LNA): Xi’an Kanglong Chemical Industry Co., Ltd., Xi’an, China; purity>98% 表 2 脂肪原料(g/100 g油) 和饲料(g/100 g干物质)的脂肪酸组成
Table 2 Fatty acid compositions of oils (g/100 g of oil) and experimental diets (g/100 g in dry matter)
脂肪酸Fatty acid 饲料Diet 椰子油Coconut oil CLA oil CLA0 CLA0.5 CLA1 CLA1.5 CLA2 CLA2.5 CLA3 C8:0 6.7 - - - - - - - - C10:0 5.8 - - - - - - - - C12:0 50.78 - 1.5 1.25 1.01 0.75 0.51 0.25 0.03 C14:0 196 - 0.588 0.49 0.392 0.294 0.196 0.098 0.06 C16:0 82 0.5 0.246 0.207 0.169 0.13 0.09 0.0534 0.015 C18:0 - 0.5 - 0.02 0.01 0.05 0.03 0.06 0.01 ∑SFAa 91.08 1 2.334 1.967 1.581 1.224 0.826 0.4614 0.115 C16:1n-7 - - - - - - - - - C18:1n-9 - 2.5 - 0.012 0.021 0.032 0.053 0.022 0.061 C20:1 - - - - - - - - - C24:1n-9 - - - - - - - - - ∑MUFAb - 2.5 - 0.012 0.021 0.032 0.053 0.022 0.061 C18:2n-6 - - 1.02 1.01 0.99 0.98 1.05 0.14 1.03 C18:2 - 1.6 - 0.008 0.016 0.024 0.032 0.04 0.048 C18:2 - 46.5 - 0.233 0.465 0.6975 0.93 1.1625 1.395 C18:2 - 47.2 - 0.236 0.472 0.708 0.944 1.18 1.416 C18:3n-3 - - 0.495 0.490 0.501 0.489 0.510 0.499 0.500 C20:5n-3 - - - - - - - - - C22:6n-3 - - - - - - - - - ∑PUFAc - 95.3 1.515 1.977 2.444 2.899 3.466 3.922 4.389 n-3PUFAd - - 0.495 0.49 0.501 0.489 0.51 0.499 0.5 n-6PUFAe - - 1.02 1.01 0.99 0.98 1.05 1.04 1.03 n-3/n-6 - - 0.485 0.485 0.506 0.499 0.486 0.480 0.485 ∑CLAf - 93.7 - 0.469 0.937 1.406 1.874 2.343 2.811 注: “-”: 未检测出; a∑饱和脂肪酸, 总饱和脂肪酸: C8:0, C10:0, C12:0, C14:0, C16:0, C18:0; b∑单不饱和脂肪酸, 总单不饱和脂肪酸: C16:1n-7, C18:1n-9, C20:1, C24:1n-9; c∑多不饱和脂肪酸, 总多不饱和脂肪酸: C18:2n-6, C18: 2 Cis-9 and Cis-12, C18:2 Cis-9 and Trans-11, C18: 2 Trans-10 and Cis-12, C18: 3n-3, C20: 5n-3, C22: 6n-3; dn-3多不饱和脂肪酸: C18: 3n-3, C20: 5n-3 and C22: 6n-3总量; en-6多不饱和脂肪酸: C18: 2n-6总量; f∑共轭亚油酸, 总共轭亚油酸: C18: 2 Cis-9 and Trans-11; C18: 2 Trans-10 and Cis-12Note: “-”: not detected; a∑SFA, total saturated fatty acids: C8:0, C10:0, C12:0, C14:0, C16:0, C18:0; b∑MUFA, total monoun-saturated fatty acids: C16:1n-7, C18:1n-9, C20:1, C24:1n-9; c∑PUFA, total polyunsaturated fatty acids: C18:2n-6, C18: 2 Cis-9 and Cis-12, C18: 2 Cis-9 and Trans-11, C18: 2 Trans-10 and Cis-12, C18: 3n-3, C20: 5n-3, C22: 6n-3; dn-3PUFA: the sum of C18: 3n-3, C20: 5n-3 and C22: 6n-3; en-6PUFA: the sum of C18: 2n-6; f∑CLA, total conjugated linoleic acid: C18: 2 Cis-9 and Trans-11; C18: 2 Trans-10 and Cis-12 表 3 实时荧光定量PCR(qRT-PCR)引物序列
Table 3 Primers used for real-time quantitative PCR (qRT-PCR)
基因Gene 正向引物Forward primer 反向引物Reverse primer PPARα TCAGGATACCACTATGGAGTTCAC TACAGCGGCGTTCACACTTG PPARγ CGCTCATCTCCTACGGTCAG ATGTCGCTGTCGTCCAACTC FAD2 AGGTCTTCTCTTGGTACTTGACTCC GCACCATCTCTTCCCCACA LPL ATTGTGGTGGACTGGTTG CTACATGAGCACCAAGACTG ACC TGGCTGCACTGCACTCTCACT GGTCCAGCTTCCCTGCGGTC HSL GTGGTCCAATCCTGCGTCAT CACAGGGCACTACAGTATGCTTCTA β-actin CGTGACATCAAGGAGAAG GAGTTGAAGGTGGTCTCAT 表 4 饲料中共轭亚油酸对生长和饲料利用的影响(平均值±标准误, n=3)*
Table 4 Effects of dietary CLA on growth and feed utilization of grass carp (mean ± SE, n = 3)*
指标Index 饵料Diet CLA0 CLA0.5 CLA1 CLA1.5 CLA2 CLA2.5 CLA3 SR1 98.89±1.11 97.78±1.11 100±0.0 97.78±2.22 98.89±1.11 96.67±1.93 97.78±1.11 IBW2 5.08±0.08 5.25±0.25 4.97±0.16 4.95±0.20 5.19±0.23 5.07±0.29 5.06±0.25 FBW3 25.96±0.41a 25.42±0.26a 26.82±0.57a 26.52±0.48a 25.94±0.49a 24.03±0.48b 23.45±0.46b FR4 2.59±0.03b 2.61±0.04ab 2.62±0.05ab 2.74±0.05a 2.62±0.03ab 2.37±0.03c 2.29±0.05c SGR5 2.11±0.05a 2.07±0.04ab 2.12±0.05a 2.10±0.05ab 2.08±0.05ab 1.95±0.03bc 1.86±0.04c FCE6 71.26±0.35a 70.23±0.61ab 71.54±0.58a 70.33±0.60ab 70.01±0.49ab 69.04±0.55b 68.85±0.47b PRE7 47.18±0.62a 47.10±0.41a 47.78±0.42a 46.80±0.50a 46.82±0.19a 44.23±0.61b 44.63±0.68b ERE8 41.53±0.53ab 41.32±0.79ab 42.06±0.82a 41.44±0.78ab 40.54±0.54ab 39.06±1.01bc 37.05±0.68c 注: 1存活率(SR, %) =100×终末实验鱼个数/初始实验鱼个数; 2初始体重; 3终末体重; 4摄食率(FR, % /d) = 100% ×饲料摄入量(干物质, g)/天数× {[初始体重(湿重, g) +终末体重(湿重, g)]/2}; 5特定生长率(SGR, %/d) = 100% × [ln终末体重(湿重, g) –ln初始体重(wet weight, g)]/天数; 6饲料转化效率(FCE, %) = 100% × [终末体重(湿重, g) – 初始体重(湿重, g)]/饲料摄入量(dry matter, g); 7蛋白储积率(PRE, %) = 100% × 鱼体蛋白储积量/蛋白摄入量(干物质, g); 8能量储积率(ERE, %) = 100% × 鱼体能量储积量/能量摄入量(干物质, kJ/g); *表中同行均值不同上标英文字母表示差异显著(P< 0.05); 下同Note: 1Survival rate (SR, %) =100×final fish number/initial fish number; 2IBW: Initial body weight; 3FBW: Final body weight; 4Feeding rate (FR, % /d) = 100% × feed intake (dry matter, g)/days × {[initial body weight (wet weight, g) + final body weight (wet weight, g)]/2}; 5Specific growth rate (SGR, %/d) = 100% × [ln final body weight (wet weight, g) – ln initial body weight (wet weight, g)]/days; 6Feed conversion efficiency (FCE, %) = 100% × [final body weight (wet weight, g) – initial body weight (wet weight, g)]/food intake (dry matter, g); 7Protein retention efficiency (PRE, %) = 100% × protein gain in fish/protein intake (dry matter, g); 8Energy retention efficiency (ERE, %) = 100% × energy gain in fish/energy intake (dry matter, kJ/g); *Means with the different superscripts within the same row are significantly different at P < 0.05; the same applies below 表 5 饲料中共轭亚油酸对草鱼全鱼组成和组织脂肪含量的影响(平均值±标准误, n = 3)
Table 5 Whole body composition and tissue lipid content of grass carp fed with the experimental diets (mean ± SE, n = 3)
指标 Index 饲料组 Diet 初始Initial CLA0 CLA0.5 CLA1 CLA1.5 CLA2 CLA2.5 CLA3 全鱼组成(g/100 g, 湿重) Whole body (g/100 g, wet weight) 干物质 Dry matter 18.77±0.12 23.02±0.24 22.70±0.33 23.28±0.29 22.60±0.35 22.67±0.41 22.75±0.39 22.78±0.13 粗蛋白 Crude protein 10.22±0.26 12.74±0.27 13.01±0.14 13.32±0.28 13.18±0.29 12.67±0.26 12.85±0.20 12.68±0.18 粗脂肪 Crude lipid 3.43±0.13 5.11±0.17 5.06±0.47 5.20±0.31 5.22±0.23 4.63±0.29 4.84±0.35 4.66±0.20 灰分 Ash 2.67±0.24 3.20±0.19 3.22±0.27 3.08±0.13 3.19±0.17 3.05±0.11 3.44±0.29 3.28±0.24 能量 Gross energy 3.03±0.15 4.28±0.19 3.34±0.32 3.56±0.32 3.58±0.34 3.63±0.29 3.73±0.26 3.55±0.28 脂肪含量(g/100 g, 湿重) Lipid content (g/100 g, wet weight) 肝脏 Liver 14.52±0.25a 14.36±0.08a 14.17±0.19a 13.26±0.22b 12.02±0.06c 10.94±0.04d 10.64±0.18d 腹腔脂肪 Intraperitoneal fat 32.31±0.25a 32.10±0.18a 31.12±0.25b 30.08±0.23c 29.19±0.14d 28.66±0.32d 28.48±0.32d 肌肉 Muscle 2.47±0.22a 2.26±0.12ab 2.22±0.10ab 1.94±0.07bc 1.86±0.02c 1.77±0.04c 1.73±0.04c 表 6 饲料中CLA对草鱼肝脏中抗氧化酶类活力、总抗氧化能力和丙二醛含量的影响(平均值±标准误, n=3)*
Table 6 Effects of dietary CLA on activity of antioxidant enzymes, T-AOC and MDA contents in the liver of grass carp (mean±SE, n=3)*
酶活力Enzyme activity CLA0 CLA0.5 CLA1 CLA1.5 CLA2 CLA2.5 CLA3 SOD (U/mg prot) 509.71±7.38d 529.30±16.05cd 544.77±11.94c 597.49±7.42b 638.89±8.90a 634.66±9.01a 612.38±5.10ab CAT (U/mg prot) 61.53±5.64b 60.57±6.10b 77.69±8.08b 100.57±10.69a 122.66±5.10a 116.17±4.38a 111.89±6.13a GPx (U/mg prot) 386.87±19.00c 402.72±11.99c 435.68±12.14bc 476.08±28.06ab 520.50±9.09a 471.50±29.62ab 501.95±12.04a GR (U/g prot) 5.50±0.36 5.59±0.60 5.44±0.53 5.59±0.52 5.80±1.06 5.94±0.54 4.33±0.68 T-AOC (U/mg prot) 4.74±0.26c 4.56±0.47c 5.90±0.52bc 6.35±0.56b 9.36±0.40a 9.40±0.31a 8.24±0.44a MDA (nmol/mg prot) 2.25±0.19b 2.19±0.17b 2.16±0.13b 1.64±0.10c 1.20±0.10c 2.93±0.18a 4.16±0.22a 表 7 饲料中CLA对草鱼肌肉中抗氧化酶类活力、总抗氧化能力和丙二醛含量的影响(平均值±标准误, n =3)*
Table 7 Effect of dietary CLA on activity of antioxidant enzymes, T-AOC and MDA contents in the muscle of grass carp (mean±SE, n=3)*
酶活力Enzyme activity CLA0 CLA0.5 CLA1 CLA1.5 CLA2 CLA2.5 CLA3 SOD (U/mg prot) 83.03±4.26d 86.40±3.52d 95.22±5.01cd 106.09±5.93bc 143.37±6.67a 114.12±4.13b 118.53±7.67b CAT (U/mg prot) 10.40±0.52 9.34±0.90 10.09±1.45 11.94±0.88 10.04±1.18 11.50±0.51 11.92±1.20 GPx (U/mg prot) 75.05±3.21c 76.72±3.08c 94.43±4.51b 102.43±6.61ab 111.69±6.26ab 116.21±7.29a 105.10±5.75ab GR (U/g prot) 2.15±0.20 2.34±0.53 2.40±0.38 1.96±0.46 2.33±0.45 1.99±0.45 1.97±0.44 T-AOC (U/mg prot) 1.73±0.28c 1.94±0.26c 2.43±0.37bc 3.16±0.29ab 3.67±0.25a 3.01±0.42ab 2.20±0.29bc MDA (nmol/mg prot) 1.96±0.28b 1.91±0.16b 1.88±0.18b 1.89±0.28b 1.75±0.28b 2.32±0.28b 3.42±0.26a 表 8 饲料中CLA水平与肝脏中抗氧化酶类活力、总抗氧化能力和丙二醛含量的相关性
Table 8 Pearson correlations between dietary CLA level and the activity of antioxidant enzymes, T-AOC and MDA contents in the liver of grass carp
CLA SOD CAT GPx GR T-AOC MDA CLA r 0.796a 0.791a 0.663a 0.204 0.806a −0.602a P 0.000 0.000 0.003 0.417 0.000 0.008 SOD r 0.872a 0.701a 0.202 0.844a −0.125 P 0.000 0.001 0.422 0.000 0.124 CAT r 0.702a 0.072 0.787a −0.216 P 0.001 0.776 0.000 0.635 GPx r −0.146 0.516a −0.314 P 0.564 0.028 0.545 GR r −0.017 −0.636 P 0.948 0.712 T-AOC r −0.354 P 0.217 MDA r P 注: “r”表示两个变量之间的相关系数, “−“表示两个变量之间负相关; a表示P<0.05, 有显著差异; 下同Note: “r” indicates correlation coefficient between the two variables; “−” indicates the negative correlation betweenthe two variables; a indicates the P value is significantly different at P<0.05; the same applies below 表 9 饲料中CLA水平与肌肉中抗氧化酶类活力、总抗氧化能力和丙二醛含量的相关性
Table 9 Pearson correlations between dietary CLA level and the activity of antioxidant enzymes, T-AOC and MDA contents in the muscle of grass carp
CLA SOD CAT GPx GR T-AOC MDA CLA r 0.624a 0.409 0.693a −0.197 0.232 −0.733a P 0.006 0.092 0.001 0.434 0.354 0.001 SOD r 0.143 0.523a 0.000 0.571a −0.247 P 0.572 0.026 0.999 0.013 0.124 CAT r 0.176 −0.313 0.166 −0.362 P 0.486 0.205 0.512 0.314 GPx r 0.028 0.458 −0.437 P 0.911 0.056 0.247 GR r −0.004 −0.334 P 0.988 0.627 T-AOC r P MDA r P 表 10 饲料中CLA水平与肝脏中脂肪代谢相关基因mRNA表达的相关性
Table 10 Pearson correlations between dietary CLA level and mRNA levels in the liver of grass carp
CLA ACC FAD2 LPL HSL PPARα PPARγ CLA r −0.818a 0.574a 0.768a 0.884a 0.746a −0.785a P 0.000 0.013 0.000 0.000 0.000 0.000 ACC r −0.790a −0.866a −0.875a −0.794a 0.751a P 0.000 0.000 0.000 0.000 0.000 FAD2 r 0.752a 0.795a 0.850a −0.786a P 0.000 0.000 0.000 0.000 LPL r 0.835a 0.821a −0.780a P 0.000 0.000 0.000 HSL r 0.863a −0.917a P 0.000 0.000 PPARα r −0.765a P 0.000 PPARγ r P 表 11 饲料中CLA水平与肌肉中脂肪代谢相关基因mRNA表达的相关性
Table 11 Pearson correlations between dietary CLA level and mRNA levels in the muscle of grass carp
CLA ACC FAD2 LPL HSL PPARα PPARγ CLA r −0.843a 0.525a 0.752a 0.857a 0.777a 0.399 P 0.000 0.025 0.000 0.000 0.000 0.101 ACC r −0.458 −0.699a −0.877a −0.849a −0.270 P 0.056 0.001 0.000 0.000 0.279 FAD2 r 0.613a 0.326 0.462 0.119 P 0.007 0.186 0.053 0.639 LPL r 0.795a 0.850a 0.334 P 0.000 0.000 0.176 HSL r 0.940a 0.408 P 0.000 0.093 PPARα r 0.342 P 0.165 PPARγ r P value -
[1] 中国渔业统计年鉴. 北京: 中国农业出版社. 2017, 25 Chinese Fishery Statistical Yearbook [M]. Beijing: Chinese Agricultural Press. 2017, 25
[2] 汪开毓, 苗常鸿, 黄锦炉, 等. 投喂高脂饲料后草鱼主要生化指标和乙酰辅酶A羧化酶1 mRNA表达的变化. 动物营养学报, 2012, 24(12): 2375—2383 doi: 10.3969/j.issn.1006-267x.2012.12.012 Wang K Y, Miao C H, Huang J L, et al. Changes in main biochemical indices and Acetyl-CoA Carboxylase 1 mRNA expression of crass carp fed a high-fat diet [J]. Chinese Journal of Animal Nutrition, 2012, 24(12): 2375—2383 doi: 10.3969/j.issn.1006-267x.2012.12.012
[3] 吴春艳. 垂盆草提取物对草鱼脂肪肝模型药效作用研究. 四川农业大学硕士论文, 成都. 2013 Wu C Y. The pharmacodynamic function study of Sedum sarmentosum extract in grass carp fatty liver model [D]. Thesis for Master of Veterinary. Sichuan Agricultural University, Chengdu. 2013
[4] Banni S. Conjugated linoleic acid metabolism [J]. Current Opinion in Lipidology, 2002, 13(3): 261—266 doi: 10.1097/00041433-200206000-00005
[5] Yang B, Chen H, Stanton C, et al. Review of the roles of conjugated linoleic acid in health and disease [J]. Journal of Functional Foods, 2015, 15: 314—325 doi: 10.1016/j.jff.2015.03.050
[6] Twibell R G, Watkins B A, Rogers L, et al. Effects of die-tary conjugated linoleic acids on hepatic and muscle li-pids in hybrid striped bass [J]. Lipids, 2000, 35(2): 155—161 doi: 10.1007/BF02664765
[7] Twibell R G, Watkins B A, Brown P B. Dietary conjuga-ted linoleic acids and lipid source alter fatty acid composition of juvenile yellow perch, Perca flavescens [J]. The Journal of Nutrition, 2001, 131(9): 2322—2328 doi: 10.1093/jn/131.9.2322
[8] Tan X Y, Luo Z, Xie P, et al. Effect of dietary conjuga-ted linoleic acid (CLA) on growth performance, body composition and hepatic intermediary metabolism in juvenile yellow catfish Pelteobagrus fulvidraco [J]. Aquacul-ture, 2010, 310(1-2): 186—191 doi: 10.1016/j.aquaculture.2010.10.011
[9] Choi B D, Kang S J, Ha Y L, et al. Accumulation of Conjugated Linoleic Acid (CLA) in Tissues of Fish Fed Diets Containing Various Levels of CLA [M]. Quality Attri-butes of Muscle Foods. 1999, 61–67
[10] Twibell R G, Wilson R P. Effects of dietary conjugated linoleic acids and total dietary lipid concentrations on growth responses of juvenile channel catfish, Ictalurus punctatus [J]. Aquaculture, 2003, 221(1): 621—628
[11] Figueiredo-Silva A C, Rema P, Bandarra N M, et al. Effects of dietary conjugated linoleic acid on growth, nutrient utilization, body composition, and hepatic lipogenesis in rainbow trout juveniles (Oncorhynchus mykiss) [J]. Aquaculture, 2005, 248(1): 163—172
[12] Makol A, Torrecillas S, Fernándezvaquero A, et al. Effect of conjugated linoleic acid on dietary lipids utilization, liver morphology and selected immune parameters in sea bass juveniles (Dicentrarchus labrax) [J]. Compa-rative Biochemistry & Physiology, 2009, 154(2): 179—187
[13] Makol A, Torrecillas S, Caballero M J, et al. Effect of long term feeding with conjugated linoleic acid (CLA) in growth performance and lipid metabolism of European sea bass (Dicentrarchus labrax) [J]. Aquaculture, 2012, 368—369(1): 129—137
[14] Zuo R T, Ai Q H, Mai K S, et al. Effects of conjugated linoleic acid on growth, non-specific immunity, antioxi-dant capacity, lipid deposition and related gene expression in juvenile large yellow croaker (Larmichthys crocea) fed soyabean oil-based diets [J]. British Journal of Nutrition, 2013, 110(7): 1220—1232 doi: 10.1017/S0007114513000378
[15] 赵占宇. 共轭亚油酸(CLA) 对大黄鱼脂肪代谢、免疫、肉品质及PPAR基因表达的影响. 浙江大学博士论文, 杭州. 2008 Zhao Z Y. Effects of conjugated linoleic acid on lipid metabolism, immunity, flesh quality and PPAR gene expression in large Yellow croaker [D]. Thesis for Doctor of Science. Zhejiang University, Hangzhou. 2008
[16] Kennedy S R, Campbell P J, Porter A, et al. Influence of dietary conjugated linoleic acid (CLA) on lipid and fatty acid composition in liver and flesh of Atlantic salmon (Salmo salar) [J]. Comparative Biochemistry & Physio-logy, 2005, 141(2): 168—178
[17] Leaver M J, Tocher D R, Obach A, et al. Effect of die-tary conjugated linoleic acid (CLA) on lipid composition, metabolism and gene expression in Atlantic salmon (Salmo salar) tissues [J]. Comparative Biochemistry and Physiology, 2006, 145(2): 258—267 doi: 10.1016/j.cbpa.2006.06.034
[18] Dong G F, Zou Q, Wang H, et al. Conjugated linoleic acid differentially modulates growth, tissue lipid deposition, and gene expression involved in the lipid metabolism of grass carp [J]. Aquaculture, 2014, 432(2): 181—191
[19] Zou Q, Yang Y O, Wei B H, et al. Effects of dietary conjugated linoleic acid on growth performance, tissue adipocytokine levels, and lipid metabolism of grass carp [J]. Aquaculture Nutrition, 2018. DOI: 10.1111/ANU.12, 815
[20] Bradford, M. A rapid sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding [J]. Analytical Biochemistry, 1976, 72(1—2): 248—254 doi: 10.1016/0003-2697(76)90527-3
[21] National Research Council (NRC) [M]. Nutrients Requirements of Fish and Shrimp. Washington DC: The National Academies Press. 2011, 109
[22] Du Z Y, Liu Y J, Tian L X, et al. Effect of dietary lipid level on growth, feed utilization and body composition by juvenile grass carp (Ctenopharyngodon idella) [J]. Aquaculture Nutrition, 2005, 11(2): 139—146 doi: 10.1111/anu.2005.11.issue-2
[23] 丁志丽, 孔有琴, 张易祥, 等. 共轭亚油酸对日本沼虾生长、抗氧化及脂质代谢的影响. 水产学报, 2017, 41(1): 123—133 Ding Z L, Kong Y Q, Zhang Y X, et al. Effects of dietary conjugated linoleic acid on growth, antioxidant capacity and lipid metabolism of Macrobrachium nipponense [J]. Journal of Fisheries of China, 2017, 41(1): 123—133
[24] Nogueira C W, Quinhones E B, Jung E A C, et al. Anti-inflammatory and antinociceptive activity of diphenyl diselenide [J]. Inflammation Research, 2003, 52(2): 56—63 doi: 10.1007/s000110300001
[25] 陶磊, 傅淑霞. 花生四烯酸与氧化应激的研究进展. 中国病理生理杂志, 2011, 27(11): 2233—2236 doi: 10.3969/j.issn.1000-4718.2011.11.039 Tao L, Fu S X. Progress on arachidonic acid and oxida-tive stress [J]. Chinese Journal of Pathophysiology, 2011, 27(11): 2233—2236 doi: 10.3969/j.issn.1000-4718.2011.11.039
[26] Rudneva I I. Blood antioxidant system of Black Sea elasmobranch and teleost [J]. Comparative Biochemistry and Physiology, 1997, 118(2): 255—260
[27] Martínez-Álvarez R M, Morales A E, Sanz A. Antioxidant defenses in fish: biotic and abiotic factors [J]. Reviews in Fish Biology & Fisheries, 2005, 15(1—2): 75—88
[28] 张克烽, 张子平, 陈芸, 等. 动物抗氧化系统中主要抗氧化酶基因的研究进展. 动物学杂志, 2007, 42(2): 153—160 doi: 10.3969/j.issn.0250-3263.2007.02.031 Zhang K F, Zhang Z P, Chen Y, et al. Antioxidant defense system in animals [J]. Chinese Journal of Zoology, 2007, 42(2): 153—160 doi: 10.3969/j.issn.0250-3263.2007.02.031
[29] Fridovich I. Superoxide Radical and Superoxide Dismutases [J]. Autoxidation in Food and Biological Systems, 1980, 64(1): 97—112
[30] 方春华, 乔琨, 刘智禹, 等. 海洋生物中抗氧化酶的研究进展. 渔业研究, 2016, 38(4): 331—342 Fang C H, Qiao K, Liu Z Y, et al. The research progress of antioxidant enzymes in marine organisms [J]. Journal of Fisheries Research, 2016, 38(4): 331—342
[31] Huang Y S, Lin Z D, Rong H, et al. Effects of conjugated linoleic acid on growth, body composition, antioxidant status, lipid metabolism and immunity parameters of juvenile Chu’s croaker, Nibea coibor [J]. Aquaculture Research, 2017, 49(1): 546—556
[32] Fracalossi D M, Lovell R T. Dietary lipid sources influence responses of channel catfish (Ictalurus punctatus) to challenge with the pathogen Edwardsiella ictaluri [J]. Aquaculture, 1994, 119(2): 287—298
[33] 崔惟东, 冷向军, 李小勤, 等. 虾青素和角黄素对虹鳟肌肉着色和肝脏总抗氧化能力的影响. 水产学报, 2009, 33(6): 987—995 Cui W D, Leng X J, Li X Q, et al. Effects of astaxanthin and canthaxanthin on pigmentation of Muscle and total antioxidant capacity of liver in rainbow trout (Oncorhynchus mykiss) [J]. Journal of Fisheries of China, 2009, 33(6): 987—995
[34] Funai K, Semenkovich C F. Skeletal muscle lipid flux: running water carries no poison [J]. American Journal of Physiology Endocrinology & Metabolism, 2011, 301(2): E245—E251
[35] 董小敬. 虹鳟、花鲈和大黄鱼Δ6脂肪酸去饱和酶调控差异的研究. 中国海洋大学博士论文, 青岛. 2015 Dong X J. Comparison study on regulation of Δ6 fatty acyl desaturase among rainbow trout, Japanese seabass and large yellow [D]. Thesis for Doctor of Agriculture. Ocean University of China, Qingdao. 2015
[36] Kennedy S R, Leaver M J, Campbell P J, et al. Influence of dietary oil content and conjugated linoleic acid (CLA) on lipid metabolism enzyme activities and gene expression in tissues of Atlantic salmon (Salmo salar L.) [J]. Lipids, 2006, 41(5): 423—436 doi: 10.1007/s11745-006-5116-4
[37] Takahashi Y, Kushiro M, Shinohara K, et al. Activity and mRNA levels of enzymes involved in hepatic fatty acid synthesis and oxidation in mice fed conjugated linoleic acid [J]. Biochimica et Biophysica Acta, 2003, 1631(3): 265—273 doi: 10.1016/S1388-1981(03)00038-6
[38] Lass A, Zimmermann R, Oberer M, et al. Lipolysis - A highly regulated multi-enzyme complex mediates the catabolism of cellular fat stores [J]. Progress in Lipid Research, 2011, 50(1): 14—27 doi: 10.1016/j.plipres.2010.10.004
[39] Larosa P C, Miner J, Xia Y, et al. Trans-10, cis-12 conjugated linoleic acid causes inflammation and delipidation of white adipose tissue in mice: a microarray and histological analysis [J]. Physiological Genomics, 2006, 27(3): 282—294 doi: 10.1152/physiolgenomics.00076.2006
[40] Pyper S R, Viswakarma N, Yu S, et al. PPARα: energy combustion, hypolipidemia, inflammation and cancer [J]. Nuclear Receptor Signaling, 2010, 8: e002
[41] Rosa R, Andrade A M, Bandarra N M, et al. Physiologi-cal and biochemical effects of conjugated linoleic acid and its use in aquaculture [J]. Reviews in Aquaculture, 2010, 2(2): 59—72 doi: 10.1111/(ISSN)1753-5131
[42] Peters J M, Park Y, Gonzalez F J, et al. Influence of conjugated linoleic acid on body composition and target gene expression in peroxisome proliferator-activated receptor α-null mice [J]. Biochimica et Biophysica Acta, 2001, 1533(3): 233—242 doi: 10.1016/S1388-1981(01)00155-X
[43] Ide T. Interaction of fish oil and conjugated linoleic acid in affecting hepatic activity of lipogenic enzymes and gene expression in liver and adipose tissue [J]. Diabetes, 2005, 54(2): 412—423 doi: 10.2337/diabetes.54.2.412
-
期刊类型引用(3)
1. 王文娟,孟骞骞,李美静,姚祖兵,王宇江,吴满瑭,张梦勤,王文秀. 日粮脂肪水平对鲤生长、血清生化指标、糖代谢及抗氧化能力的影响. 江苏农业学报. 2023(09): 1908-1916 .  百度学术
百度学术
2. 刘波,周群兰,缪凌鸿,梁化亮,孙存鑫,郑肖川,林艳,任鸣春,朱玲,戈贤平. 水产动物营养与免疫研究进展. 水产学报. 2022(10): 1761-1775 .  百度学术
百度学术
3. 邹朝霞,李影. 共轭亚油酸减少动物脂肪沉积的分子机制研究进展. 中国细胞生物学学报. 2021(10): 2061-2070 .  百度学术
百度学术
其他类型引用(7)



 下载:
下载: