EFFECTS OF CADMIUM ON IMMUNE RESPONSES of TWO C-TYPE LECTINS IN THE FRESHWATER CRAB SINOPOTAMON HENANENSE
-
摘要: C型凝集素是一类可以和糖类结合的蛋白质, 是先天性免疫系统中重要的模式识别受体。其中, 经典C型凝集素依赖Ca2+对糖类进行识别。Ca2+可作为细胞内第二信使, 参与多种信息传递。而重金属镉可导致细胞钙稳态失调, 干扰细胞内与Ca2+相关的信息传递。研究旨在探明镉胁迫对河南华溪蟹(Sinopotamon henanense) ShLec21和ShLec23两种C型凝集素免疫应答的影响。利用RACE方法, 克隆了ShLec21和ShLec23, 并进行了系统进化分析; 利用实时荧光定量PCR的方法, 研究了ShLec21和ShLec23的组织表达模式和镉联合嗜水气单胞菌(Aeromonas hydrophila)胁迫后肝胰腺和血淋巴中ShLec21和ShLec23表达模式。结果显示: ShLec21 cDNA全长863 bp, 编码152个氨基酸残基; ShLec23 cDNA全长681 bp, 编码164个氨基酸残基。ShLec21和ShLec23分别聚类为无脊椎动物的两个分支。ShLec21和ShLec23在血淋巴、鳃、肝胰腺、肠道、肌肉、卵巢和精巢中表达广泛, 但二者均主要在肝胰腺中表达。在胁迫条件下, 单独镉胁迫对肝胰腺和血淋巴中ShLec21和ShLec23表达量无显著影响; 在单独嗜水气单胞菌感染后, 肝胰腺中ShLec21和ShLec23表达量分别显著(P<0.05)与极显著(P<0.01)下调, 血淋巴中ShLec23表达量显著(P<0.05)下调; 而在镉胁迫后嗜水气单胞菌感染过程中,ShLec21和ShLec23表达量在肝胰腺和血淋巴中显著(P<0.05)或极显著(P<0.01)上调。研究结果表明, 河南华溪蟹ShLec21和ShLec23在响应嗜水气单胞菌感染过程中的表达, 在一定程度上能够被镉胁迫所上调。Abstract: C-type lectins are a type of proteins binding to carbohydrates and important pattern recognition receptors in the innate immune system. The classical C-type lectins recognize sugars in Ca2+-dependent manners. It is highly acknowledged that Ca2+ acts as a second messenger in the cell and participates in a variety of physiological and biochemical process. Heavy metal cadmium can lead to dysregulation of cellular calcium homeostasis and interfere with intracellular Ca2+-related information transmission. The aim of this study was to investigate the effects of cadmium stress on the immune responses of two types of lectins, ShLec21 and ShLec23, in the freshwater crab Sinopotamon henanense. The ShLec21 and ShLec23 cDNA were cloned by RACE method, and bioinformatic analysis was carried out. In addition to their constitutive expression in selected tissues, the stimulated expression of the two C-type lectins in hepatopancreas and hemolymph after the treatment of cadmium followed by Aeromonas hydrophila infection were detected. The results showed that ShLec21 cDNA was 863 bp in length that potentinally encoded 152 amino acid residues and ShLec23 cDNA was 681 bp in length that encoded 164 amino acid residues. ShLec21 and ShLec23 clustered into two branches of invertebrates. Both of ShLec21 and ShLec23 were widely expressed in hemolymph, gill, hepatopancreas, intestine, muscle, ovary and testis with highest level in hepatopancreas. Cadmium stress had no significant effect on the expression of ShLec21 and ShLec23 in hepatopancreas and hemolymph. Bacteria A. hydrophila infection significantly down-regulated the expression of ShLec21 (P<0.05) andShLec23 (P<0.01) in the hepatopancreas, and significantly (P<0.05) reduced the expression ofShLec23 in hemolymph. However, in the course of infection with A. hydrophila after cadmium stress, the expression levels of ShLec21 (P<0.05) andShLec23 (P<0.01) were significantly up-regulated in hepatopancreas and hemolymph. The results suggest that cadmium stress could upregulate the expression ofShLec21 and ShLec23 in response to A. hydrophila infection in a certain extent.
-
Keywords:
- Sinopotamon henanense /
- C-type lectin /
- Immune response /
- Cadmium /
- Aeromonas hydrophila
-
凝集素(Lectins)几乎存在于所有动物、植物、微生物等生物有机体[1]。动物凝集素分为C型、F型、I型、L型、M型、P型及R型等13个家族[2]。其中, C型凝集素(C-type lectin, CTL)是一类糖类识别蛋白, 至少含有一个识别糖基的结构域(Carbohyrate recognition domain, CRD), 被称为C型凝集素样结构域(C-type lectin domain, CTLD), 可特异性地结合异物表面的糖类分子, 在蛋白转运、细胞信号转导、病原识别及作为效应分子等生物过程中起重要作用[2—4]。大量研究证明, 虾蟹类CTL具有促进凝集、血细胞吞噬、血细胞包裹、激活酚氧化酶原系统及抗病菌等免疫功能[5—7]。目前, CTL已在凡纳滨对虾(Litopenaeus vannamei)[8]、罗氏沼虾(Macrobrachium rosenbergii)[9]、中华绒螯蟹(Eriocheir sinensis)[10, 11]和三疣梭子蟹(Portunus trituberculatus)[12]等多种虾蟹中成功克隆。CTL对病菌及其类似物胁迫会产生应答反应, 例如: 脂多糖能够上调中华绒螯蟹肝胰腺EsLecD的表达[13], 嗜水气单胞菌能够下调中华绒鳌蟹EsCTLDcp-2在肝胰腺中的表达[14], 副溶血弧菌(Vibrio parahemolyticus)可诱导拟穴青蟹(Scylla paramamosain) Sp-lectin3在储精囊和射精管中的表达以及Sp-lectin4在肝胰腺中的表达[15]。
镉是广泛存在于环境中的有毒有害物质[16]。研究表明, 镉可以诱导细胞发生氧化应激产生大量的活性氧, 直接引起DNA、蛋白质等生物大分子的氧化损伤, 引发细胞凋亡并致癌[17, 18]。本课题组前期研究表明, 镉胁迫能够对甲壳动物生殖系统[19, 20]、消化系统[21]、免疫系统[22, 23]等造成损害。河南华溪蟹(Sinopotamon honanense)仅有非特异性免疫系统, 对重金属污染敏感, 是研究重金属胁迫下先天性免疫的理想模型。研究证实, 镉能够对河南华溪蟹免疫系统产生影响, 例如: 镉胁迫能够降低河南华溪蟹血淋巴细胞总数, 对超氧化物歧化酶、酸性磷酸酶、碱性磷酸酶等免疫相关酶活力也有不同程度的影响[22], 镉胁迫能够上调河南华溪蟹肠道及鳃中Shtoll3在响应嗜水单胞菌感染过程中的表达[23]。Ca2+是细胞内的第二信使, 参与多种信息传递。细胞内局部Ca2+特异的时空分布影响着钙离子依赖性蛋白的功能和基因表达的模式。镉可导致细胞钙稳态失调, 干扰细胞内与Ca2+相关的信息传递。而镉胁迫后Ca2+依赖的河南华溪蟹CTL的应答如何? 对此, 目前尚未见相关的研究报道。
本研究在前期对河南华溪蟹转录组测序结果中鉴定的ShLec21与ShLec23部分序列基础上, 采用RACE方法克隆了2种CTL的cDNA全长; 采用实时荧光定量PCR方法, 研究了2种CTL的组织表达模式和单独镉胁迫及镉胁迫后再用细菌感染过程的中2种CTL的应答模式, 旨在为深入探索重金属胁迫对无脊椎动物先天性免疫系统的影响提供科学依据。
1. 材料与方法
1.1 实验材料
河南华溪蟹购自太原市五龙口海鲜市场, 体重1.9—3.5 g, 体长4.0—6.5 cm。在实验室经曝气自来水空腹饲养1周, 后喂食饲养1周, 实验前1天停止喂食。实验时, 取6只健康河南华溪蟹的血淋巴、鳃、肝胰腺、肠道、肌肉、卵巢以及精巢组织, 用于实时荧光定量PCR组织表达模式检测。
实验设置对照组(0 Cd), 低浓度镉处理组(7.25 mg/L Cd, 1/32LD50)和高浓度镉处理组(29 mg/L Cd, 1/8LD50)三个组, 每组8只。在镉处理7d后, 注射嗜水气单胞菌(4.8×104 cfu/mL, 1/4LD50)100 μL[23]。在整体处理24h后, 取血淋巴、肝胰腺, 用于实时荧光定量PCR检测不同浓度镉联合细菌胁迫后ShLec21和ShLec23基因的表达变化。
随机取健康河南华溪蟹, 用镉浓度14.5 mg/L染毒, 经3个不同时间段(1d、4d和7d)处理, 同时设对照组(即镉染毒0)。在每个时间段内又分为2个亚组: 亚组一注射0.85% 生理盐水100 μL, 亚组二注射嗜水气单胞菌(4.8×104 cfu/mL; 1/4LD50)100 μL[23]; 每亚组6只蟹。在处理12h后, 取血淋巴、肝胰腺, 以备后续实时荧光定量PCR检测不同时间镉联合细菌胁迫后基因表达变化之用。
1.2 实验方法
克隆河南华溪蟹ShLec21和ShLec23基因 取河南华溪蟹血淋巴、鳃、肝胰腺和肠道等组织器官, 提取总RNA, 构建SMART cDNA文库[23]。设计ShLec21与ShLec23的 3′RACE和5′RACE引物(表 1), 分别以5′-RACE-Ready cDNA和3′-RACE-Ready cDNA为模板, 进行巢式PCR。首轮PCR反应使用KOD-FX-Neo (TOYOBO, 货号: KFX-201), PCR扩增条件: 94℃ 2min; 98℃ 10s, 66℃ 30s, 68℃ 2min, 37个循环; 68℃ 7min。将首轮PCR扩增产物稀释100倍后作为模板, 使用Es Taq MasterMix(康维世纪, 货号: CW0690)进行第二轮PCR反应, 扩增条件: 94℃ 2min; 94℃ 30s, 66℃ 30s, 72℃ 3min, 37个循环; 72℃ 7min。RACE扩增产物经1.2%琼脂糖凝胶电泳分析, 切胶回收, 连接pMD19-T-simple载体, 转化Trans5α感受态细胞, 测序。最后, 对测序正确的序列进行拼接, 并设计引物(表 1), 使用KOD-FX-Neo进行PCR扩增。同上测序, 进行ShLec21和ShLec23全长验证。
表 1 引物名称及序列Table 1. Primers used in this study引物
Primer引物序列
Primer sequence (5′—3′)用途
UsageShLec21-F1 GCTAAAGTGACTGGCGACCT 实时荧光定量PCR ShLec21-R1 TCTCCTCACTTCCTCCCTCG 实时荧光定量PCR ShLec23-F1 GCTGACGTGCTTGAGTACCT 实时荧光定量PCR ShLec23-R1 GCACGTTGTCACATCCATCG 实时荧光定量PCR ShLec21-5outer TTCTCCTCACTTCCTCCCTCGGG 5′RACE-PCR ShLec21-5inner AGAAGCATTTGTCCGTCAGCCCA 5′RACE-PCR ShLec21-3outer ATGAAGTGGGCCGCGACTCTTAC 3′RACE-PCR ShLec21-3inner TGGGCTGACGGACAAATGCTTCT 3′RACE-PCR ShLec23-5outer CACAACCACGCCCCTTCATGATT 5′RACE-PCR ShLec23-5inner CATGATTTAGGTCTGTGGCGCCG 5′RACE-PCR ShLec23-3outer ACCACCAGCACGAGACAAAGCAA 3′RACE-PCR ShLec23-3inner GTGGACGTAACTGTCACCGGCAC 3′RACE-PCR ShLec21-F2 TGTGGGAGTGTCAACAGCACAGA 全长验证 ShLec21-R2 ACACAATTTCGAGTCTCCGGGGT 全长验证 ShLec23-F2 AGCACGAGACAAAGCAAAATCAT 全长验证 ShLec23-R2 TGCTTTCACTCATAACATCATGCT 全长验证 使用NCBI的BLAST工具(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对序列进行相似性分析, 使用ORF Finder程序(https://www.ncbi.nlm.nih.gov/orffinder/)对开放阅读框进行分析, 使用SMART (http://smart.embl-heidelberg.de/)在线软件预测结构域和信号肽, 使用PROSITE (http://prosite.expasy.org/prosite.html/)对二硫键进行预测, 使用ClustalX1.8.1进行多重序列比对; 使用MEGA 5.05软件以邻接法(neighbour-joining, NJ)构建系统进化树。
实时荧光定量PCR构建 克隆质粒pMD19-T-simple-ShLec21和pMD19-T-simple-ShLec23并进行质粒提取(表 1), 经微量分光光度计测定质粒浓度及纯度, 依据公式: 质粒拷贝数=(6.02×1023×质粒浓度)/[(2692+目的基因片段长度)×660][24], 计算出质粒拷贝数。将标准质粒用无菌水稀释成101—1010 copies/μL的10个梯度, 选取105、106、107、108、109和1010的6个梯度为模板, 以ShLec21和ShLec23特异性引物(表 1), 每个反应样本设置2个重复, 使用SYBR® Premix Ex TaqTMⅡ(TaKaRa, 货号: RR20A)进行实时荧光定量检测, 操作方法按照Lang等[25]描述进行。反应结束后根据结果绘制标准曲线。
取“材料与方法”中1.1健康河南华溪蟹血淋巴、鳃、肝胰腺、肠道、肌肉、卵巢和精巢, 以及不同处理条件的血淋巴和肝胰腺, 提取总RNA并反转录合成cDNA作为模板[23], 根据上述反应条件进行实时荧光定量反应。在反应结束后, 根据标准曲线, 计算得到ShLec21和ShLec23的准确拷贝数。采用GraphPad Prims 7绘图, 结果用平均值±标准差(Mean±SD)表示。采用SPSS17.0 进行Kruskal-Wallis非参数检验; 采用Mann-Whitney检验两组数据之间的统计学差异。*P<0.05表示差异显著,**P<0.01表示差异极显著。
2. 结果
2.1 河南华溪蟹ShLec21和ShLec23的克隆与序列分析
通过RACE PCR扩增, 得到河南华溪蟹ShLec21和ShLec23全长cDNA序列。其中, ShLec21全长863 bp, 包括120 bp的5′UTR、编码152 aa的长459 bp的开放阅读框及284 bp的3′UTR。ShLec23全长681 bp, 包括72 bp的5′UTR、编码164 aa的长495 bp的开放阅读框及114 bp的3′UTR。通过SMART预测, ShLec21含有19 aa的信号肽和130 aa的CTLD; ShLec23含有17 aa的信号肽和134 aa的CTLD。并且, ShLec21与ShLec23结构域CTLD中分别含有EPE与EPI糖基结合位点。另外, 通过多序列比对及PROSITE预测, ShLec21含有2个保守的半胱氨酸残基(Cys50和Cys149)形成一个二硫键; ShLec23含有4个保守的半胱氨酸残基(Cys59、Cys138、 Cys154和Cys162)形成两个二硫键。
2.2 河南华溪蟹ShLec21和ShLec23的系统进化分析
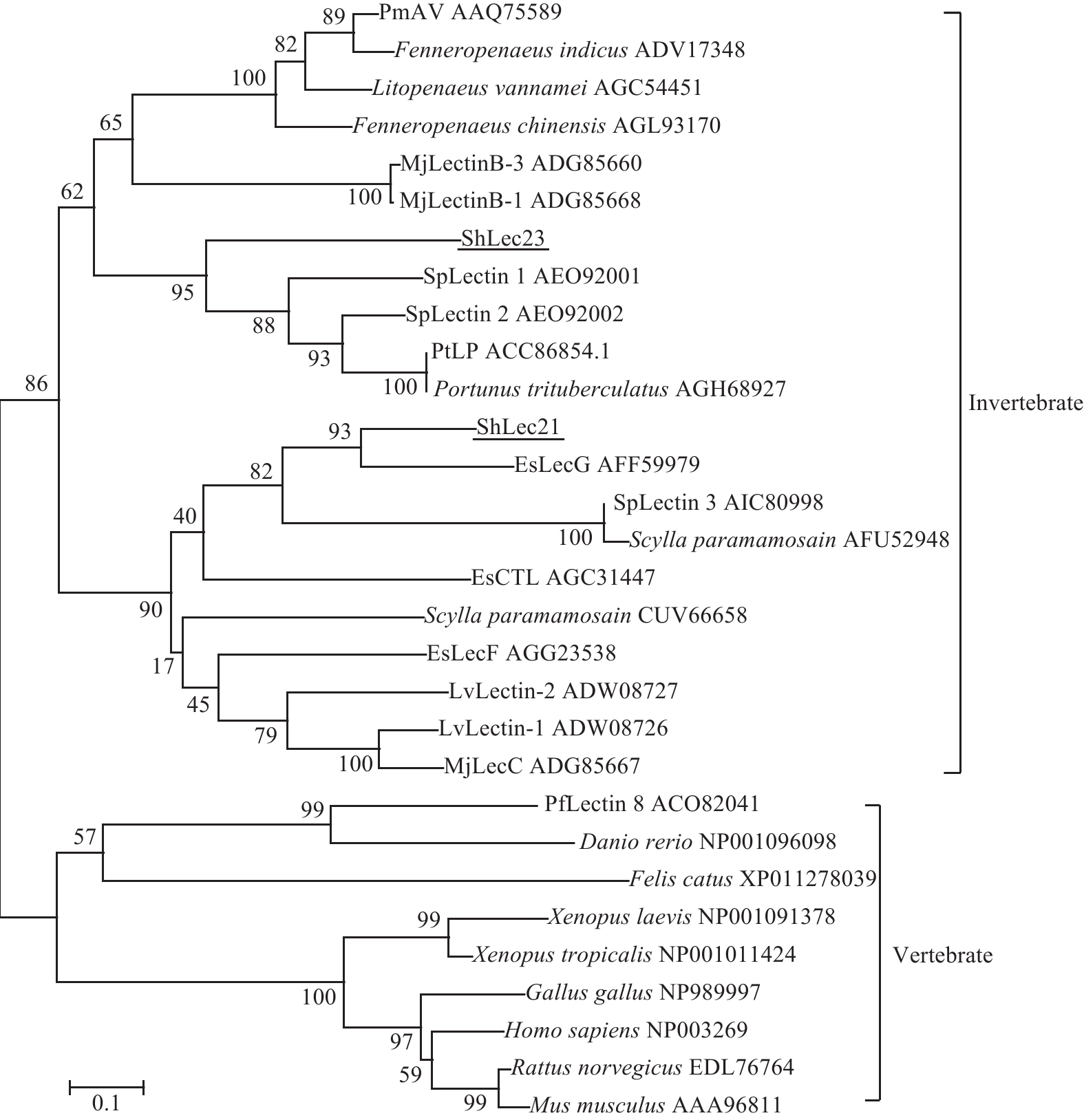
利用ClustalX1.8.1软件, 将河南华溪蟹ShLec21和ShLec23, 与中华绒螯蟹、三疣梭子蟹、拟穴青蟹及凡纳滨对虾的CTL的氨基酸进行序列多重比对。结果表明, ShLec21和ShLec23与其他虾蟹类CTL的CTLD结构域具有一定的保守性。ShLec21与中华绒螯蟹EsLecG的相似性为65%, ShLec23与三疣梭子蟹的PtLP相似性为48%。而ShLec21与ShLec23基因编码的氨基酸序列相似性仅为32%。分别选择不同的无脊椎动物和脊椎动物CTL的典型蛋白, 用NJ法构建CTL典型蛋白的系统进化树。结果显示, ShLec21和ShLec23分别与虾蟹类CTL聚类在无脊椎动物分支中两个不同的分支(图 1)。
2.3 河南华溪蟹ShLec21和ShLec23的组织表达模式
河南华溪蟹ShLec21和ShLec23的标准曲线分别为: Y= –3.4501X+35.371、Y= –3.3598X+35.419, 其中Y为CT值, X为起始模板数量。ShLec21与ShLec23标准曲线的回归系数R2, 分别为: 0.9985和0.9995; 扩增效率E, 分别为: 94.92%与98.44%。结果显示, ShLec21和ShLec23标准质粒在稀释浓度范围内存在良好的线性关系。
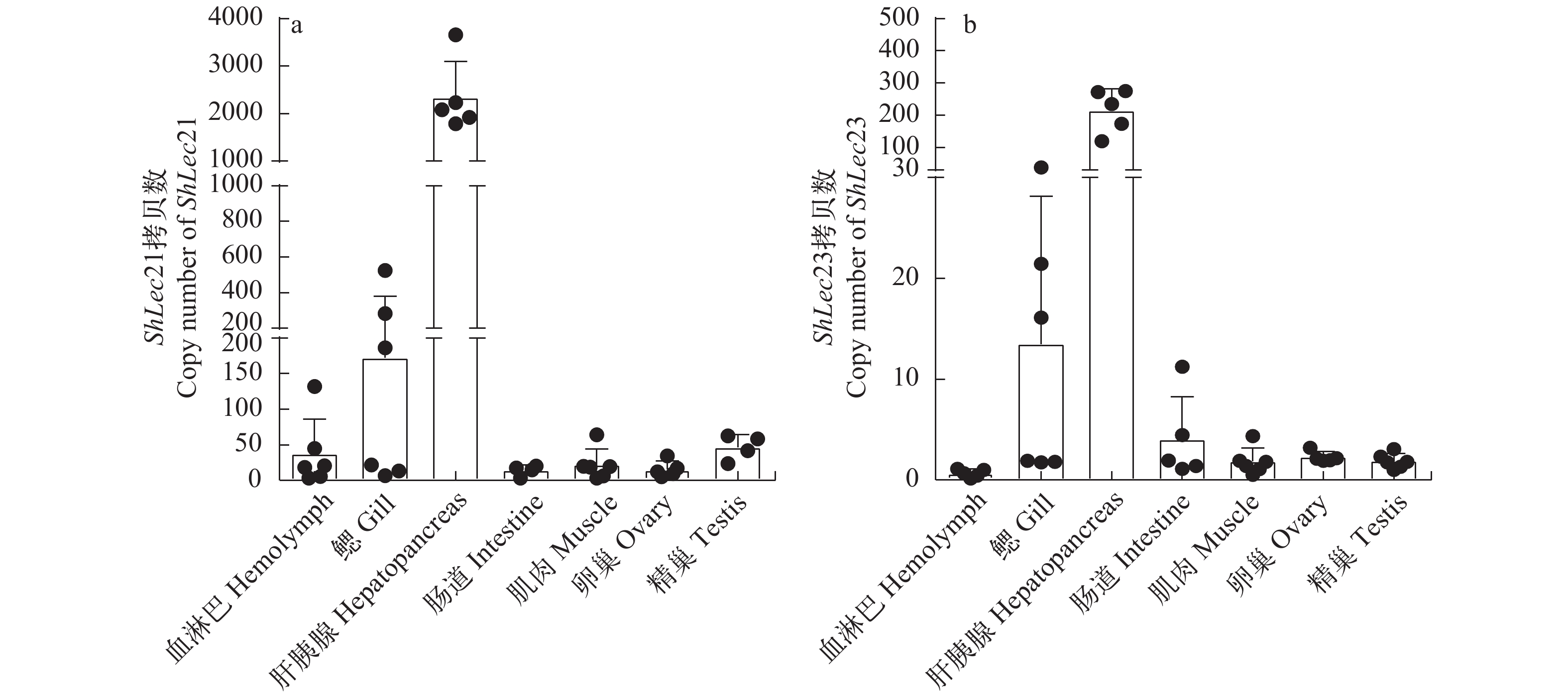
采用实时荧光定量PCR方法, 检测了河南华溪蟹ShLec21和ShLec23在血淋巴、鳃、肝胰腺、肠道、肌肉、卵巢和精巢7种组织器官中的表达情况。结果显示, ShLec21和ShLec23 主要在肝胰腺组织中表达, 在鳃组织中表达量较低, 而血淋巴、肠道、肌肉、卵巢和精巢组织中只有微量表达(图 2)。
2.4 镉胁迫对河南华溪蟹ShLec21和ShLec23应答变化的影响
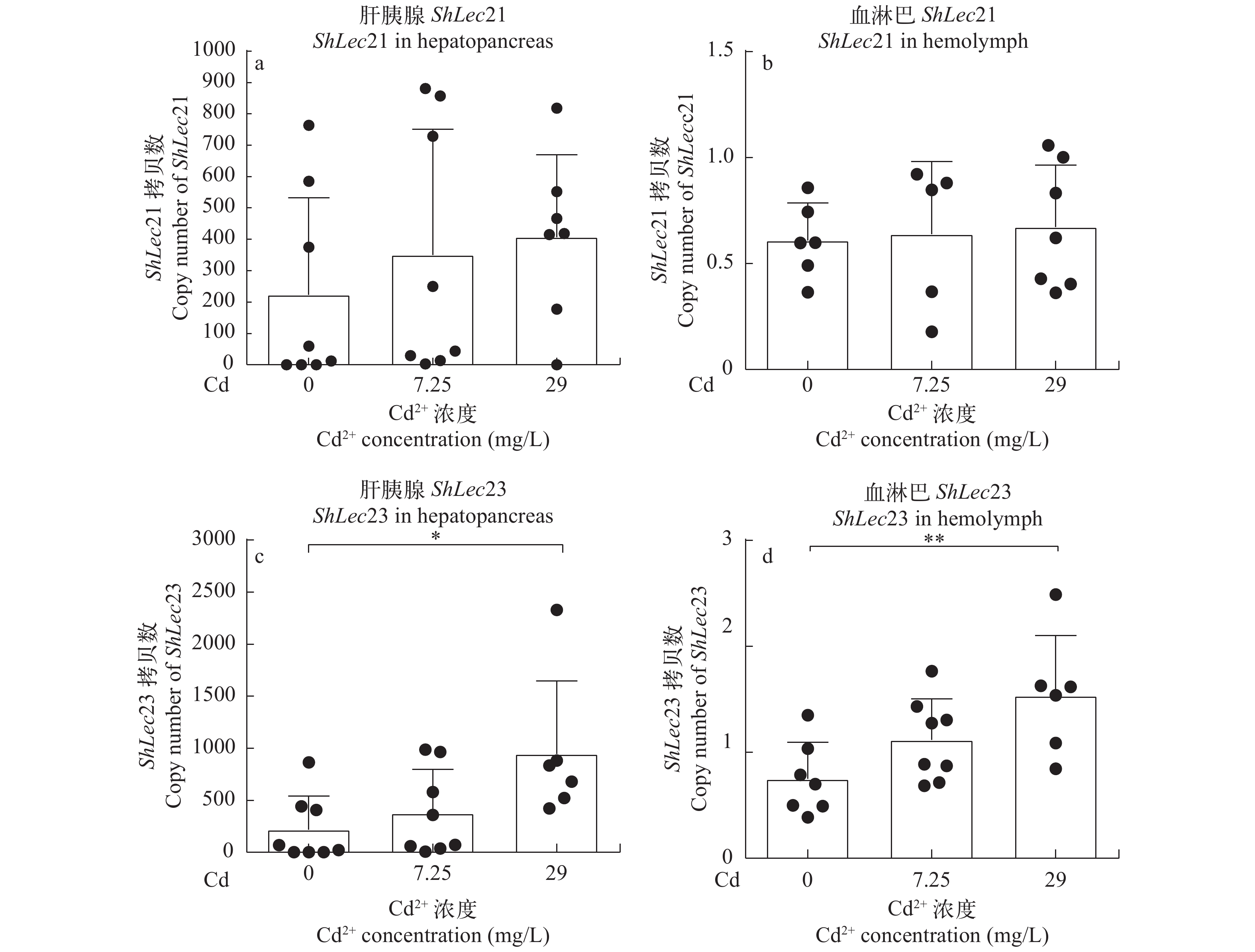
实时荧光定量PCR结果显示, 在镉处理河南华溪蟹并用嗜水气单胞菌感染过程中, 肝胰腺、血淋巴ShLec23在29 mg/L高浓度镉组中, mRNA表达量分别显著(P<0.05)与极显著(P<0.01)高于对照组的, 且存在明显的剂量-效应关系。而在肝胰腺、血淋巴中ShLec21在不同处理组之间的表达没有显著性差异(图 3)。
![]() 图 3 河南华溪蟹在不同浓度镉处理后再用嗜水气单胞菌感染肝胰腺和血淋巴中ShLec21和ShLec23 mRNA的表达模式0、7.25和29 mg/L浓度镉分别处理7d后注射100 μL1/4LD50嗜水气单胞菌感染24h; a. 肝胰腺ShLec21 mRNA表达; b. 血淋巴ShLec21 mRNA表达; c. 肝胰腺ShLec23 mRNA表达; d. 血淋巴ShLec23 mRNA表达。*P<0.05, **P<0.01Figure 3. Effects on ShLec21 and ShLec23 expression in hepatopancreas and hemolymph of S. henanense by different concentrations of cadmium subsequently infected by bacteria A. hydrophilaAfter treatment of different concentrations of cadmium (0, 7.25 and 29 mg/L) for 7d, 100 μL of1/4LD50 A. hydrophila was injected for 24h; a. ShLec21 mRNA expression in hepatopancreas; b. ShLec21 mRNA expression in the hemolymph; c. ShLec23 mRNA expression in the hepatopancreas; d. ShLec23 mRNA expression in the hemolymph; *P<0.05, **P<0.01
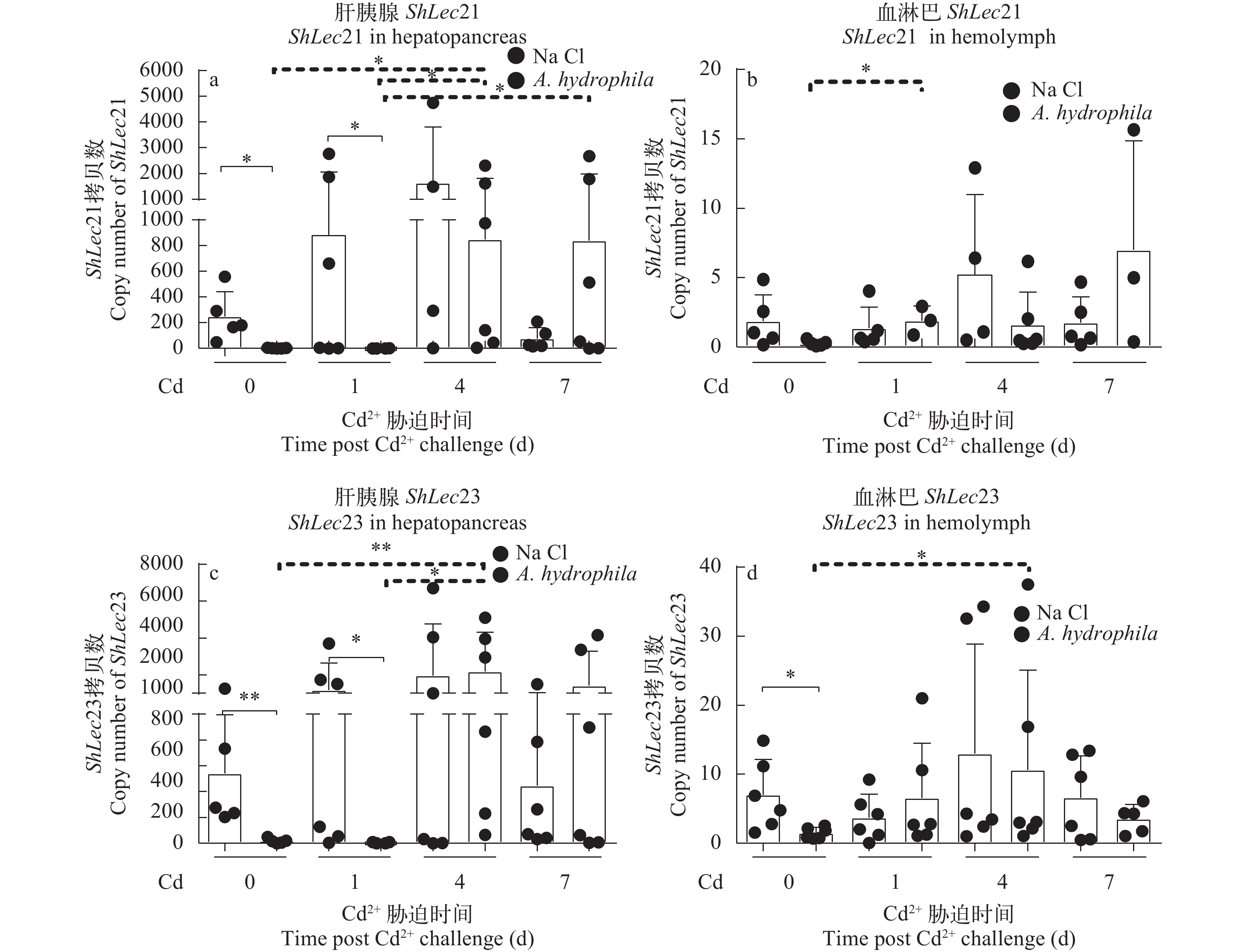
图 3 河南华溪蟹在不同浓度镉处理后再用嗜水气单胞菌感染肝胰腺和血淋巴中ShLec21和ShLec23 mRNA的表达模式0、7.25和29 mg/L浓度镉分别处理7d后注射100 μL1/4LD50嗜水气单胞菌感染24h; a. 肝胰腺ShLec21 mRNA表达; b. 血淋巴ShLec21 mRNA表达; c. 肝胰腺ShLec23 mRNA表达; d. 血淋巴ShLec23 mRNA表达。*P<0.05, **P<0.01Figure 3. Effects on ShLec21 and ShLec23 expression in hepatopancreas and hemolymph of S. henanense by different concentrations of cadmium subsequently infected by bacteria A. hydrophilaAfter treatment of different concentrations of cadmium (0, 7.25 and 29 mg/L) for 7d, 100 μL of1/4LD50 A. hydrophila was injected for 24h; a. ShLec21 mRNA expression in hepatopancreas; b. ShLec21 mRNA expression in the hemolymph; c. ShLec23 mRNA expression in the hepatopancreas; d. ShLec23 mRNA expression in the hemolymph; *P<0.05, **P<0.01如图 4a—b所示, 河南华溪蟹肝胰腺与血淋巴中ShLec21表达量, 在单独镉胁迫不同时间段(0、1d、4d和7d)无显著性差异; 在单独嗜水气单胞菌感染后(即单独镉染毒0), ShLec21表达量在肝胰腺组织中显著性下调(P<0.05); 但是, 在镉胁迫不同时间段(0、1d、4d和7d)后嗜水气单胞菌感染过程中,ShLec21在肝胰腺中的表达量在处理4d的较1d和对照组的显著性上调(P<0.05), 7d的较1d的呈显著性上调(P<0.05),ShLec21在血淋巴中的表达量在处理1d的较对照的显著性上调(P<0.05)。
![]() 图 4 河南华溪蟹镉胁迫不同时间再嗜水气单胞菌感染后肝胰腺和血淋巴中ShLec21和ShLec23 mRNA表达模式14.5 mg/L镉处理0、1d、4d和7d后, 注射100 μL1/4LD50嗜水气单胞菌12h, 对照组注射100 μL 0.85%生理盐水12h; a. 肝胰腺ShLec21 mRNA表达; b. 血淋巴ShLec21 mRNA表达; c. 肝胰腺ShLec23 mRNA表达; d. 血淋巴ShLec23 mRNA表达; *P<0.05,**P<0.01Figure 4. Effects of ShLec21 and ShLec23 expression in hepatopancreas and hemolymph of S. henanense by different treatment times of cadmium subsequently infected by bacteria A. hydrophilaAfter treatment of 14.5 mg/L cadmium for 0, 1, 4, and 7 days, 100 μL of 1/4LD50 A. hydrophila was injected for 12h, and the control group was injected with 100 μL of 0.85% saline for 12h; a. ShLec21 mRNA level in hepatopancreas; b. ShLec21 mRNA level in the hemolymph; c. ShLec23 mRNA level in the hepatopancreas; d. ShLec23 mRNA level in the hemolymph. *P<0.05, **P<0.01
图 4 河南华溪蟹镉胁迫不同时间再嗜水气单胞菌感染后肝胰腺和血淋巴中ShLec21和ShLec23 mRNA表达模式14.5 mg/L镉处理0、1d、4d和7d后, 注射100 μL1/4LD50嗜水气单胞菌12h, 对照组注射100 μL 0.85%生理盐水12h; a. 肝胰腺ShLec21 mRNA表达; b. 血淋巴ShLec21 mRNA表达; c. 肝胰腺ShLec23 mRNA表达; d. 血淋巴ShLec23 mRNA表达; *P<0.05,**P<0.01Figure 4. Effects of ShLec21 and ShLec23 expression in hepatopancreas and hemolymph of S. henanense by different treatment times of cadmium subsequently infected by bacteria A. hydrophilaAfter treatment of 14.5 mg/L cadmium for 0, 1, 4, and 7 days, 100 μL of 1/4LD50 A. hydrophila was injected for 12h, and the control group was injected with 100 μL of 0.85% saline for 12h; a. ShLec21 mRNA level in hepatopancreas; b. ShLec21 mRNA level in the hemolymph; c. ShLec23 mRNA level in the hepatopancreas; d. ShLec23 mRNA level in the hemolymph. *P<0.05, **P<0.01如图 4c—d所示, 河南华溪蟹肝胰腺和血淋巴中ShLec23表达量, 在单独镉胁迫不同时间段(0、1d、4d和7d)同样无显著性差异; 在单独嗜水气单胞菌感染后, ShLec23表达量在肝胰腺中表现为极显著(P<0.01)下调, 在血淋巴中表现为显著性下调(P<0.05); 但是, 在镉胁迫不同时间段(0、1d、4d和7d)后嗜水气单胞菌感染过程中,ShLec23在肝胰腺中的表达量镉处理4d的较1d的表现为显著性上调(P<0.05), 4d的较对照的表现为极显著性上调(P<0.01),ShLec23表达量在血淋巴中4d的较对照的显著性上调(P<0.05)。
3. 讨论
脊椎动物CTL蛋白家族具有高度保守性, 而无脊椎动物则呈现一定多样性。在结构上, CTL至少含有一个形成双环结构的CTLD结构域[26]。河南华溪蟹Shlec21和Shlec23均有一个CTLD, 与墨吉对虾(Fenneropenaeus merguiensis) FmLC2[27]、中华绒鳌蟹EsLecG[10]和三疣梭子蟹PtLP[12]的报道一致。而有的CTL中含有2个CTLD, 例如罗氏沼虾MrLec1、MrLec2、MrLec3及 MrLec4[28]。CTL双环结构的稳定主要依赖于4个保守的半胱氨酸形成的二硫键[29], Shlec23 CTLD含有4个保守的半胱氨酸(Cys59、Cys138、Cys154和Cys162), 形成2个二硫桥, 具有典型的双环结构。Shlec21则仅有2个保守的半胱氨酸残基(Cys50和Cys149)形成一个二硫桥, 没有典型的双环结构, 这方面还未见相关报道。CTL的CTLD中含有4个Ca2+结合位点, 其中Ca2+结合位点2可通过2个典型的基序参与对糖基的识别[29]。第一个基序为EPN (Glu-Pro-Asn), 或者QPD (Gln-Pro-Asp); 第二个基序为WND (Trp-Asn-Asp)。EPN与QPD位点分别识别甘露糖和半乳糖[29]。2个糖基识别基序常会出现变异, 例如EPD、EPK、EPS、EPQ、QPG、QPS、QPN、QPT、YPT、WHD、FND及MND等[2, 30], 或者在CTLD检测不到。在ShLec21与ShLec23中, 分别含有EPE (Glu-Pro-Glu)和EPI (Glu-Pro- Ile), 两者可能是EPN位点的变异, 替代EPN识别甘露糖。而EPE位点在中华绒鳌蟹EsLecG CTLD中也有发现[10]。另外, 系统进化结果表明, ShLec21和ShLec23虽然同属于无脊椎动物分支, 但是隶属无脊椎动物中不同的亚类。因此, 我们推测ShLec21和ShLec23在河南华溪蟹的先天性免疫中可能发挥不同的作用。
CTL具有不同的组织表达模式。凡纳滨对虾LvCTL3在肝胰腺、胃、幽门盲囊、上皮、肌肉、眼柄、柄节、肠、血细胞和鳃中广泛表达[31], 而中国对虾(Fenneropenaeus chinensis)Fclectin仅在血淋巴中有表达[32], 中华绒螯蟹EsCTLDcp、EsCTLD1、EsCTLD2及凡纳滨对虾LvLT仅在肝胰腺中表达[33, 34]。组织表达模式分析结果说明, 河南华溪蟹Shlec21和Shlec23在被检测组织中普遍表达, 但主要在肝胰腺中表达。
Shlec21和Shlec23是存在于河南华溪蟹中2种钙依赖活性的C型凝集素。为探明镉胁迫对Shlec21和Shlec23免疫应答的影响, 本文首先检测了河南华溪蟹不同浓度镉处理后再用细菌感染过程中, ShLec21和ShLec23在肝胰腺和血淋巴两个免疫组织中的应答变化。结果发现, 在高浓度镉胁迫7d再用嗜水气单胞菌感染后, ShLec23表达量在肝胰腺和血淋巴中显著性上调。之后我们研究了河南华溪蟹经镉胁迫不同时间段后再嗜水气单胞菌感染过程中, ShLec21和ShLec23在肝胰腺、血淋巴两个免疫组织中的应答变化。在本研究的胁迫条件下, 单独镉处理不同时间, 对肝胰腺、血淋巴中ShLec21和ShLec23表达量没有显著性影响; 而在不同时间镉胁迫河南华溪蟹后再细菌感染过程中, 肝胰腺和血淋巴中ShLec21和ShLec23 表达量在有些时间段上调。值得提到的是, 基因表达在胁迫时间维度上存在差异, 本研究结果也应考虑由于ShLec21和ShLec23表达在时间维度上存在的差异而对结果造成的影响。另外, 在本研究中嗜水气单胞菌能够下调ShLec21与ShLec23在肝胰腺或血淋巴中的表达(图 4), 这与中华绒鳌蟹肝胰腺EsCTLDcp-2[14]结果一致。总之, 本研究表明, 镉能够上调河南华溪蟹ShLec21和ShLec23响应嗜水气单胞菌感染过程中的表达, 在先天性免疫中具有一定的调节作用。
-
图 3 河南华溪蟹在不同浓度镉处理后再用嗜水气单胞菌感染肝胰腺和血淋巴中ShLec21和ShLec23 mRNA的表达模式
0、7.25和29 mg/L浓度镉分别处理7d后注射100 μL1/4LD50嗜水气单胞菌感染24h; a. 肝胰腺ShLec21 mRNA表达; b. 血淋巴ShLec21 mRNA表达; c. 肝胰腺ShLec23 mRNA表达; d. 血淋巴ShLec23 mRNA表达。*P<0.05, **P<0.01
Figure 3. Effects on ShLec21 and ShLec23 expression in hepatopancreas and hemolymph of S. henanense by different concentrations of cadmium subsequently infected by bacteria A. hydrophila
After treatment of different concentrations of cadmium (0, 7.25 and 29 mg/L) for 7d, 100 μL of1/4LD50 A. hydrophila was injected for 24h; a. ShLec21 mRNA expression in hepatopancreas; b. ShLec21 mRNA expression in the hemolymph; c. ShLec23 mRNA expression in the hepatopancreas; d. ShLec23 mRNA expression in the hemolymph; *P<0.05, **P<0.01
图 4 河南华溪蟹镉胁迫不同时间再嗜水气单胞菌感染后肝胰腺和血淋巴中ShLec21和ShLec23 mRNA表达模式
14.5 mg/L镉处理0、1d、4d和7d后, 注射100 μL1/4LD50嗜水气单胞菌12h, 对照组注射100 μL 0.85%生理盐水12h; a. 肝胰腺ShLec21 mRNA表达; b. 血淋巴ShLec21 mRNA表达; c. 肝胰腺ShLec23 mRNA表达; d. 血淋巴ShLec23 mRNA表达; *P<0.05,**P<0.01
Figure 4. Effects of ShLec21 and ShLec23 expression in hepatopancreas and hemolymph of S. henanense by different treatment times of cadmium subsequently infected by bacteria A. hydrophila
After treatment of 14.5 mg/L cadmium for 0, 1, 4, and 7 days, 100 μL of 1/4LD50 A. hydrophila was injected for 12h, and the control group was injected with 100 μL of 0.85% saline for 12h; a. ShLec21 mRNA level in hepatopancreas; b. ShLec21 mRNA level in the hemolymph; c. ShLec23 mRNA level in the hepatopancreas; d. ShLec23 mRNA level in the hemolymph. *P<0.05, **P<0.01
表 1 引物名称及序列
Table 1 Primers used in this study
引物
Primer引物序列
Primer sequence (5′—3′)用途
UsageShLec21-F1 GCTAAAGTGACTGGCGACCT 实时荧光定量PCR ShLec21-R1 TCTCCTCACTTCCTCCCTCG 实时荧光定量PCR ShLec23-F1 GCTGACGTGCTTGAGTACCT 实时荧光定量PCR ShLec23-R1 GCACGTTGTCACATCCATCG 实时荧光定量PCR ShLec21-5outer TTCTCCTCACTTCCTCCCTCGGG 5′RACE-PCR ShLec21-5inner AGAAGCATTTGTCCGTCAGCCCA 5′RACE-PCR ShLec21-3outer ATGAAGTGGGCCGCGACTCTTAC 3′RACE-PCR ShLec21-3inner TGGGCTGACGGACAAATGCTTCT 3′RACE-PCR ShLec23-5outer CACAACCACGCCCCTTCATGATT 5′RACE-PCR ShLec23-5inner CATGATTTAGGTCTGTGGCGCCG 5′RACE-PCR ShLec23-3outer ACCACCAGCACGAGACAAAGCAA 3′RACE-PCR ShLec23-3inner GTGGACGTAACTGTCACCGGCAC 3′RACE-PCR ShLec21-F2 TGTGGGAGTGTCAACAGCACAGA 全长验证 ShLec21-R2 ACACAATTTCGAGTCTCCGGGGT 全长验证 ShLec23-F2 AGCACGAGACAAAGCAAAATCAT 全长验证 ShLec23-R2 TGCTTTCACTCATAACATCATGCT 全长验证 -
[1] Sharon N, Lis H. History of lectins: from hemagglutinins to biological recognition molecules [J]. Glycobiology, 2004, 14(11): 53R
[2] Wang X W, Wang J X. Diversity and multiple functions of lectins in shrimp immunity [J]. Developmental & Comparative Immunology, 2013, 39(1-2): 27—38
[3] Wang X W, Wang J X. Pattern recognition receptors acting in innate immune system of shrimp against pathogen infections [J]. Fish & Shellfish Immunology, 2013, 34(4): 981—989
[4] Weis W I, Taylor M E, Drickamer K. The C-type lectin superfamily in the immune system [J]. Immunological Reviews, 1998, 163(1): 19—34
[5] Chen D D, Meng X L, Xu J P, et al. PcLT, a novel C-type lectin from Procambarus clarkii, is involved in the innate defense against Vibrio alginolyticus and WSSV [J]. Developmental & Comparative Immunology, 2013, 39(3): 255—264
[6] Junkunlo K, Prachumwat A, Tangprasittipap A, et al. A novel lectin domain-containing protein (LvCTLD) associated with response of the whiteleg shrimp Penaeus (Litopenaeus) vannamei to yellow head virus (YHV) [J]. Developmental & Comparative Immunology, 2012, 37(3-4): 334—341
[7] Luo T, Yang H, Li F, et al. Purification, characterization and cDNA cloning of a novel lipopolysaccharide-binding lectin from the shrimp Penaeus monodon [J]. Developmental & Comparative Immunology, 2006, 30(7): 607—617
[8] Costa F H, Valenca N S, Silva A R, et al. Cloning and molecular modeling of Litopenaeus vannamei (Penaeidae) C-type lectin homologs with mutated mannose binding domain-2 [J]. Genetics & Molecular Research, 2011, 10(2): 650—664
[9] Huang X, Li W, Jin M, et al. Single CRD containing lectin from Macrobrachium rosenbergii (MrLec) participates in innate immunity against pathogen infections [J]. Fish & Shellfish Immunology, 2016, 51: 282—290
[10] Jin X K, Li W W, Cheng L, et al. Two novel short C-type lectin from Chinese mitten crab, Eriocheir sinensis, are induced in response to LPS challenged [J]. Fish & Shellfish Immunology, 2012, 33(5): 1149—1158
[11] Fang Z Y, Li D, Li X J, et al. A single CRD C-type lectin from Eriocheir sinensis (EsLecB) with microbial-binding, antibacterial prophenoloxidase activation and hem-encapsulation activities [J]. Fish & Shellfish Immunology, 2016, 50: 175—190
[12] Kong H J, Park E M, Nam B H, et al. A C-type lectin like-domain (CTLD)-containing protein (PtLP) from the swimming crab Portunus trituberculatus [J]. Fish & Shellfish Immunology, 2008, 25(3): 311—314
[13] Guo X N, Jin X K, Li S, et al. A novel C-type lectin from Eriocheir sinensis functions as a pattern recognition receptor with antibacterial activity [J]. Fish & Shellfish Immunology, 2013, 35(5): 1554—1565
[14] Guo H Z, Zou P F, Fu J P, et al. Characterization of two C-type lectin-like domain (CTLD)-containing proteins from the cDNA library of Chinese mitten crab Eriocheir sinensis [J]. Fish & Shellfish Immunology, 2011, 30(2): 515—524
[15] 段利朋, 黄贝, 周立红, 等. 拟穴青蟹两种新C-型凝集素基因的克隆与表达分析. 水生生物学报, 2015, 39(2): 321—330 Duan L P, Huang B, Zhou L H, et al. Molecular cloning, characterization and expression of two novel lectins in mud crab, Scylla paramamosain [J]. Acta Hydrobiologica Sinica, 2015, 39(2): 321—330
[16] Kumar S R, Agrawal M, Marshall F. Heavy metal contamination of soil and vegetables in suburban areas of Varanasi, India [J]. Ecotoxicology & Environmental Safety, 2007, 66(2): 258—266
[17] Valko M, Izakovic M, Mazur M, et al. Role of oxygen radicals in DNA damage and cancer incidence [J]. Molecular and Cellular Biochemistry, 2004, 266(1/2): 37—56
[18] Zhan Q, Tang M. Research advances on apoptosis caused by quantum dots [J]. Biological Trace Element Research, 2014, 161(1): 3—12
[19] 侯宇华, 李娜, 李丹, 等. 镉对河南华溪蟹副性腺抗氧化酶活性及脂质、蛋白质和DNA的影响. 水生生物学报, 2015, 39(3): 621—626 Hou Y H, Li N, Li D, et al. Bioaccumulation of cadmium and its effects on antioxidant enzyme activities, lipid, protein and dna in male accessory gland of the freshwater crab Sinopotamon henanense [J]. Acta Hydrobiologica Sinica, 2015, 39(3): 621—626
[20] 杨健, 刘冬梅, 何永吉, 等. 镉对河南华溪蟹卵黄磷蛋白在卵巢中表达含量的影响及ELISA法的建立. 水生生物学报, 2015, 39(2): 287—293 Yang J, Liu D M, He Y J, et al. Established of elisa method of vitellin from freshwater crab Sinopotamon henanense and effect of cadmium on vitellin accumulation in ovary [J]. Acta Hydrobiologica Sinica, 2015, 39(2): 287—293
[21] 王茜, 郭鹄飞, 王兰. 镉对大型溞摄食能力和相关生理指标的影响. 水生生物学报, 2018, 42(3): 616—621 Wang Q, Guo H F, Wang L. Effect of cadmium on the feeding capacity and physiological status of Daphnia magna [J]. Acta Hydrobiologica Sinica, 2018, 42(3): 616—621
[22] Qin Q, Qin S, Wang L, et al. Immune responses and ultrastructural changes of hemocytes in freshwater crab Sinopotamon henanense exposed to elevated cadmium [J]. Aquatic Toxicology, 2012, (106–107): 140—146
[23] Lang L, Zhang Z, Jing W, et al. Identification of a novel toll gene (Shtoll3) from the freshwater crab Sinopotamon henanense and its expression pattern changes in response to cadmium followed by Aeromonas hydrophila infection [J]. Fish & Shellfish Immunology, 2017, 71: 177—190
[24] Li L, Zhao C P, Li H, et al. Establishment of the plasmid standard curve generation method for absolute quantification PCR [J]. Journal of Agricultural Biotechnology, 2011, 19(6): 1157—1162
[25] Lang X, Wang L, Zhang Z. Stability evaluation of reference genes for real-time PCR in zebrafish (Danio rerio) exposed to cadmium chloride and subsequently infected by bacteria Aeromonas hydrophila [J]. Aquatic Toxicology, 2016, 170: 240—250
[26] Robinson M J, Sancho D, Slack E C, et al. Myeloid C-type lectins in innate immunity [J]. Nature Immunology, 2006, 7(12): 1258—1265
[27] Runsaeng P, Thepnarong S, Rattanaporn O, et al. Cloning and the mRNA expression of a C-type lectin with one carbohydrate recognition domain from Fenneropenaeus merguiensis in response to pathogenic inoculation [J]. Molecular & Cellular Probes, 2015, 29(6): 365—375
[28] Ren Q, Li M, Du J, et al. Immune response of four dual-CRD C-type lectins to microbial challenges in giant freshwater prawn Macrobrachium rosenbergii [J]. Fish & Shellfish Immunology, 2012, 33(2): 155—167
[29] Zelensky A N, Gready J E. The C-type lectin-like domain superfamily [J]. FEBS Journal, 2005, 272(24): 6179—217
[30] Wang L, Wang L, Huang M, et al. The immune role of C-type lectins in molluscs [J]. Invertebrate Survival Journal, 2011, 8(2): 241—246
[31] Li M, Li C, Ma C, et al. Identification of a C-type lectin with antiviral and antibacterial activity from pacific white shrimp Litopenaeus vannamei [J]. Developmental & Comparative Immunology, 2014, 46(2): 231—240
[32] Liu Y C, Li F H, Dong B, et al. Molecular cloning, characterization and expression analysis of a putative C-type lectin (Fclectin) gene in Chinese shrimp Fenneropenaeus chinensis [J]. Molecular Immunology, 2007, 44(4): 598—607
[33] Huang Y, Huang X, Wang Z, et al. Function of two novel single-CRD containing C-type lectins in innate immunity from Eriocheir sinensis [J]. Fish & Shellfish Immunology, 2014, 37(2): 313—321
[34] Ma T H, Tiu S H, He J G, et al. Molecular cloning of a C-type lectin (LvLT) from the shrimp Litopenaeus vannamei: early gene down-regulation after WSSV infection [J]. Fish & Shellfish Immunology, 2007, 23(2): 430—437
-
期刊类型引用(2)
1. 刘忠华,陈洁,黄晓玲,涂淏天,梁海鹰. 镉胁迫对合浦珠母贝C型凝集素基因表达及部分生理指标的影响. 南方农业学报. 2024(11): 3414-3425 .  百度学术
百度学术
2. 汪笑宇,戴媛媛,贾磊,王群山,陈春秀. 全氟辛烷磺酸盐(PFOS)对半滑舌鳎(Cynoglossus semilaevis)免疫相关基因表达的影响. 生态毒理学报. 2020(02): 71-80 .  百度学术
百度学术
其他类型引用(2)



 下载:
下载: