EFFECTS OF DAILY PHOTOPERIOD ON FEED CONSUMPTION, DIGESTIVE ENZYME ACTIVITIES AND BLOOD HORMONE OF TURBOT SCOPHTHALMUS MAXIMUS L. JUVENILES
-
摘要: 研究了4种光照周期[24L﹕0D(D1)、16L﹕8D(D2)、8L﹕16D(D3)和0L﹕24D(D4)]对体重(30.5±2.0) g大菱鲆Scophthalmus maximus L.幼鱼20h (8:00am—4:00am)内摄食、消化酶活力、血清激素含量的影响。结果显示: (1)实验鱼的摄食率随光照时间的缩短而降低; D1组实验鱼每隔8h出现摄食高峰, 其他组均在8:00am及4:00pm出现摄食高峰。(2)D1、D2和D3组在12:00am和8:00pm出现肠道蛋白酶及淀粉酶活力峰值, 脂肪酶活力显著高于D4组(P<0.05)。(3)各组8:00am至8:00pm生长激素(GH)含量无显著变化, D1组4:00am时显著高于其他组(P<0.05), D4组0:00am及4:00am显著低于其他组(P<0.05); D1、D2和D3组初次摄食8h内皮质醇(COR)含量无显著变化, 8h后先升高后降低, D4组COR含量先升高后降低, 8:00pm时达到最高; D1和D2组0:00am时去甲肾上腺素(NE)含量显著高于其他组(P<0.05), D4组8:00pm时显著低于其他组(P<0.05); D2组8:00am及12:00am时三碘甲状原氨酸(T3)含量显著高于其他组(P<0.05), D4组8:00pm时显著低于其他组, 0:00am时显著高于其他组(P<0.05), D2和D3组4:00am显著低于D1和D4组(P<0.05), 各组T3最高值均出现在8:00pm。在实验条件下, 光照周期影响了大菱鲆幼鱼摄食、消化酶活力及血清激素含量。在此光照强度下, 大菱鲆养殖中以8—16h光照周期、日投喂2次为宜。Abstract: This study was conducted to investigate the effects of 4 kinds [24L﹕0D (D1), 16L﹕8D (D2), 8L﹕16D (D3), 0L﹕24D (D4)] of photoperiods on feed consumption, digestive enzyme activities and blood hormone of turbotScophthalmus maximus L. juveniles with initial body weight of (30.5±2.0) g in 20 hours (8:00am—4:00am). The results showed that the feed rate decreased with the shorten of illumination time, and feeding peak in D1 group appeared every 8h, meanwhile others appeared at 8:00am and 4:00pm. Activities of protease and amylase of former 3 groups were appeared spike at 12:00am and 8:00pm, and lipase was significantly higher than that of the D4 group. There were no difference of GH contents from 8:00am to 8:00pm among all groups, and D1 group at 4:00am was significantly higher than others, but D4 group was significantly lower than others from 0:00am to 4:00am. COR contents of D1, D2 and D3 groups were not significant difference in 8h after first feeding, and then increased firstly and decreased afterwards; D4 group reached the maximum level at 8:00pm. NE content of D1 and D2 groups were significantly higher than that of the others at 0:00am, meanwhile D4 group was significantly lower than others at 8:00pm. T3 content of D2 group was significantly higher than that of the other groups at 8:00am and 12:00am; D4 group was lower at 8:00pm, and higher at 0:00am than others; D2 and D3 group were lower than those of D1 and D4 group at 4:00am; The highest values of T3 of all groups were appeared at 8:00pm. These results demonstrated that feed intake, digestive enzyme activities and serum hormone contents of turbot juvenile were affected by photoperiod under current experimental conditions. 8—16 lighting period and feed twice daily would be recommended for turbot culture under this intensity of illumination.
-
Keywords:
- Turbot /
- Photoperiod /
- Feeding /
- Digestive enzyme /
- Hormone
-
光照是水生动物生长过程中重要的生态因子, 直接或间接影响其生长、摄食、存活及繁殖内分泌, 并通过影响“下丘脑-垂体-性腺”轴(HPGaxis), 影响血液中激素含量[1]。光照对水生动物生理的影响主要分为2种: 光照强度和光照周期。研究表明: 光照强度对乌鳢(Channa Argus)[2]、褐牙鲆(Paralichthys olivaceus)[3]等生长、繁殖均有显著影响; 光照周期影响了虹鳟(Oncorhynchus mykiss)幼鱼免疫系统发育[4], 黄花鱼(Miichthys miiuy)消化酶活力[5], 欧鲈(Perca fluviatilis)繁殖性能[6], 大菱鲆(Scophthatmus maximus)[7]、条石鲷(Oplegnathus fasciatus)[8]、大西洋鳕鱼(Gadus morhua)[9]等鱼类的生长性能。光照周期对水生动物生理生化的影响主要分为2种: 长光照周期和短光照周期。前者的相关研究主要集中在光周期的改变对生长、存活、免疫等方面的影响[4, 10]; 后者主要集中于光周期改变对激素等的影响, 如光照周期显著影响了大西洋鲑(Salmo salar)生长激素的分泌[11], 显著改变了白斑狗鱼(Esox lucius)耗氧率的昼夜节律[12]。
激素(Hormone)是由高度分化的内分泌细胞合成并直接分泌入血的化学信息物质, 它通过调节各种组织细胞的代谢活动来影响动物的生理活动, 对机体的代谢、生长、发育、繁殖和性别等起重要的调节作用。激素不参加具体的代谢过程, 只对特定的代谢和生理过程起调节作用, 调节代谢及生理过程的进行速度和方向, 从而使机体的活动更适应于内外环境的变化。Björn等[11]报道了大西洋鲑生长激素(GH)水平受光照周期影响显著; 田娟等[13]也报道了饥饿和再投喂显著影响了尼罗罗非鱼(Oreochromis niloticus)血清中GH和类胰岛素生长因子-Ⅰ(IGF-Ⅰ)的含量, 并影响了其肝胰脏mRNA的表达丰度。这些研究报道均表明, 机体激素的分泌受生长环境的影响。
大菱鲆Scophthalmus maximus L., 又名多宝鱼, 是我国北方海水工厂化养殖的主要品种之一。在工厂化养殖条件下, 多以白炽灯为光源, 强度与周期均为人为控制。大菱鲆养殖过程中对光照强度的要求并不严格, 水面光照强度500—6000 lx均可[14], 光照节律多采用自然光周期, 而在其仔稚鱼上的研究表明适当延长光照时间可促进生长[15]。因此本实验在适宜的光照强度下, 测定了4种光照周期对大菱鲆幼鱼摄食、前肠消化酶活力及血清激素含量的变化, 以期为其科学养殖策略的建立提供基础。
1. 材料与方法
1.1 实验设计与采样
实验分为4个处理, 分别为24L(光照)﹕0D(黑暗, D1)、16L﹕8D(D2)、8L﹕16D(D3)、0L﹕24D(D4), 每个处理3个重复, 每个重复放养体重(30.5±2.0) g的大菱鲆幼鱼50尾。实验在本研究院循环水养殖系统中进行, 养殖容器为Ф80 cm×H70 cm的绿色PVC水桶, 控制水深为45 cm, 每个水桶上方加盖一个黑色盖子, 每个盖子中间安装一个7 W的三基色节能灯为光源, 采用自动计时器控制光照周期, 水面光照强度约为1000—1500 lx。在实验开始前, 实验鱼在养殖系统中驯养15d, 这期间采用9L﹕15D (7:30am—4:30pm)光照周期, 日投喂2次(8:00am, 4:00pm)商品饲料(CP≥50%, CL≥10%)。实验持续7d, 期间每隔4h饱食投喂1次, 记录投喂量, 投喂后30min, 排出残饵数颗粒计算重量。实验第7天时, 每次投喂后取样1次, 每次取3尾鱼, 尾静脉抽血分离血清后, 解剖取前肠, –80℃保存, 共计取样6次(8:00am至次日4:00am)。
1.2 样品测定与指标计算
肠道蛋白酶、淀粉酶及脂肪酶活力采用南京建成生物工程研究所试剂盒测定, 蛋白酶测定采用福林-酚法, 淀粉酶测定采用碘-淀粉比色法, 脂肪酶测定采用滴定法。蛋白酶活力单位(U)定义为在pH 8.0, 37℃条件下, 每毫克蛋白质中含有的蛋白酶每分钟使吸光度变化0.003即为一个酶活力单位。淀粉酶活力单位(U)定义为每毫克蛋白质在37℃与底物作用30min, 水解10 mg淀粉定义为1个淀粉酶活力单位。脂肪酶活力单位(U)定义为在37℃条件下, 每克蛋白质在本反应体系中与底物反应1min, 每消耗1 μmol底物为1个酶活力单位; 匀浆液中蛋白质含量采用考马斯亮蓝法测定。
血清中生长激素(GH)、皮质醇(COR)、去甲肾上腺素(NE)、三碘甲状腺原氨酸(T3)含量采用上海酶联生物科技有限公司酶联免疫(Elisa)试剂盒测定, 具体操作方法见说明书。
摄食率(Feeding rate, %)=日摄食量/体重×100
1.3 数据处理
实验所得数据采用Microsoft Excel 2007以及SPSS11.0 One-way ANOVA分析, 结果以平均值±标准差表示, 差异显著时(P<0.05), 用Duncan氏多重比较进行。采用SPSS11.0 Two-way ANOVA分析不同光照周期条件下, 不同采样时间时摄食量、消化酶活力及血清激素含量的差异。采用origin8.1绘制血清激素含量变化图。
2. 结果
2.1 光照周期对大菱鲆幼鱼摄食量的影响
在本实验中, D2及D3组在整个实验过程中摄食较为正常, 而D1及D4组第2天开始表现为易惊, 摄食量下降, 第4天时有所好转, 第6天摄食较为稳定。
由表 1可见, 在不同光照周期条件下, 不同采样时间时大菱鲆的摄食量均有差异。在24 L光照下, 大菱鲆幼鱼每隔8h出现一次摄食高峰, 在16 L及8 L光照下, 实验鱼分别在8:00am及4:00pm出现摄食高峰, 在0 光照下, 实验鱼的摄食量一直呈下降趋势。各实验组的摄食率均随光照时间的缩短而降低(P<0.05), D1组日摄食量比其他三组分别提高了5.59%、13.31%和71.87%。
表 1 光照周期对大菱鲆幼鱼摄食量的影响Table 1. The effect of photoperiod on feed consumption of juvenile turbot Scophthalmus maximus L. (g)时间Time 组别Group D1 D2 D3 D4 8:00am 15.46±0.27aA 15.63±0.19aA 15.37±0.24aA 3.60±0.35bA 12:00am 5.31±0.22aC 4.94±0.16aC 5.48±0.20aC 1.42±0.07bD 4:00pm 11.63±0.43aB 12.84±0.27aB 13.25±0.19aB 3.61±0.52bB 8:00pm 3.37±0.09bE 4.54±0.15aD 1.72±0.08dD 2.48±0.11cC 0:00am 4.43±0.25aD 1.41±0.08bE 0.56±0.04cE 0.37±0.05dE 4:00am 1.11±0.05aF 0.58±0.04bF 0.27±0.03cF 0.34±0.06cE 摄食率Feed rate (%) 2.78±0.07d 2.62±0.04c 2.41±0.05b 0.78±0.08a Two-way ANOVA df P value F 光照周期Photoperiod 3 0.02 60.12 采样时间Sampling time 5 0.00 164.26 光照周期×采样时间Photoperiod×Sampling time 15 0.00 14.99 注: 同行上标小写字母不同表示二者之间差异显著(P<0.05), 同列大写字母不同表示二者之间差异显著(P<0.05), 下同Note: Values in the same line with different superscripts are significantly different (P<0.05), values in the same row with different capitals are significantly different (P<0.05). The same applies below 2.2 光照周期对大菱鲆幼鱼消化酶活力的影响
不同光照周期和采样时间时实验鱼消化酶活力均存在差异(表 2、表 3和表 4)。D1、D2和D3组蛋白酶及淀粉酶活力在12:00am和8:00pm出现2个峰值, 且8:00pm时的峰值高于12:00am。D4组酶活呈先降后升趋势, 但一直维持在较低水平。D1、D2和D3组12:00am至8:00pm脂肪酶活力显著高于D4组, 其余时间酶活力无显著差异, 且0:00am后各组脂肪酶活力变化不显著。
表 3 光照周期对大菱鲆幼鱼淀粉酶活力的影响Table 3. The effect of photoperiod on amylase of juvenile turbot Scophthalmus maximus L. [U/(mg·prot)]时间Time 组别Group D1 D2 D3 D4 8:00am 0.47±0.02C 0.45±0.06C 0.42±0.04C 0.44±0.03A 12:00am 0.64±0.11aA 0.59±0.07aA 0.62±0.04aA 0.37±0.02bB 4:00pm 0.51±0.05bB 0.54±0.03abB 0.58±0.08aA 0.34±0.03cBC 8:00pm 0.55±0.01bB 0.61±0.05aA 0.57±0.13abA 0.31±0.07cC 0:00am 0.46±0.10aC 0.44±0.07aC 0.49±0.05aB 0.33±0.05bC 4:00am 0.39±0.04bD 0.42±0.06aC 0.48±0.03aB 0.29±0.04cC Two-way ANOVA df P F 光照周期Photoperiod 3 0.00 50.88 采样时间Sampling time 5 0.01 23.82 光照周期×采样时间Photoperiod×Sampling time 15 0.00 4.05 表 4 光照周期对大菱鲆幼鱼脂肪酶活力的影响Table 4. The effect of photoperiod on lipase of juvenile turbot Scophthalmus maximus L. [U/(g·prot)]时间Time 组别Group D1 D2 D3 D4 8:00am 390.97±28.24C 397.31±15.38D 386.68±10.14D 392.45±18.46C 12:00am 493.67±21.12aA 515.19±22.73aA 518.42±13.59aA 423.85±16.62bA 4:00pm 456.75±11.09aB 448.92±8.95aB 461.48±18.20aB 381.27±9.74bC 8:00pm 520.85±14.03aA 517.96±25.36aA 522.47±19.42aA 400.79±21.92bB 0:00am 412.41±29.17C 428.84±13.09C 419.65±32.17C 411.04±9.96B 4:00am 427.43±27.78C 436.75±18.69BC 431.88±21.34C 416.19±16.95B Two-way ANOVA df P F 光照周期Photoperiod 3 0.01 60.37 采样时间Sampling time 5 0.00 89.95 光照周期×采样时间Photoperiod×Sampling time 15 0.00 9.90 表 2 光照周期对大菱鲆幼鱼蛋白酶活力的影响Table 2. The effect of photoperiod on protease of juvenile turbot Scophthalmus maximus L. [U/(mg·prot)]时间Time 组别Group D1 D2 D3 D4 8:00am 16.59±1.65C 16.83±1.34D 15.97±1.05D 14.95±1.13B 12:00am 20.84±1.42aB 21.69±1.76aB 19.67±1.43aB 16.44±0.92bA 4:00pm 17.36±0.86aC 18.24±1.15aC 17.96±1.63aC 10.18±1.33bC 8:00pm 23.49±1.00bA 24.79±1.52abA 25.15±1.31aA 7.47±0.82cD 0:00am 18.28±1.32abC 19.21±0.83aC 17.44±1.12bC 6.89±0.81cD 4:00am 9.14±0.85cD 14.78±1.21bE 16.28±1.08aD 7.54±0.63 dD Two-way ANOVA df P F 光照周期Photoperiod 3 0.00 332.99 采样时间Sampling time 5 0.02 132.35 光照周期×采样时间Photoperiod×Sampling time 15 0.00 25.83 2.3 光照周期对大菱鲆幼鱼血清激素含量的影响
由表 5可见, 光照周期及采样时间时大菱鲆幼鱼血清中GH、COR、NE及T3的含量均存在显著差异。
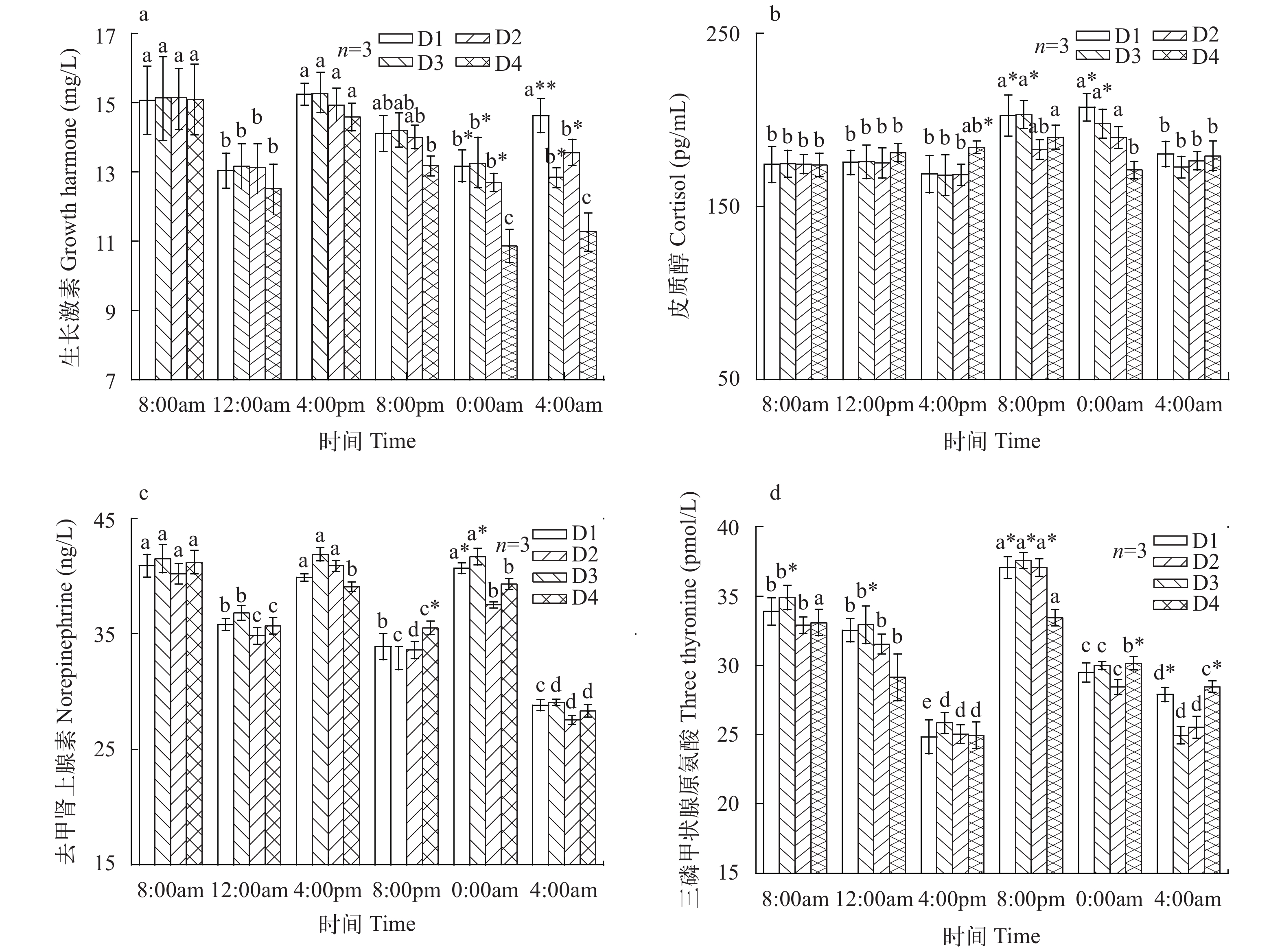
表 5 光照周期及采样时间对大菱鲆血清激素含量的主效应分析Table 5. Main effect analysis of photoperiod and sampling time on serum hormone content in turbot Scophthalmus maximus L.GH COR NE T3 df P F df P F df P F df P F 光照周期Photoperiod 3 0.01 23.44 3 0.01 8.24 3 0.46 0.88 3 0.20 1.62 采样时间Sampling time 5 0.00 46.84 5 0.00 28.68 5 0.00 29.27 5 0.00 30.29 光照周期×采样时间Photoperiod×Sampling time 15 0.00 4.04 15 0.00 5.50 15 0.59 0.88 15 0.51 0.96 实验期间, 各组实验鱼血清生长激素(GH)含量均呈先降后升再降低的趋势, 表现出较强的时间节律性(图 1a)。各组8:00am至8:00pmGH含量无显著变化, D4组0:00am和4:00am时GH含量显著低于其他三组(P<0.05), D1组4:00am时GH含量显著高于其他三组(P<0.05)。
![]() 图 1 不同光照周期对大菱鲆血清激素含量的影响同系列柱上标小写字母不同表示二者差异显著, 同组柱上标*不同表示差异显著(P<0.05)(n=3) a. 生长激素(GH); b. 皮质醇(COR); c. 去甲肾上腺素(NE); d. 三碘甲状腺原氨酸(T3)Figure 1. The effect of different photoperiod on serum hormone contents of turbot Scophthatmus maximus L.Different letters of superscript on the same series columns indicated significantly dierent (P<0.05), and diffenet * of superscript on the same group columns indicated significantly dierent (P<0.05) (n=3) a. growth hormone (GH); b. cortisol (COR); c. noradrenaline (NE); d. Triiodothyronine (T3)
图 1 不同光照周期对大菱鲆血清激素含量的影响同系列柱上标小写字母不同表示二者差异显著, 同组柱上标*不同表示差异显著(P<0.05)(n=3) a. 生长激素(GH); b. 皮质醇(COR); c. 去甲肾上腺素(NE); d. 三碘甲状腺原氨酸(T3)Figure 1. The effect of different photoperiod on serum hormone contents of turbot Scophthatmus maximus L.Different letters of superscript on the same series columns indicated significantly dierent (P<0.05), and diffenet * of superscript on the same group columns indicated significantly dierent (P<0.05) (n=3) a. growth hormone (GH); b. cortisol (COR); c. noradrenaline (NE); d. Triiodothyronine (T3)由图 1b可见, D1、D2、D3组初次摄食8h内皮质醇(COR)含量变化不显著, 8:00pm时骤然升高, 之后逐渐降低; D4组4:00pm时含量显著高于其他组(P<0.05); D1、D2组8:00pm及0:00am时显著高于D3、D4组(P<0.05); 4:00am时各组之间差异不显著(P>0.05)。
由图 1c可见, 光照周期显著影响了大菱鲆幼鱼去甲肾上腺素(NE)的含量。8:00am至4:00pm各组NE含量无显著差异(P>0.05); D4组实验鱼8:00pm时显著高于其他组(P<0.05); D1、D2组0:00am时显著高于其他组(P<0.05); 4:00am时各组无显著差异(P>0.05)。
D2组8:00am及12:00am时三碘甲状原氨酸(T3)含量显著高于其他组(P<0.05), D4组8:00pm时三碘甲状原氨酸(T3)含量显著低于其他组, 0:00am显著高于其他组(P<0.05), D2、D3组4:00am显著低于D1、D4组(P<0.05); 各组T3最高值均出现在8:00pm (图 1d)。
3. 讨论
3.1 不同光照周期对大菱鲆幼鱼摄食的影响
光照周期对鱼类的影响可分为短期影响及长期影响, 鱼类摄食节律的研究方法有分段式投喂法和一次性饱食投喂法。本实验采用短期分段式投喂研究光照周期对大菱鲆摄食的影响。在本研究中, 不同光照周期条件下, 各组大菱鲆幼鱼均在8:00am出现一个摄食高峰, D1到D3组在4:00pm时出现另一个摄食高峰, 这与郑珂珂等[16]的研究较为一致, 而D4组摄食量呈一直下降的趋势, 且由于本实验中光照强度较弱, 因此可认为大菱鲆幼鱼属于典型的晨昏摄食类型。在本实验中, 随着光照时间的延长, 实验鱼的日摄食量及摄食率均呈上升趋势, 这与在罗氏沼虾(Macrobrachium rosenbergh)及斜带石斑鱼(Epinephelus coioides)幼体的研究结果一致[17, 18], 光照影响鱼类摄食的原因主要有: ①光照能促进鱼类的活动, 从而提高其觅食能力; ②光照可能促进生长激素的分泌, 从而提高大西洋鲑的食欲[19]。Biswas等[20]研究, 真鲷(Pagrus major)的生长及饲料利用随着光照时间的延长而增加, 但在大菱鲆[7]及南极石首鱼(Argyrosomus japonicu)[21]上的研究表明, 长期光照对鱼类的生长及饲料利用的影响是负面的, 但阶段性的提高光照周期可以促进鱼类的生长及饲料利用。在本实验中, 实验鱼对光照周期改变的适应能力较强, 且光照会增加实验鱼的摄食量, 但这种影响能持续多长时间需进一步的研究。此外, 实验鱼前期养殖中所采用的管理策略对其摄食生理造成的影响也需要进一步的研究。
研究表明自然界中许多鱼类的摄食存在昼夜节律[22], 且不同的光照周期及投喂间隔会影响某些鱼类的摄食量、生长及饲料利用[23]。因此, 本实验模拟自然光节律, 以24h为一个光照周期, 并采用4h投喂间隔研究光照周期对大菱鲆摄食量的影响。在本实验中, D1—D3组日摄食率显著高于本实验室其他在相同规格大菱鲆上的研究[24, 25], 表明适当加大投喂频率会促进大菱鲆的摄食。但鱼类摄食量的增加会对机体造成的一系列生理生化影响, 这种摄食量的增加是否能长期维持下去, 有待于进一步研究。
3.2 不同光照周期对大菱鲆幼鱼前肠消化酶活力的影响
本实验中测定的3种消化酶均为胰酶[26], 胰酶的分泌受神经和体液的双重调控[27], 并受外部环境的影响[26, 28—30]。在人类上的研究表明, 食物的视觉和味觉可以通过迷走神经调控消化酶分泌, 在鱼类上尚未见相关报道[31]。消化酶的体液调控主要是通过胃肠激素激素完成的, 而食物是引起胃肠激素分泌的自然刺激物。与本实验室其他在大菱鲆上的研究相比, 本实验所测得的3种消化酶活力均相对较高。一方面本实验是投喂之后取样, 且取样间隔时间较短, 其他研究多在禁食24h后取样, 由此导致了测定的消化酶活力有较大变化; 另一方面可能由于光照周期影响了机体内的激素分泌[32], 从而对其生理节律造成了影响, 这在斜带石斑鱼上也有类似的报道[18]。
由于本实验持续时间较短, 缺乏饲料利用、生长等数据, 所以不能得出该规格大菱鲆适宜的最适宜的光照周期及投喂频率。但从实验鱼的摄食及消化酶活力的变化规律分析, 12—16h光照、日早晚投喂2次更符合大菱鲆的生理节律。
3.3 不同光照周期对大菱鲆幼鱼血清激素含量的影响
胁迫(Stress)是鱼类应对环境改变的一种保护机制。环境胁迫与鱼体神经内分泌系统有着广泛联系, 鱼体对环境胁迫产生的应激反应最终结果是导致其血液激素水平升高[33]。已有研究表明, 血清内许多激素的变化是脉冲式[34, 35], 单个时间取样所测的激素水平的平均值难以反映其真实情况。草鱼在正常投喂条件下, 4h左右出现一次生长激素高峰[35], 因此本实验采用了4h的取样时间。
生长激素(Growth hormone, GH)是腺垂体细胞分泌的一种肽类激素。在正常情况下生长激素呈脉冲式分泌, 受下丘脑产生的生长激素释放素(GHRH)和生长激素抑制激素(GHIH)的调节, 还受性别、年龄和昼夜节律的影响[36]。生长激素的主要生理功能是促进神经组织以外的所有其他组织生长, 促进机体合成代谢和蛋白质合成, 促进脂肪分解, 抑制葡萄糖利用而使血糖升高等作用。在本实验中, 大菱鲆血清GH含量变化呈现出明显的脉冲性, 且GH含量与曾霖等[37]报道较为一致。此外, 长期黑暗导致了D4组实验鱼血清GH含量下降, 如果此种情况得以延续, 必然会导致其生长性能下降。在本实验中大菱鲆血清GH峰值出现的时间与其他动物差异较大[32], 这可能与实验环境, 尤其是光照强度有关。
皮质醇(Cortisol, COR)是从肾上腺皮质中提取出的对糖类代谢具有最强作用的肾上腺皮质激素, 是“抗应激激素”, 也是水生动物中研究最为广泛的激素[38, 39]。在本实验中, 长时间光照(D1、D2组)提高了血清COR含量, 这与大菱鲆对温度和盐度的反应较为一致[37, 40], 表明短期光照周期的改变对大菱鲆是一种胁迫环境。皮质醇具有昼夜和季节变化节律, 并受光周期、光强度和温度等环境因素的影响, 长期光照对皮质醇影响不显著[20], 这表明了动物对环境胁迫的一种适应性。相较于黑暗(D4组), 光照(D1、D2组)对大菱鲆血清皮质醇的影响更为显著, 说明长期光照是比黑暗更为强烈的环境胁迫。
去甲肾上腺素(Noradrenaline, NE)是肾上腺素去掉N-甲基后形成的物质, 在化学结构上属于儿茶酚胺, 它既是一种神经递质, 也是一种激素。它可以通过α受体激动, 引起血管极度收缩, 使血压升高, 冠状动脉血流增加。在本实验中, 光照仅在8:00pm和0:00am时对NE含量有影响, 但并为改变其总体趋势。目前关于水生动物去甲肾上腺素的研究较少, 光照改变NE含量的原因尚需进一步研究, 但也有可能是由于实验操作或实验误差导致的。
三碘甲状腺原氨酸(Triiodothyronine)是由甲状腺分泌出的活性物质, 它对蛋白质合成、体温调节、能量产生和调节有着极为重要的作用[41]。在异育银鲫(Carassius auratus gibelio)上的研究表明, 免疫增强剂能提高血清T3、降低COR水平[42]。在本实验中未发现此种现象, T3含量表现出较强的规律性, 延长光照时间或长期黑暗对其含量有一定影响, 这可能是机体应对急性胁迫的一种对策[43]。
在本研究中, 由于采用了短期光照周期, 大菱鲆幼鱼摄食、消化酶活力及血清激素含量仍表现出较强的时间节律性, 长期光照周期对血清激素时间节律的影响仍需进一步研究。Imsland等[7]发现长期光照周期(46个月)下, 长期连续光照降低了大菱鲆的生长, 降低了血清11-甲基睾酮的含量。因此, 在养殖生长中推荐以8—16h光照周期为宜。
4. 结论
在本实验中, 不同的光照周期显著影响了大菱鲆幼鱼的摄食、消化酶活力及血清激素水平。在此光照强度下, 大菱鲆养殖采取8—16h 光照周期、日投喂2次为宜。
-
图 1 不同光照周期对大菱鲆血清激素含量的影响
同系列柱上标小写字母不同表示二者差异显著, 同组柱上标*不同表示差异显著(P<0.05)(n=3) a. 生长激素(GH); b. 皮质醇(COR); c. 去甲肾上腺素(NE); d. 三碘甲状腺原氨酸(T3)
Figure 1. The effect of different photoperiod on serum hormone contents of turbot Scophthatmus maximus L.
Different letters of superscript on the same series columns indicated significantly dierent (P<0.05), and diffenet * of superscript on the same group columns indicated significantly dierent (P<0.05) (n=3) a. growth hormone (GH); b. cortisol (COR); c. noradrenaline (NE); d. Triiodothyronine (T3)
表 1 光照周期对大菱鲆幼鱼摄食量的影响
Table 1 The effect of photoperiod on feed consumption of juvenile turbot Scophthalmus maximus L. (g)
时间Time 组别Group D1 D2 D3 D4 8:00am 15.46±0.27aA 15.63±0.19aA 15.37±0.24aA 3.60±0.35bA 12:00am 5.31±0.22aC 4.94±0.16aC 5.48±0.20aC 1.42±0.07bD 4:00pm 11.63±0.43aB 12.84±0.27aB 13.25±0.19aB 3.61±0.52bB 8:00pm 3.37±0.09bE 4.54±0.15aD 1.72±0.08dD 2.48±0.11cC 0:00am 4.43±0.25aD 1.41±0.08bE 0.56±0.04cE 0.37±0.05dE 4:00am 1.11±0.05aF 0.58±0.04bF 0.27±0.03cF 0.34±0.06cE 摄食率Feed rate (%) 2.78±0.07d 2.62±0.04c 2.41±0.05b 0.78±0.08a Two-way ANOVA df P value F 光照周期Photoperiod 3 0.02 60.12 采样时间Sampling time 5 0.00 164.26 光照周期×采样时间Photoperiod×Sampling time 15 0.00 14.99 注: 同行上标小写字母不同表示二者之间差异显著(P<0.05), 同列大写字母不同表示二者之间差异显著(P<0.05), 下同Note: Values in the same line with different superscripts are significantly different (P<0.05), values in the same row with different capitals are significantly different (P<0.05). The same applies below 表 3 光照周期对大菱鲆幼鱼淀粉酶活力的影响
Table 3 The effect of photoperiod on amylase of juvenile turbot Scophthalmus maximus L. [U/(mg·prot)]
时间Time 组别Group D1 D2 D3 D4 8:00am 0.47±0.02C 0.45±0.06C 0.42±0.04C 0.44±0.03A 12:00am 0.64±0.11aA 0.59±0.07aA 0.62±0.04aA 0.37±0.02bB 4:00pm 0.51±0.05bB 0.54±0.03abB 0.58±0.08aA 0.34±0.03cBC 8:00pm 0.55±0.01bB 0.61±0.05aA 0.57±0.13abA 0.31±0.07cC 0:00am 0.46±0.10aC 0.44±0.07aC 0.49±0.05aB 0.33±0.05bC 4:00am 0.39±0.04bD 0.42±0.06aC 0.48±0.03aB 0.29±0.04cC Two-way ANOVA df P F 光照周期Photoperiod 3 0.00 50.88 采样时间Sampling time 5 0.01 23.82 光照周期×采样时间Photoperiod×Sampling time 15 0.00 4.05 表 4 光照周期对大菱鲆幼鱼脂肪酶活力的影响
Table 4 The effect of photoperiod on lipase of juvenile turbot Scophthalmus maximus L. [U/(g·prot)]
时间Time 组别Group D1 D2 D3 D4 8:00am 390.97±28.24C 397.31±15.38D 386.68±10.14D 392.45±18.46C 12:00am 493.67±21.12aA 515.19±22.73aA 518.42±13.59aA 423.85±16.62bA 4:00pm 456.75±11.09aB 448.92±8.95aB 461.48±18.20aB 381.27±9.74bC 8:00pm 520.85±14.03aA 517.96±25.36aA 522.47±19.42aA 400.79±21.92bB 0:00am 412.41±29.17C 428.84±13.09C 419.65±32.17C 411.04±9.96B 4:00am 427.43±27.78C 436.75±18.69BC 431.88±21.34C 416.19±16.95B Two-way ANOVA df P F 光照周期Photoperiod 3 0.01 60.37 采样时间Sampling time 5 0.00 89.95 光照周期×采样时间Photoperiod×Sampling time 15 0.00 9.90 表 2 光照周期对大菱鲆幼鱼蛋白酶活力的影响
Table 2 The effect of photoperiod on protease of juvenile turbot Scophthalmus maximus L. [U/(mg·prot)]
时间Time 组别Group D1 D2 D3 D4 8:00am 16.59±1.65C 16.83±1.34D 15.97±1.05D 14.95±1.13B 12:00am 20.84±1.42aB 21.69±1.76aB 19.67±1.43aB 16.44±0.92bA 4:00pm 17.36±0.86aC 18.24±1.15aC 17.96±1.63aC 10.18±1.33bC 8:00pm 23.49±1.00bA 24.79±1.52abA 25.15±1.31aA 7.47±0.82cD 0:00am 18.28±1.32abC 19.21±0.83aC 17.44±1.12bC 6.89±0.81cD 4:00am 9.14±0.85cD 14.78±1.21bE 16.28±1.08aD 7.54±0.63 dD Two-way ANOVA df P F 光照周期Photoperiod 3 0.00 332.99 采样时间Sampling time 5 0.02 132.35 光照周期×采样时间Photoperiod×Sampling time 15 0.00 25.83 表 5 光照周期及采样时间对大菱鲆血清激素含量的主效应分析
Table 5 Main effect analysis of photoperiod and sampling time on serum hormone content in turbot Scophthalmus maximus L.
GH COR NE T3 df P F df P F df P F df P F 光照周期Photoperiod 3 0.01 23.44 3 0.01 8.24 3 0.46 0.88 3 0.20 1.62 采样时间Sampling time 5 0.00 46.84 5 0.00 28.68 5 0.00 29.27 5 0.00 30.29 光照周期×采样时间Photoperiod×Sampling time 15 0.00 4.04 15 0.00 5.50 15 0.59 0.88 15 0.51 0.96 -
[1] 王连群, 侯芳, 臧长江, 等. 光照周期对动物下丘脑-垂体-性腺轴的调节机制. 贵州农业科学, 2015, 43(2): 95—99 doi: 10.3969/j.issn.1001-3601.2015.02.025 Wang L C, Hou F, Zang C J, et al. Adjustment mechanism of hypothalamus-pituitary-gonad axis affected by photoperiod [J]. Guizhou Agricultural Sciences, 2015, 43(2): 95—99 doi: 10.3969/j.issn.1001-3601.2015.02.025
[2] 谢从新, 熊传喜, 周洁, 等. 不同光照强度下乌鳢幼鱼的摄食强度及动力学. 水生生物学报, 1997, 21(3): 213—218 doi: 10.3321/j.issn:1000-3207.1997.03.003 Xie C X, Xiong C X, Zhou J, et al. Feeding intensity and dynamics of juveniles northern snakehead, Channa Argus, under different illumination [J]. Acta Hydrobiologica Sinica, 1997, 21(3): 213—218 doi: 10.3321/j.issn:1000-3207.1997.03.003
[3] 楼宝, 史会来, 毛国民, 等. 不同光照时间、强度对舟山褐牙鲆稚幼鱼摄食、生长的影响. 浙江海洋学院学报(自然科学版), 2008, 27(2): 140—143 doi: 10.3969/j.issn.1008-830X.2008.02.006 Lou B, Shi H L, Mao G M, et al. effects on feeding and growth of juvenile Zhoushan Paralichthys olivaceus under different illuminances times and intensities [J]. Journal of Zhejiang Ocean University(
Natural Science ) , 2008, 27(2): 140—143 doi: 10.3969/j.issn.1008-830X.2008.02.006 [4] Leonardi M O, Klempau A E. Artificial photoperiod influence on the immune system of juvenile rainbow trout (Oncorhynchus mykiss) in the Southern Hemisphere [J]. Aquaculture, 2003, 221(1): 581—591
[5] Shan X J, Xiao Z Z, Huang W, et al. Effects of photoperiod on growth, mortality and digestive enzyme in miry croaker larvae and juveniles [J]. Aquaculture, 2008, 281(1): 70—76
[6] Migaud H, Wang N, Gardeur J N, et al. Influence of photoperiod on reproductive performances in Eurasian perch Perca fluviatilis [J]. Aquaculture, 2006, 252(2): 385—393
[7] Imsland A K, Gunnarsson S, Roth B, et al. Long-term effect of photoperiod manipulation on growth, maturation and flesh quality in turbot [J]. Aquaculture, 2013, 416—417(11): 152—160
[8] Biswas A K, Seoka M, Ueno K, et al. Growth performance and physiological responses in striped knifejaw, Oplegnathus fasciatus, held under different photoperiods [J]. Aquaculture, 2008, 279(1): 42—46
[9] Fülberth M, Moran D, Jarlbæk H, et al. Growth of juvenile Atlantic cod Gadus morhua in land-based recirculation systems: Effects of feeding regime, photoperiod and diet [J]. Aquaculture, 2009, 292(3): 225—231
[10] Torstein H, Anders M J, Mari M, et al. Control of light condition affects the feeding regime and enables successful eye migration in Atlantic halibut juveniles [J]. Aquaculture, 2009, 290(3-4): 250—255 doi: 10.1016/j.aquaculture.2009.02.032
[11] Björnsson B T, Stefansson G V, Berge Å I, et al. Circulating growth hormone levels in Atlantic salmon smolts following seawater transfer: effects of photoperiod regime, salinity, duration of exposure and season [J]. Aquaculture, 1998, 168(1-4): 121—137 doi: 10.1016/S0044-8486(98)00344-5
[12] 杜劲松, 高攀, 刘立志, 等. 温度、体重、摄食和光照对白斑狗鱼幼鱼耗氧率的影响. 淡水渔业, 2011, 41(4): 45—49 doi: 10.3969/j.issn.1000-6907.2011.04.008 Du J S, Gao P, Liu L Z, et al. Effects of water temperature, body weight, feeding state and photoperiod on oxygen consumption rate of Esox lucius [J]. Freshwater Fisheries, 2011, 41(4): 45—49 doi: 10.3969/j.issn.1000-6907.2011.04.008
[13] 田娟, 涂玮, 曾令兵, 等. 饥饿和再投喂期间尼罗罗非鱼生长、血清生化指标和肝胰脏生长激素、类胰岛素生长因子-Ⅰ和胰岛素mRNA表达丰度的变化. 水产学报, 2012, 36(6): 900—907 Tian J, Tu W, Zeng L B, et al. The changes in growth, serum biochemical indices and GH/IGF-I/IN mRNA expression abundance of Oreochromis niloticus during fasting and re-feeding [J]. Journal of Fisheries of China, 2012, 36(6): 900—907
[14] 中国水产科学研究院大菱鲆专家组. 大菱鲆健康养殖技术指南. 中国水产, 2007, 374(1): 50—57 doi: 10.3969/j.issn.1002-6681.2007.01.032 Turbot panel from Chinese Academy of Fishery Sciences. Technical Guide for Healthy Culture of Turbot [J]. China Fisheries, 2007, 374(1): 50—57 doi: 10.3969/j.issn.1002-6681.2007.01.032
[15] 张邦辉, 陆裕肖. 工厂化无公害养殖大菱鲆关键技术及探讨. 中国水产, 2007, 374(1): 58—61 doi: 10.3969/j.issn.1002-6681.2007.01.033 Zhang B H, Lu Y X. Key technology and discussion on nuisanceless factory culture of turbot [J]. China Fisheries, 2007, 374(1): 58—61 doi: 10.3969/j.issn.1002-6681.2007.01.033
[16] 郑珂珂, 方伟, 孔凡华, 等. 大菱鲆幼鱼的摄食节律及适宜的投喂时间. 渔业现代化, 2010, 37(5): 26—30 doi: 10.3969/j.issn.1007-9580.2010.05.007 Zheng K K, Fang W, Kong F H, et al. Feeding rhythm and optimal feeding time for turbot Scophthalmus maximus L. Juvenile [J]. Fishery Modernization, 2010, 37(5): 26—30 doi: 10.3969/j.issn.1007-9580.2010.05.007
[17] 林小涛. 不同光照周期条件下罗氏沼虾幼体摄食量及发育的研究. 海洋与湖沼, 1997, 28(1): 13—20 doi: 10.3321/j.issn:0029-814X.1997.01.003 Lin X T. Influence of photoperiod on food consumption and development of Macrobrachium Rosenbergh larvae [J]. Ocenologica et Limnologia Sinica, 1997, 28(1): 13—20 doi: 10.3321/j.issn:0029-814X.1997.01.003
[18] 张海发, 刘晓春, 林浩然, 等. 斜带石斑鱼仔鱼的摄食节律及日摄食量. 水产学报, 2004, 28(6): 669—674 Zhang H F, Liu X C, Lin H R, et al. Studies on feeding rhythm and daily feeding amount of larval Epinephelus coioides [J]. Journal of Fisheries of China, 2004, 28(6): 669—674
[19] Mccormick S D, Shrimpton J M, Moriyama S, et al. Differential hormonal responses of Atlantic salmon parr and smolt to increased day length: A possible developmental basis for smolting [J]. Aquaculture, 2007, 273(2-3): 337—344 doi: 10.1016/j.aquaculture.2007.10.015
[20] Biswas A K, Seoka M, Tanaka Y, et al. Effect of photoperiod manipulation on the growth performance and stress response of juvenile red sea bream (Pagrus major) [J]. Aquaculture, 2006, 258(1): 350—356
[21] Ballagh D A, Pankhurst P M, Fielder D S. Photoperiod and feeding interval requirements of juvenile mulloway, Argyrosomus japonicus [J]. Aquaculture, 2008, 277(1-2): 52—57 doi: 10.1016/j.aquaculture.2008.02.025
[22] 周显青, 牛翠娟, 李庆芬. 光照对水生动物摄食、生长和存活的影响. 水生生物学报, 2000, 24(2): 178—181 doi: 10.3321/j.issn:1000-3207.2000.02.013 Zhou X Q, Niu C J, Li Q F. Effects of light on feeding behavior, growth and survival of aquatic animals [J]. Acta Hydrobiologica Sinica, 2000, 24(2): 178—181 doi: 10.3321/j.issn:1000-3207.2000.02.013
[23] Ginés R, Afonso J M, Argüello A, et al. The effects of long-day photoperiod on growth, body composition and skin colour in immature gilthead sea bream (Sparus aurata L.) [J]. Aquaculture Research, 2004, 35(13): 1207—1212 doi: 10.1111/are.2004.35.issue-13
[24] 孙建珍, 王际英, 马晶晶, 等. 不同脂肪水平下添加胆汁酸对大菱鲆(Scophthalmus maximus)幼鱼生长、体组成和脂肪代谢的影响. 海洋与湖沼, 2014, 45(3): 617—625 Sun J Z, Wang J Y, Ma J J, et al. Effects of bile acids on growth, body composition and lipid metabolism of juvenile turbot (Scophthalmus maximus) at two dietary lipid levels [J]. Ocenologica et Limnologia Sinica, 2014, 45(3): 617—625
[25] 郝甜甜, 王际英, 李宝山, 等. 饲料中添加糖萜素对大菱鲆幼鱼生长、免疫及热休克蛋白70含量的影响. 浙江大学学报(农业与生命科学版), 2014, 40(3): 338—347 doi: 10.3785/j.issn.1008-9209.2014.03.014 Hao T T, Wang J Y, Li B S, et al. Effects of dietary supplementation of saccharicterpenin on growth, immunity and heat shock protein 70 content of juvenile turbot (Scophthalmus maximus) [J]. Journal of Zhejiang University(
Agriculture & Life Sciences ) , 2014, 40(3): 338—347 doi: 10.3785/j.issn.1008-9209.2014.03.014 [26] 王海英.大菱鲆主要消化酶-蛋白酶、脂肪酶、淀粉酶的研究. 博士学位论文,中国海洋大学, 青岛. 2014 Wang H Y. Digestive enzyme in turbot Scophthalmus maximus L.[D]. Thesis for Doctor of Science. China Ocean University, Qingdao. 2014
[27] 董虹, 张永东, 刘凤华, 等. 胰腺外分泌功能调节的研究进展. 动物医学进展, 2005, 26(10): 19—22 Dong H, Zhang Y D, Liu F H, et al. Advance in the effects of functional regulation of exocrine pancreatic secretion [J]. Progress in Veterinary Medicine, 2005, 26(10): 19—22
[28] 韩庆, 刘良国, 张建平, 等. 乌日娜温度和pH对洞庭鲇鱼消化酶活性的影响. 水生生物学报, 2011, 35(1): 22—33 Han Q, Liu L G, Zhang J P, et al. The effects of temperature and pH on activities of digestive enzymes in catfish (Silurus asotus L.) in Dongting Lake area [J]. Acta Hydrobiologica Sinica, 2011, 35(1): 22—33
[29] 张莉莉, 梁萌青, 徐后国, 等. 饲料中添加磷虾水解物对大菱鲆幼鱼生长性能、体组成及相关酶活性的影响. 水生生物学报, 2017, 41(3): 497—505 Zhang L L, Liang M Q, Xu H G, et al. Effects of dietary krill hydrolysates on growth performance, body composition and related enzyme activities of juvenile turbot (Scophthalmus maximus L.) [J]. Acta Hydrobiologica Sinica, 2017, 41(3): 497—505
[30] 宋国, 彭士明, 孙鹏, 等. 饥饿与再投喂及投喂频率对条石鲷幼鱼生长和消化酶活力的影响. 中国水产科学, 2011, 18(6): 1269—1277 Song G, Peng S M, Sun P, et al. Effects of starvation, refeeding, and feeding frequency on growth and digestive enzyme activity of Oplegnathus fasciatus [J]. Journal of Fishery Sciences of China, 2011, 18(6): 1269—1277
[31] 李劲松, 陈道达. 胰腺外分泌的迷走神经调节. 国外医学外科学分册, 1999, 26(2): 88—90 Li J S, Chen D D. Vagus nerve regulation of exocrine secretion of the pancreas [J]. Foreign Medicine-Surgery Branch, 1999, 26(2): 88—90
[32] 黄仁录, 陈辉, 邸科前, 等. 不同光照周期对蛋鸡高峰期血液激素水平的影响. 畜牧兽医学报, 2008, 39(3): 368—371 doi: 10.3321/j.issn:0366-6964.2008.03.021 Huang R L, Chen H, Di K Q, et al. Effect of different photoperiods on blood hormone of laying hens [J]. Acta Veterinaria et Zootechnica Sinica, 2008, 39(3): 368—371 doi: 10.3321/j.issn:0366-6964.2008.03.021
[33] 王文博, 李爱华. 环境胁迫对鱼类免疫系统影响的研究进展. 水产学报, 2002, 26(4): 368—374 Wang W B, Li A H. The effect of environmental stress to fish immune system [J]. Journal of Fisheries of China, 2002, 26(4): 368—374
[34] 陈平洁, 陈庄, 王祖昆, 等. 生长激素分泌规律的研究概况. 国外畜牧科技, 1998, 25(2): 32—34 Chen P J, Chen Z, Wang Z K, et al. The general research on the regular of growth hormone [J]. Animal Science Abroad, 1998, 25(2): 32—34
[35] 张为民, 张利红, 沈文英, 等. 饥饿状态下草鱼生长激素的分泌. 水生生物学报, 2001, 25(3): 236—240 doi: 10.3321/j.issn:1000-3207.2001.03.006 Zhang W M, Zhang L H, Shen W Y, et al. The secretion of growth hormone in starved grass carp, Ctenopharyngodon idellus [J]. Acta Hyrobiologica Sinica, 2001, 25(3): 236—240 doi: 10.3321/j.issn:1000-3207.2001.03.006
[36] 李文笙, 林浩然. 鱼类生长激素合成与分泌的内分泌调控网络:垂体生长激素分泌细胞中的信号整合. 中国科学:生命科学, 2010, 40(2): 149—158 Li W S, Lin H R. The endocrine regulation network of growth hormone synthesis and secretion in fish: emphasis on the signal integration insomatotropes [J]. Scientia Sinica Vitae, 2010, 40(2): 149—158
[37] 曾霖, 雷霁霖, 刘滨, 等. 盐度对大菱鲆幼鱼鳃Na+-K+-ATPase活力、血清离子浓度和激素水平的影响. 动物学杂志, 2014, 49(3): 407—414 Zeng L, Lei Q L, Liu B, et al. Effects of salinity on Na+-K+-ATPase activity in gills, and concentrations of ions and hormones in serum of juvenile turbot (Scophthalmus maximus) [J]. Chinese Journal of Zoology, 2014, 49(3): 407—414
[38] 徐钢春, 杜富宽, 聂志娟, 等. 10‰盐度对长江刀鲚幼鱼装载和运输胁迫中应激指标的影响. 水生生物学报, 2015, 39(1): 66—72 Xu G C, Du F K, Nie Z J, et al. Effects of 10‰ salinity to the plasma osmotic pressure, cortisol, glucose and liver glycogen in Colilianasus stressed during loading and transportation [J]. Acta Hydrobiologica Sinica, 2015, 39(1): 66—72
[39] 何杰, 强俊, 徐跑, 等. 低温驯化下4种不同品系罗非鱼血清皮质醇及免疫相关指标的变化. 中国水产科学, 2014, 32(2): 266—274 He J, Qiang J, Xu P, et al. Change in serum cortisol and immune-related indices in four strains of tilapia during low-temperature acclimation [J]. Journal of Fishery of China, 2014, 32(2): 266—274
[40] 纪利芹. 连续降温对大菱鲆血液生理生化指标的影响及分子机制. 博士学位论文, 中国海洋大学, 青岛. 2014 Ji L Q. Effect of continuous cooling on serum physiological, biochemical index and molecular mechanism of adult Scophthalmus maximus L. [D]. Thesis for Doctor of Science, China Ocean University, Qingdao. 2014
[41] 周密, 廖清奎, 李丰益, 等. 甲状腺激素T3影响K562细胞转铁蛋白受体和铁蛋白表达的分子机制研究. 中华血液学杂志, 2003, 24(4): 181—183 doi: 10.3760/j:issn:0253-2727.2003.04.004 Zhou M, Liao Q K, Li F Y, et al. Effect of T3 on the expression of transferring receptor and ferritin in K562 cells and its possible mechanism [J]. China Journal of Hematology, 2003, 24(4): 181—183 doi: 10.3760/j:issn:0253-2727.2003.04.004
[42] 陈勇, 华雪铭, 周洪琪, 等. 壳聚糖和益生菌对异育银鲫非特异性免疫功能及血清甲状腺激素、皮质醇水平的影响. 水产学报, 2010, 34(5): 711—718 Chen Y, Hua X M, Zhou H Q, et al. Effcets of chitosan and probiotics on non-specific immune function and the levels of serum thyroid hormone and cortisol in allogynogenetic silver crucian carp (Carassius auratus gibelio) [J]. Journal of Fisheries of China, 2010, 34(5): 711—718
[43] 邓利, 张为民, 林浩然. 饥饿对黑鲷血清生长激素、甲状腺素以及白肌和肝脏脂肪、蛋白质含量的影响. 动物学研究, 2003, 24(2): 94—98 doi: 10.3321/j.issn:0254-5853.2003.02.003 Deng L, Zhang W M, Lin H R. Effects of starvation on the contents of growth hormone and triiodothyronine in serum, and lipid and protein of white muscles and livers in black seabreams [J]. Zoological Research, 2003, 24(2): 94—98 doi: 10.3321/j.issn:0254-5853.2003.02.003
-
期刊类型引用(6)
1. 张雨田,田涛,于晓明,吴忠鑫,李青霞,高东奎. 光照颜色对许氏平鲉幼鱼行为和生理的影响. 上海海洋大学学报. 2024(06): 1392-1405 .  百度学术
百度学术
2. 王文雯,胡静,周胜杰,杨蕊,马振华. 小头鲔幼鱼不同消化器官中消化酶活性分析. 天津农学院学报. 2023(04): 27-31 .  百度学术
百度学术
3. 王荟杰,刘越,代乾良,武世雄,王伟. 不同光照强度对黄盖鲽仔稚鱼摄食情况的影响. 安徽农业科学. 2022(03): 79-83 .  百度学术
百度学术
4. 曹晓慧,刘晃. 养殖鱼类摄食行为的特征提取研究与应用进展. 渔业现代化. 2021(02): 1-8 .  百度学术
百度学术
5. 陈吉圣,席世改,秦传新,郭禹,潘莞倪,邵广彧. 光照强度对紫海胆浮游幼体生长及消化酶活性的影响. 渔业科学进展. 2021(03): 125-131 .  百度学术
百度学术
6. 唐荣,陈军,刘世晶,汤涛林. 基于声学方法的水产养殖投饲反馈技术研究进展. 渔业现代化. 2019(03): 15-21 .  百度学术
百度学术
其他类型引用(6)



 下载:
下载: