EFFECTS OF DIETARY SUPPLEMENTATION WITH GLUTATHIONE ON TISSUE GSH LEVEL, IMMUNITY, AND ANTIOXIDANT CAPACITY OF JUVENILE YELLOW CATFISH (PELTEOBAGURS FULVIDRACO)
-
摘要: 研究旨在探讨饲料中添加还原型谷胱甘肽(Glutathione, GSH)对黄颡鱼幼鱼(Pelteobagrus fulvidraco)组织谷胱甘肽含量、免疫及抗氧化性能的影响。选用初始体重为(1.32±0.01) g的黄颡鱼800尾, 随机分为5组, 每组4个重复, 每个重复40 尾鱼, 分别投喂基础饲料和添加100、300、500和700 mg/kg GSH的试验饲料, 饲养56d后采样分析, 并采用氯化铵进行96h氨氮应激试验。结果表明: 除100 mg/kg组外, 饲料中添加GSH显著提高黄颡鱼肝脏、血清GSH含量(P<0.05), 当GSH添加量≥300 mg/kg时, 肝脏和血清GSH含量均呈现稳定状态。随着饲料中谷胱甘肽水平的增加, 血清免疫和肝脏抗氧化指标均呈现先升高后降低的趋势, 其中300和500 mg/kg组溶菌酶与碱性磷酸酶活性、300 mg/kg组免疫球蛋白M与补体4含量、500 mg/kg组酸性磷酸酶活性与对照组相比显著升高(P<0.05)。与对照组和700 mg/kg组相比, 300 mg/kg组肝脏超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化酶活性和总抗氧化能力与血清超氧化物歧化酶、谷胱甘肽过氧化酶活性均显著高升高(P<0.05); 且300 mg/kg组血清丙二醛含量显著降低(P<0.05)。氨氮应激96h时, 与对照组相比, 300 mg/kg组肝脏和血清超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化酶活性力均显著升高(P<0.05), 且300 mg/kg组血清丙二醛含量显著降低(P<0.05)。由此可见, 饲料中添加谷胱甘肽能提高黄颡鱼幼鱼组织谷胱甘肽含量、免疫及抗氧化性能, 其中以300—500 mg/kg为宜。Abstract: To assess the effects of dietary supplementation with glutathione (GSH) on tissue GSH levels, immunity, and antioxidant capacity of juvenile yellow catfish (Pelteobagrus fulvidraco), a total of 800 yellow catfish with a mean body weight of (1.32±0.01) g were considered and randomly divided into 5 groups with 4 replicates per each group and 40 fish per each replicate as well. During 56d, the fish were fed by a basal diet and four test diets, which supplemented with 100, 300, 500, and 700 mg/kg of reduced GSH, respectively. The results indicated that, except for 100 mg/kg group, supplementation with GSH significantly increased the GSH content in liver and serum of yellow catfish (P<0.05). When GSH level was 300 mg/kg or higher, GSH content in liver and serum was in a stable state. With the increase of glutathione level, the immunity and antioxidant indices were initially increased, and then decreased. The lysozyme and alkaline phosphatase activities in 300 and 500 mg/kg groups, immunoglobulin M (IgM) and complement component 4 (C4) contents in 300 mg/kg group, and acid phosphatase activity in 500 mg/kg group markedly increased, compared with the control group (P<0.05). There were no significant differences (P>0.05) in complement component 3 (C3) and nitric oxide contents among all groups. Compared with the control and 700 mg/kg groups, the liver superoxide dismutase, catalase and glutathione peroxidase activities, total antioxidant capacity and the serum superoxide dismutase, as well as glutathione peroxidase activities in 300 mg/kg group were significantly higher (P<0.05), while the serum malondialdehyde content in that group was considerably lower (P<0.05). Under ammonia-nitrogen stress for 96h, compared with the control group, the liver and serum superoxide dismutase, catalase, and glutathione peroxidase activities in 300 mg/kg group were significantly greater (P<0.05), however, the serum malondialdehyde content in the mentioned group was significantly lower (P<0.05). In conclusion, dietary supplementation with GSH could enhance the tissue GSH level, immunity and antioxidant capacity of juvenile yellow catfish, and the effective range of this enhancement was 300 to 500 mg/kg as well.
-
黄颡鱼(Pelteobagrus fulvidraco)隶属于鲇形目(Siluriformes)、鲿科(Bagridae)、黄颡鱼属(Pelteobagrus), 是我重要的养殖品种, 其肉质鲜美, 深受消费者欢迎, 具有广阔的养殖前景。近年来, 我国黄颡鱼养殖业快速发展, 集约化模式下各种氧化应激因子不断增加, 其中氨氮应激是重要因素之一。在集约化高密度养殖水体中, 残饵和鱼体代谢物大量富集发酵成氨氮, 这使得鱼体抗氧化性能和免疫性能降低, 严重影响了黄颡鱼养殖产业的发展[1]。近年来, 应用营养免疫调控理论, 来提高水产动物机体的抗氧化应激能力和免疫性能, 越来越受到广大研究者的关注。
谷胱甘肽(Glutathione, GSH) 是由半胱氨酸(Cysteine)、甘氨酸(Glycine)及谷氨酸(Glutamine)经肽键缩合成的生物活性三肽, 是一种天然的抗氧化剂, 能增强动物的免疫和抗氧化性能。研究表明, GSH在清除活性自由基、缓解毒素及调节免疫系统上具有重要作用, 能增强动物免疫、抗氧化、抗应激性能[2]。相关报道显示, GSH能有效提高吉富罗非鱼(GIFT)[3]、草鱼(Ctenopharyngodon idellus)[4]、奥尼罗非鱼(Oreochromis niloticus×O. aureus)[5]、皱纹盘鲍(Haliotis discus hannai)[6]、牙鲆(Paralichthys olivaceus)[7]、凡纳滨对虾(Litopenaeus vannamei)[8]的抗氧化性能, 改善吉富罗非鱼[3]、草鱼[4]、奥尼罗非鱼[5]、凡纳滨对虾[8]的免疫性能, 并提高其抗病原菌感染和抗氨氮、亚硝酸盐应激能力。本试验前期研究发现, 在饲料中添加适量的GSH能显著提高黄颡鱼的生长性能及降低氨氮应激时的累计死亡率, 并得出在黄颡鱼饲料中GSH的适宜用量为357.69 mg/kg[9], 但关于GSH对黄颡鱼组织GSH含量、免疫及抗氧化性能的作用效果及提高抗氨氮能力的作用机理尚未见报道。为此, 本试验研究了饲料中添加GSH对黄颡鱼组织GSH含量和免疫、抗氧化性能以及氨氮应激时抗氧化指标的影响, 以期在黄颡鱼的养殖产业中提供GSH的应用依据。
1. 材料与方法
1.1 试验饲料
参考陈启明等[10]的黄颡鱼配方配制基础饲料, 其配方成分和营养水平见表 1。分别在基础饲料(对照组, G0)中添加100、300、500和700 mg/kg的GSH(AMRESCO公司(美国), 纯度>98.0%, 还原型), 配成4种饲料, 分别记作G100、G300、G500和G700试验组。饲料原料经60 目筛粉碎后, 逐级扩大加入微量成分, 因GSH易溶于水, 采用溶水后加入。均匀混合后用双螺杆挤压机(华南理工大学, SLX-80)挤条, 并用制粒机制粒, 在烘箱中55℃烘干大约6h, 冷却至室温后密封保存于–20℃条件下。
表 1 基础饲料组成及营养水平(风干基础)Table 1. Composition and nutrient levels of basal diet (air- dried basis)(%)原料Ingredient 含量Content 原料Ingredient 含量Content 鱼粉Fish meal 25.00 氯化胆碱Choline chloride 0.40 豆粕Soybean meal 30.00 VC酯Vitamin Cester 0.10 菜粕Rapeseed meal 9.00 磷酸二氢钙Ca(H2PO4)2 1.30 玉米蛋白粉Corn gluten meal 6.00 矿物质预混料Mineral premix1) 0.50 高筋面粉High gluten wheat flour 22.50 维生素预混料Vitamin premix2) 0.10 鱼油Fish oil 2.00 蛋氨酸L-Met3) 0.20 豆油Soybean oil 2.00 赖氨酸L-Lys3) 0.90 营养水平Nutritional level4) 粗蛋白Crude protein 41.48 粗灰分Ash 7.82 粗脂肪Crude lipid 7.50 水分Moisture 7.75 总能Gross energy (kJ/g) 19.12 能蛋比Energy and protein ratio 46.09 注: 1)每千克矿物质预混料中包含: MgSO4·H2O 12 g, Ca(IO3)2 9 g, KCl 36 g, Met-Cu 1.5 g, ZnSO4·H2O 10 g, FeSO4·H2O 1 g, Met-Co 0.25 g, NaSeO3 0.0036 g; 水分≤10%; 2)每千克维生素预混料中包含: VA 3200000 IU, VB1 4 g, VB2 8 g, VB6 4.8 g, VB12 0.016 g, VD 1600000 IU, VE 16 g, VK 4 g, 烟酸 28 g, 泛酸钙16 g, 叶酸 1.28 g, 肌醇40 g, 生物素0.064 g; 水分≤10%; 3)由广东省农业科学院动物科学研究所, 飞禧特生物科技有限公司提供; 4)营养水平为实际检测值 Note: 1)One kilogram of mineral premix contained the following: MgSO4·H2O 12 g, Ca(IO3)2 9 g, KCl 36 g, Met-Cu 1.5 g, ZnSO4·H2O 10 g, FeSO4·H2O 1 g, Met-Co 0.25 g, NaSeO3 0.0036 g; moisture≤10%; 2)One kilogram of vitamin premix contained the following: VA 3200000 IU, VB1 4 g, VB2 8 g, VB6 4.8 g, VB12 0.016 g, VD 1600000 IU, VE 16 g, VK 4 g, nicotinic acid 28 g, calcium pantothenate 16 g, folic acid 1.28 g, inositol 40 g, biotin 0.064 g; moisture≤10%; 3)Obtained from Fishtech Biological Science & Technology Company, LTD, Institute of Animal Science, Guangdong Academy of Agricultural Sciences (Guangzhou, China); 4)Nutrient levels were measured values 1.2 试验鱼与饲养管理
从清远市黄沙渔业基地购买试验用黄颡鱼。参考周艳玲等[9], 鱼苗先于暂养池中驯养2周后开始正式试验。饲养试验在广东省农业科学院动物科学研究所300 L的20个室内循环水养殖桶内开展。选用800尾均重为(1.32±0.02) g幼鱼, 完全随机放入20个养殖桶中, 每个桶40尾鱼, 试验设置4个重复, 试验开始后分别投喂5组饲料。每天投喂2次(08:30和18:30), 投喂体重的4%—6%, 并根据摄食情况及时调整投喂量。每天排污, 隔天换水, 饲养持续56d。在饲养过程中, 溶氧>6.0 mg/L, 氨氮<0.2 mg/L, 亚硝酸氮<0.01 mg/L, 水温28—32℃, pH在7.5—8.0, 自然光照。
1.3 氨氮应激试验
参考周艳玲等[9], 在56d养殖结束后, 每个桶取规格均一的20尾鱼开展96h的氨氮应激试验。向150 L水体中加入浓度为10 g/L的氯化铵母液, 使非离子氨浓度达到2.58 mg/L [pH 7.5, 温度(27±1)℃], 参考李波等[11]的方法计算非离子氨浓度。氨氮应激试验期间继续投喂试验饲料, 应激开始后, 停止循环, 每6h检测pH和水温, 并基本保证氨应激浓度。试验用水为曝气2d的养殖用水。氯化铵母液的配制方法和非离子氨的计算公式如下:
氯化铵母液的配制: 先将分析纯NH4Cl烘干至恒重, 然后向每升水中加入29.72 g的NH4Cl配成总氨浓度为10 g/L的母液。
非离子氨的计算公式:
非离子氨浓度=总氨浓度/[10×(pKa–pH)+1]
其中, pKa=0.09018+2729.92/T(T为开氏温度)
1.4 样品采集与分析
养殖试验结束禁食24h和氨氮应激试验结束后分别采样。每个桶捞取6尾鱼, 迅速用MS-222将其麻醉, 从尾静脉采血, 并解剖采集肝脏。血液4℃下45°倾斜放置4h, 然后在4℃下离心10min (3500 r/min), 分离血清于–80℃条件下保存, 用于免疫指标检测。肝脏以1﹕9加预冷匀浆液匀浆, 在4℃下离心10min (3 000 r/min), 去沉淀, 留上清制备肝脏匀浆液, 全过程低温操作, 保存于–20℃条件下, 用于抗氧化指标检测。
LZM采用比浊法测定, ACP活性采用分光光度法测定, AKP活性采用磷酸苯二钠比色法测定, C3、C4、IgM含量用生物素双抗体夹心酶联免疫吸附法测定, NO含量采用硝酸还原酶法测定。SOD活性用羟胺法测定, CAT活性用可见分光光度法测定, GPX活性、GSTs活性、还原型谷胱甘肽含量和T-AOC用比色法测定, MDA含量用TBA法测定, 所有试剂盒均购自南京建成。
1.5 统计分析
采用SPSS 20.0软件对各项检测指标进行单因素方差分析, 若组间有显著差异(P<0.05), 则作Duncan氏多重比较检验。各项检测指标均以平均值±标准差(Mean±SD,n=4)表示。
2. 结果
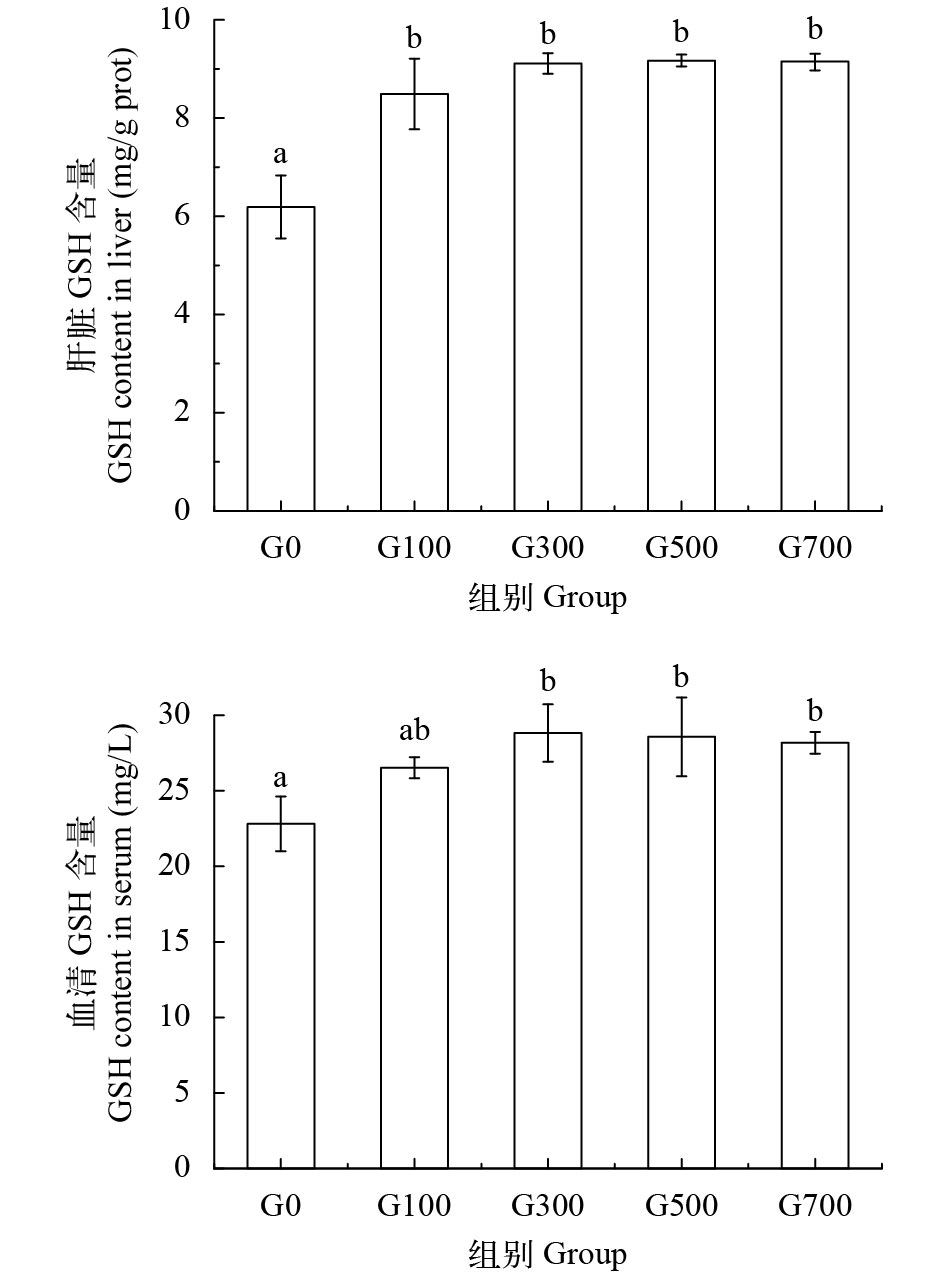
2.1 饲料中添加GSH对黄颡鱼组织GSH含量的影响
由图 1可知, 除G100组外, 饲料中添加GSH显著提高黄颡鱼肝脏、血清GSH含量(P<0.05), 当GSH添加量≥300 mg/kg时, 肝脏和血清GSH含量呈现稳定状态。
2.2 饲料中添加GSH对黄颡鱼血清免疫指标的影响
由表 2可知, 各免疫指标均随着饲料中GSH水平的增加呈现先升高后降低的趋势, 且各添加组的免疫指标均高于对照组, 并均在G300或G500组达到最大值。其中, 与对照组相比, G300和G500组LZM与AKP活性、G300组IgM与C4含量、G500组ACP活性显著升高(P<0.05)。各组C3和NO含量无显著差异(P>0.05)。
表 2 饲料中添加GSH对黄颡鱼血清免疫指标的影响Table 2. Effects of dietary supplementation with GSH on serum immune indices of yellow catfish (Pelteobagrus fulvidraco)项目Item G0 G100 G300 G500 G700 溶菌酶LZM (μg/mL) 1.55±0.08a 1.61±0.04ab 1.74±0.16bc 1.78±0.01c 1.69±0.10abc 酸性磷酸酶ACP (U/100mL) 24.22±3.59a 26.22±4.19ab 27.76±1.92ab 30.11±3.04b 28.87±2.17ab 碱性磷酸酶AKP (U/L) 23.25±3.50a 24.50±1.29ab 30.00±3.61c 28.50±2.38bc 26.33±2.52abc 免疫球蛋M IgM (g/L) 0.34±0.03a 0.37±0.07ab 0.44±0.07b 0.36±0.05ab 0.35±0.05ab 补体3 C3 (g/L) 0.29±0.06 0.38±0.10 0.42±0.10 0.40±0.18 0.32±0.03 补体4 C4 (g/L) 0.14±0.10a 0.20±0.05ab 0.28±0.07b 0.22±0.05ab 0.18±0.10ab 一氧化氮NO (μmol/L) 91.23±20.04 95.23±8.38 102.63±9.13 94.90±8.24 93.62±24.48 注: 表中同一行内, 数据右上角没有或者具有相同英文字母表示差异不显著(P>0.05), 标有不同英文字母表示差异显著(P<0.05)。下同 Note: In the same row, values with no or the same letter superscripts mean no significant difference (P>0.05), and with different letter superscripts mean significant difference (P<0.05). The same applies below 2.3 饲料中添加GSH对黄颡鱼肝脏抗氧化指标的影响
由表 3和表 4可知, 饲料中GSH水平能显著提高肝脏和血清SOD、CAT、GPX活性和T-AOC (P<0.05), 并能降低肝脏和血清MDA含量; 其中与G0和G700组相比, G300组肝脏SOD、CAT、GPX活性和T-AOC与G300组血清SOD、GPX活性均显著升高(P<0.05), 且G300组血清MDA含量显著低降低(P<0.05)。
表 3 饲料中添加GSH对黄颡鱼肝脏抗氧化指标的影响Table 3. Effects of dietary supplementation with GSH on liver antioxidant indices of yellow catfish (Pelteobagrus fulvidraco)项目Item G0 G100 G300 G500 G700 超氧化物歧化酶SOD (U/mgprot) 37.39±1.60a 49.39±1.68b 55.81±2.65c 46.03±0.41b 38.05±2.08a 过氧化氢酶CAT (U/mgprot) 17.52±1.73a 20.35±2.22b 26.28±1.64d 23.21±0.97c 17.95±0.30ab 谷胱甘肽过氧化酶GPX (U/mgprot) 98.92±6.98a 123.49±2.16ab 158.88±27.07b 152.64±38.27b 112.30±8.46a 谷胱甘肽硫转移酶GSTs (U/mgprot) 6.05±0.42 5.93±1.17 5.19±0.41 5.71±0.66 7.59±0.23 总抗氧化能力T-AOC (U/mgprot) 0.87±0.09a 1.16±0.15b 1.46±0.22c 1.21±0.18b 1.01±0.05b 丙二醛MDA (nmol/mgprot) 1.65±0.43 1.51±0.32 1.34±0.05 1.41±0.40 1.61±0.39 表 4 饲料中添加GSH对黄颡鱼血清抗氧化指标的影响Table 4. Effects of dietary supplementation with GSH on serum antioxidant indices of yellow catfish (Pelteobagrus fulvidraco)项目Item G0 G100 G300 G500 G700 超氧化物歧化酶SOD (U/mL) 42.68±4.63a 50.88±3.76b 64.93±3.82c 59.98±5.40c 49.27±6.40ab 过氧化氢酶CAT (U/mL) 24.66±4.28 27.48±9.34 30.21±5.34 27.21±4.52 24.56±1.11 谷胱甘肽过氧化酶GPX (U/mL) 201.87±5.84a 224.34±17.11ab 236.63±22.76b 228.45±27.35ab 202.23±10.29a 总抗氧化能力T-AOC (U/mL) 1.86±0.37a 2.45±0.29ab 3.21±0.50b 2.81±0.74b 2.43±0.50ab 丙二醛MDA (nmol/mL) 3.93±0.15c 3.14±0.06b 2.29±0.26a 2.64±0.36a 3.61±0.28c 2.4 饲料中添加GSH对黄颡鱼氨氮应激时肝脏抗氧化指标的影响
由表 5和表 6可知, 氨氮应激96h时, G300和G500组肝脏SOD、CAT、GPX活性和T-AOC均显著高于G0和G700组(P<0.05), G300组血清SOD、CAT、GPX活性显著高于G0组(P<0.05); 与对照组相比, 各添加组肝脏和血清MDA含量均有不同程度的降低, 其中添加组血清MDA达到显著水平(P<0.05), 其最低值出现在G300组。
表 5 饲料中添加GSH对黄颡鱼氨氮应激96h肝脏抗氧化指标的影响Table 5. Effects of dietary supplementation with GSH on liver antioxidant indices of yellow catfish (Pelteobagrus fulvidraco) under ammonia-nitrite stress for 96h项目Item G0 G100 G300 G500 G700 超氧化物岐化酶SOD (U/mL) 22.07±1.71a 30.67±2.19b 35.19±1.23c 32.59±2.36bc 22.35±1.63a 过氧化氢酶CAT (U/mL) 5.90±0.78a 9.67±1.39b 12.49±1.68c 10.02±0.55b 6.46±1.14a 谷胱甘肽过氧化酶GPX (U/mL) 60.51±13.74a 95.38±7.31b 136.55±8.56c 109.47±9.24b 72.46±3.17a 总抗氧化能力T-AOC (U/mL) 0.66±0.06a 0.92±0.05b 1.22±0.04c 1.19±0.10c 0.89±0.09b 丙二醛MDA (nmol/mL) 2.73±0.29 2.53±0.29 2.26±0.11 2.38±0.41 2.64±0.33 表 6 饲料中添加GSH对黄颡鱼氨氮应激96h血清抗氧化指标的影响Table 6. Effects of dietary supplementation with GSH on serum antioxidant indices of yellow catfish (Pelteobagrus fulvidraco) under ammonia-nitrite stress for 96h项目Item G0 G100 G300 G500 G700 超氧化物岐化酶SOD (U/mgprot) 35.62±3.75a 41.45±2.04ab 43.41±5.56b 40.29±3.25ab 37.10±4.05ab 过氧化氢酶CAT (U/mgprot) 14.39±1.52a 17.78±5.13ab 20.64±0.99b 18.81±3.64ab 17.52±3.90ab 谷胱甘肽过氧化酶GPX (U/mgprot) 179.13±29.27a 209.45±16.37ab 232.94±26.82b 208.74±37.50ab 182.38±22.94ab 总抗氧化能力T-AOC (U/mgprot) 0.98±0.29 1.05±0.16 1.27±0.22 1.08±0.38 1.01±0.11 丙二醛MDA (nmol/mgprot) 4.97±0.12c 3.72±0.16b 2.39±0.06a 2.74±0.19a 3.83±0.16b 3. 讨论
3.1 GSH对黄颡鱼组织GSH含量的影响
GSH是机体抗氧化系统的重要组成部分, 是GPX、GST两种酶的反应底物, 缺乏会引起机体氧化应激、代谢絮乱甚至发生疾病[12, 13]。GSH在动物体内的吸收主要为两种方式, 一种通过载体介导跨细胞基底膜直接以三肽形式吸收, 另一种通过γ-谷氨酰循环降解为氨基酸, 重吸收后合成GSH[14]。Alton Meister[15]研究发现, GSH在体内经γ-谷氨酰半胱氨酸合酶与谷胱甘肽合酶经两步途径重新合成, 其中半胱氨酸是体内再合成的限速因子, 肝脏既是GSH合成的主要部位, 同时也是消耗的主要部位, 合成的GSH经肝血窦流入血液或通过毛细血管流入其他部位[16]。本试验结果表明, 外源加入GSH能显著提高黄颡鱼肝脏和血清GSH含量, 这与在奥尼罗非鱼[5]、皱纹盘鲍[6]的研究结果一致, 这可能是外源GSH的添加促进了三肽吸收和加大了半胱氨酸供给的结果。
本试验结果还显示, 当饲料中GSH添加量≥300 mg/kg时, 黄颡鱼肝脏和血清中GSH含量呈现稳定状态, 该结果与在皱纹盘鲍[6]、牙鲆[7]上的研究相似, 这可能与两个方面的原因有关。机体主要通过抗氧化酶和还原性物质来保护自身免受抗氧化损伤, GSH含有特殊的巯基(-SH), 本身就是还原性物质, GSH的大量存在一定程度上可能会填补体内抗氧化酶不足的抗氧化空缺。在本试验中, 各抗氧化酶活性均在添加量达到300或500 mg/kg后, 呈现下降趋势, 此时黄颡鱼体内的抗氧化保护可能主要通过消耗大量的外源GSH来实现, 从而导致体内GSH含量不随外源GSH水平的增加而增加, 最终呈现稳定状态。亦有研究表明, GSH在自然界中以还原型(GSH)和氧化型(GSSG)两种形态存在, 在正常情况下, 大多数细胞中氧化型和还原型的比例约为1﹕100, 胞内过高浓度的GSH可能对宿主细胞产生代谢毒性[17, 18], 这可能会使得机体将体内的GSH恒定在一定水平。然而, 在牙鲆的研究中发现, 在GSH补充剂量达到1100 mg/kg时, 牙鲆组织内的GSH含量显著低于其他添加量组[19]。关于外源GSH对体内GSH含量的影响及作用机制有待进一步研究。
3.2 GSH对黄颡鱼免疫性能的影响
目前, 临床上GSH已被用于多项免疫相关疾病的研究及治疗, 陆生动物和水生动物上也有不少研究, 均表明GSH能很好的提高机体免疫性能。LZM、ACP、AKP、C3、C4、IGM和NO都是反应机体免疫性能的重要指标。在本试验中, 各免疫指标均随着饲料中GSH水平的增加呈现先升高后降低的趋势, 且各免疫指标均高于对照组, 且均是300或500 mg/kg组的值最大, 这与周婷婷等[20]在吉富罗非鱼、曹俊明等[21]在凡纳滨对虾和Ming等[3]在草鱼的研究结果一致, 这说明适量GSH能提高黄颡鱼免疫性能, 过量GSH反而不利于机体免疫性能的提升。GSH对黄颡鱼免疫性能的提升可能是通过提高机体抗氧化防御能力实现的。研究发现, 动物机体的免疫紊乱往往涉及氧化应激和炎症反应等表现, 而GSH作为生物体极为重要的抗氧化活性物质, 早已在临床医学上治疗多种疾病[22]。李继东等[23]报道, GSH可通过抑制氧化应激、炎症反应阻止兔动脉粥样硬化的发生、发展。Louw等[24]指出, 外源补充GSH可以明显缓解非洲人冠心病发展。然而, 在GSH过量过后, 大量的GSH在跨膜转运时, 会对机体细胞产生毒性, 使得机体产生免疫氧化, 导致免疫抑制[18]。关于GSH在水生动物上的免疫研究目前还较少, GSH对水生动物免疫性能的影响及作用机制有待深入探讨。
3.3 GSH对黄颡鱼抗氧化性能的影响
与陆生动物一样, 鱼类在进化过程中也产生了酶和非酶系统来保护机体免受氧化损伤, 其中SOD、CAT、GPX就是主要的抗氧化酶, 它们在清除自由基、缓解氧化应激和保护细胞完整性上发挥着重要作用, 这些酶活性的升高往往预示着抗氧化性能的提高[6, 25]。此外, T-AOC作为评价机体抗氧化性能的总体指标和MDA作为反映体内脂质过氧化水平的敏感指标, 它们也可反应机体的抗氧化性能。研究报道, GSH作为良好的抗氧化物质, 显著增强了吉富罗非鱼[26]和和草鱼[4]血清抗氧化酶活性, 并降低了组织MDA的含量, 使鱼体表现出较好的抗氧化性能。在本试验中, 各添加组肝脏和血清SOD、CAT、GPX活性和T-AOC值均有不同程度升高, 在300 mg/kg组均显著高于对照组, 各添加组肝脏和血清MDA含量也有不同程度的降低, 这与上述的研究结果相似。这说明与其他水生动物一样, GSH能通过提高体内抗氧化酶活性来改善黄颡鱼的抗氧化系统, 最终提高机体的抗氧化性能。
在本试验中, 当GSH的添加量超过300 mg/kg时, 黄颡鱼肝脏和血清SOD、CAT、GPX活性和T-AOC值均有不同程度降低, 表现为抗氧化性能降低, 并伴有MDA含量升高的氧化损伤。王芳青等[7]在牙鲆、刘晓华等[8]在凡纳滨对虾中也发现, 饲料中添加适量的GSH能增强试验动物的抗氧化性能, 但超过一定水平后, 作用反而不明显。研究表明, 虽然GSH是细胞内重要的清除剂, 但过高的GSH会产生细胞毒性, 并表现出促氧化性质[18, 27]。亦有报道显示, 过多的GSH会与卤烯烃、醌类、醛类等结合成毒性代谢物, 进而在体内产生氧自由基, 最终对机体产生氧化应激损伤[28]。高姝娟等[29]和Sah等[30]也指出, GSH作为氧化物的前体, 浓度过高时会产生毒性, 会使DNA损伤。
3.4 GSH对氨氮应激时黄颡鱼抗氧化性能的影响
研究表明, 鱼长期处于氨氮应激下, 其生长性能和免疫力均会下降, 与此同时, 机体受到应激也会使体内抗氧化酶活性降低, 使得过多的自由基不能清除, 有氧代谢途径中的非正常氧化反应风险增大, 从而增加机体的抗氧化系统压力, 最终对机体产生不良影响[31]。研究报道, 在处于氨氮应激时, 机体会通过SOD、CAT、GPX等抗氧化酶的联合作用来缓解应激损伤, 这也是机体克服不良环境的适应性反应[32]。而胡毅等[33]研究发现, 高浓度的氨氮会使青鱼的SOD、CAT活性及T-AOC较降低。在本试验中, 对比表 3和表 5、表 4和表 6, 作者也发现应激后肝脏和血清SOD、CAT、GPX活性和T-AOC均有所降低。Xu等[34]研究表明, GSH能有效增强凡纳滨对虾的抗氨氮应激能力, 改善成活率和缓解肝脏抗氧化酶降低的幅度。周婷婷等[26]研究发现, GSH能有效降低吉富罗非鱼在96h亚硝酸盐应激下的累计死亡率, 提高其抗亚硝酸盐应激能力。在本试验中, 在黄颡鱼饲料中添加GSH, 氨氮应激96h时, 其肝脏和血清SOD、CAT、GPX活性均随着GSH水平的增加呈现先升高后降低的趋势, 并在300 mg/kg组显著高于对照组, 且各添加组的MDA含量均较对照组降低, 这说明适量添加GSH可以激活黄颡鱼的肝脏抗氧化系统, 并通过调节抗氧化酶的活性变化来加强对自由基的清除能力, 最终缓解由氨氮应激引起的应激反应。
综上所述, 饲料中添加谷胱甘肽能提高黄颡鱼组织谷胱甘肽含量、免疫及抗氧化性能, 但过量的GSH不利于黄颡鱼机体免疫和抗氧化性能的提升, 综合分析得出GSH在黄颡鱼上的适宜用量为300—500 mg/kg, 这与本试验前期的研究结果相符。
-
表 1 基础饲料组成及营养水平(风干基础)
Table 1 Composition and nutrient levels of basal diet (air- dried basis)(%)
原料Ingredient 含量Content 原料Ingredient 含量Content 鱼粉Fish meal 25.00 氯化胆碱Choline chloride 0.40 豆粕Soybean meal 30.00 VC酯Vitamin Cester 0.10 菜粕Rapeseed meal 9.00 磷酸二氢钙Ca(H2PO4)2 1.30 玉米蛋白粉Corn gluten meal 6.00 矿物质预混料Mineral premix1) 0.50 高筋面粉High gluten wheat flour 22.50 维生素预混料Vitamin premix2) 0.10 鱼油Fish oil 2.00 蛋氨酸L-Met3) 0.20 豆油Soybean oil 2.00 赖氨酸L-Lys3) 0.90 营养水平Nutritional level4) 粗蛋白Crude protein 41.48 粗灰分Ash 7.82 粗脂肪Crude lipid 7.50 水分Moisture 7.75 总能Gross energy (kJ/g) 19.12 能蛋比Energy and protein ratio 46.09 注: 1)每千克矿物质预混料中包含: MgSO4·H2O 12 g, Ca(IO3)2 9 g, KCl 36 g, Met-Cu 1.5 g, ZnSO4·H2O 10 g, FeSO4·H2O 1 g, Met-Co 0.25 g, NaSeO3 0.0036 g; 水分≤10%; 2)每千克维生素预混料中包含: VA 3200000 IU, VB1 4 g, VB2 8 g, VB6 4.8 g, VB12 0.016 g, VD 1600000 IU, VE 16 g, VK 4 g, 烟酸 28 g, 泛酸钙16 g, 叶酸 1.28 g, 肌醇40 g, 生物素0.064 g; 水分≤10%; 3)由广东省农业科学院动物科学研究所, 飞禧特生物科技有限公司提供; 4)营养水平为实际检测值 Note: 1)One kilogram of mineral premix contained the following: MgSO4·H2O 12 g, Ca(IO3)2 9 g, KCl 36 g, Met-Cu 1.5 g, ZnSO4·H2O 10 g, FeSO4·H2O 1 g, Met-Co 0.25 g, NaSeO3 0.0036 g; moisture≤10%; 2)One kilogram of vitamin premix contained the following: VA 3200000 IU, VB1 4 g, VB2 8 g, VB6 4.8 g, VB12 0.016 g, VD 1600000 IU, VE 16 g, VK 4 g, nicotinic acid 28 g, calcium pantothenate 16 g, folic acid 1.28 g, inositol 40 g, biotin 0.064 g; moisture≤10%; 3)Obtained from Fishtech Biological Science & Technology Company, LTD, Institute of Animal Science, Guangdong Academy of Agricultural Sciences (Guangzhou, China); 4)Nutrient levels were measured values 表 2 饲料中添加GSH对黄颡鱼血清免疫指标的影响
Table 2 Effects of dietary supplementation with GSH on serum immune indices of yellow catfish (Pelteobagrus fulvidraco)
项目Item G0 G100 G300 G500 G700 溶菌酶LZM (μg/mL) 1.55±0.08a 1.61±0.04ab 1.74±0.16bc 1.78±0.01c 1.69±0.10abc 酸性磷酸酶ACP (U/100mL) 24.22±3.59a 26.22±4.19ab 27.76±1.92ab 30.11±3.04b 28.87±2.17ab 碱性磷酸酶AKP (U/L) 23.25±3.50a 24.50±1.29ab 30.00±3.61c 28.50±2.38bc 26.33±2.52abc 免疫球蛋M IgM (g/L) 0.34±0.03a 0.37±0.07ab 0.44±0.07b 0.36±0.05ab 0.35±0.05ab 补体3 C3 (g/L) 0.29±0.06 0.38±0.10 0.42±0.10 0.40±0.18 0.32±0.03 补体4 C4 (g/L) 0.14±0.10a 0.20±0.05ab 0.28±0.07b 0.22±0.05ab 0.18±0.10ab 一氧化氮NO (μmol/L) 91.23±20.04 95.23±8.38 102.63±9.13 94.90±8.24 93.62±24.48 注: 表中同一行内, 数据右上角没有或者具有相同英文字母表示差异不显著(P>0.05), 标有不同英文字母表示差异显著(P<0.05)。下同 Note: In the same row, values with no or the same letter superscripts mean no significant difference (P>0.05), and with different letter superscripts mean significant difference (P<0.05). The same applies below 表 3 饲料中添加GSH对黄颡鱼肝脏抗氧化指标的影响
Table 3 Effects of dietary supplementation with GSH on liver antioxidant indices of yellow catfish (Pelteobagrus fulvidraco)
项目Item G0 G100 G300 G500 G700 超氧化物歧化酶SOD (U/mgprot) 37.39±1.60a 49.39±1.68b 55.81±2.65c 46.03±0.41b 38.05±2.08a 过氧化氢酶CAT (U/mgprot) 17.52±1.73a 20.35±2.22b 26.28±1.64d 23.21±0.97c 17.95±0.30ab 谷胱甘肽过氧化酶GPX (U/mgprot) 98.92±6.98a 123.49±2.16ab 158.88±27.07b 152.64±38.27b 112.30±8.46a 谷胱甘肽硫转移酶GSTs (U/mgprot) 6.05±0.42 5.93±1.17 5.19±0.41 5.71±0.66 7.59±0.23 总抗氧化能力T-AOC (U/mgprot) 0.87±0.09a 1.16±0.15b 1.46±0.22c 1.21±0.18b 1.01±0.05b 丙二醛MDA (nmol/mgprot) 1.65±0.43 1.51±0.32 1.34±0.05 1.41±0.40 1.61±0.39 表 4 饲料中添加GSH对黄颡鱼血清抗氧化指标的影响
Table 4 Effects of dietary supplementation with GSH on serum antioxidant indices of yellow catfish (Pelteobagrus fulvidraco)
项目Item G0 G100 G300 G500 G700 超氧化物歧化酶SOD (U/mL) 42.68±4.63a 50.88±3.76b 64.93±3.82c 59.98±5.40c 49.27±6.40ab 过氧化氢酶CAT (U/mL) 24.66±4.28 27.48±9.34 30.21±5.34 27.21±4.52 24.56±1.11 谷胱甘肽过氧化酶GPX (U/mL) 201.87±5.84a 224.34±17.11ab 236.63±22.76b 228.45±27.35ab 202.23±10.29a 总抗氧化能力T-AOC (U/mL) 1.86±0.37a 2.45±0.29ab 3.21±0.50b 2.81±0.74b 2.43±0.50ab 丙二醛MDA (nmol/mL) 3.93±0.15c 3.14±0.06b 2.29±0.26a 2.64±0.36a 3.61±0.28c 表 5 饲料中添加GSH对黄颡鱼氨氮应激96h肝脏抗氧化指标的影响
Table 5 Effects of dietary supplementation with GSH on liver antioxidant indices of yellow catfish (Pelteobagrus fulvidraco) under ammonia-nitrite stress for 96h
项目Item G0 G100 G300 G500 G700 超氧化物岐化酶SOD (U/mL) 22.07±1.71a 30.67±2.19b 35.19±1.23c 32.59±2.36bc 22.35±1.63a 过氧化氢酶CAT (U/mL) 5.90±0.78a 9.67±1.39b 12.49±1.68c 10.02±0.55b 6.46±1.14a 谷胱甘肽过氧化酶GPX (U/mL) 60.51±13.74a 95.38±7.31b 136.55±8.56c 109.47±9.24b 72.46±3.17a 总抗氧化能力T-AOC (U/mL) 0.66±0.06a 0.92±0.05b 1.22±0.04c 1.19±0.10c 0.89±0.09b 丙二醛MDA (nmol/mL) 2.73±0.29 2.53±0.29 2.26±0.11 2.38±0.41 2.64±0.33 表 6 饲料中添加GSH对黄颡鱼氨氮应激96h血清抗氧化指标的影响
Table 6 Effects of dietary supplementation with GSH on serum antioxidant indices of yellow catfish (Pelteobagrus fulvidraco) under ammonia-nitrite stress for 96h
项目Item G0 G100 G300 G500 G700 超氧化物岐化酶SOD (U/mgprot) 35.62±3.75a 41.45±2.04ab 43.41±5.56b 40.29±3.25ab 37.10±4.05ab 过氧化氢酶CAT (U/mgprot) 14.39±1.52a 17.78±5.13ab 20.64±0.99b 18.81±3.64ab 17.52±3.90ab 谷胱甘肽过氧化酶GPX (U/mgprot) 179.13±29.27a 209.45±16.37ab 232.94±26.82b 208.74±37.50ab 182.38±22.94ab 总抗氧化能力T-AOC (U/mgprot) 0.98±0.29 1.05±0.16 1.27±0.22 1.08±0.38 1.01±0.11 丙二醛MDA (nmol/mgprot) 4.97±0.12c 3.72±0.16b 2.39±0.06a 2.74±0.19a 3.83±0.16b -
[1] Loong A M, Tan J Y, Wong W P, et al. Defense against environmental ammonia toxicity in the African lungfish, Protopterus aethiopicus: Bimodal breathing, skin ammonia permeability and urea synthesis [J]. Aquatic Toxicology, 2007, 85(1): 76—86
[2] 周艳玲, 孙育平, 黄燕华, 等. 水产动物谷胱甘肽营养生理作用的研究进展. 饲料研究, 2016, (19): 38—43 Zhou Y L, Sun Y P, Huang Y H, et al. Research progress on physiological functions of glutathione in aquaculture animals [J]. Feed Research, 2016, (19): 38—43
周艳玲, 孙育平, 黄燕华, 等. 水产动物谷胱甘肽营养生理作用的研究进展. 饲料研究, 2016, (19): 38—43[3] 周婷婷. 谷胱甘肽对吉富罗非鱼生长性能和抗氧化功能的影响. 硕士学位论文, 华中农业大学, 武汉. 2012 Zhou T T. Effects of dietary glutathione on growth performance and antioxidant function of Oreochromis niloticus [D]. Thesis for Master of Science, Huazhong Agricultural University, Wuhan. 2012
周婷婷. 谷胱甘肽对吉富罗非鱼生长性能和抗氧化功能的影响. 硕士学位论文, 华中农业大学, 武汉. 2012[4] Ming J H, Ye J Y, Zhang Y X, et al. Effects of dietary reduced glutathione on growth performance, non-specific immunity, antioxidant capacity and expression levels of IGF-I and HSP70 mRNA of grass carp (Ctenopharyngodon idella) [J]. Aquaculture, 2015, 438: 39—46
[5] 梁春梅. 还原型GSH对奥尼罗非鱼(Oreochromis niloticus×O. aureus)幼鱼生长、免疫功能的影响及其机理研究. 硕士学位论文, 华南农业大学, 广州. 2006 Liang C M. Effects and mechanism of dietary Reduced GSH in on growth, immune function of tilapia (Oreochromis niloticus * O. aureus) [D]. Thesis for Master of Science, South China Agricultural University, Guangzhou. 2006
梁春梅. 还原型GSH对奥尼罗非鱼(Oreochromis niloticus×O. aureus)幼鱼生长、免疫功能的影响及其机理研究. 硕士学位论文, 华南农业大学, 广州. 2006[6] 陈齐勇. 饲料中α-硫辛酸、谷胱甘肽和硒对皱纹盘鲍(Haliotis discus hannai Ino)生长和抗氧化反应的影响. 硕士学位论文, 中国海洋大学, 青岛. 2010 Chen Q Y. Effects of dietary alpha lipoic acid, glutathione and selenium on growth and antioxidant capacity of Haliotis discus hannai Ino [D]. Thesis for Master of Science, Ocean University of China, Qingdao. 2010
陈齐勇. 饲料中α-硫辛酸、谷胱甘肽和硒对皱纹盘鲍(Haliotis discus hannai Ino)生长和抗氧化反应的影响. 硕士学位论文, 中国海洋大学, 青岛. 2010[7] 王芳倩, 张文兵, 麦康森, 等. 饲料中添加还原型谷胱甘肽对牙鲆生长和抗氧化能力的影响. 中国海洋大学学报自然科学版, 2011, 41(4): 51—56 Wang F Q, Zhang W B, Mai K S. Effects of dietary glutathione on growth and antioxidant capacity of Paralichthys olivaceus[J]. Journal of Ocean University of China (Natural Science), 2011, 41(4): 51—56
王芳倩, 张文兵, 麦康森, 等. 饲料中添加还原型谷胱甘肽对牙鲆生长和抗氧化能力的影响. 中国海洋大学学报自然科学版, 2011, 41(4): 51—56[8] 刘晓华. 谷胱甘肽对凡纳滨对虾抗氧化防御的调控机理. 博士学位论文, 华中农业大学, 武汉. 2010 Liu X H. Regulation mechanism of dietary glutathione on antioxidant defense in Litopenaeus vannamei [D]. Thesis for Doctor of Science, Huazhong Agricultural University, Wuhan. 2010
刘晓华. 谷胱甘肽对凡纳滨对虾抗氧化防御的调控机理. 博士学位论文, 华中农业大学, 武汉. 2010[9] 周艳玲, 孙育平, 曹俊明, 等. 饲料中添加谷胱甘肽对黄颡鱼幼鱼生长性能、体成分、血清生化指标和抗氨氮应激能力的影响. 动物营养学报, 2017, 29(11): 4189—4197 Zhou Y L, Sun Y P, Cao J M, et al. Effects of dietary glutathione on growth performance, body composition, serum biochemical indexes and anti stress ability of juvenile yellow catfish (Pelteobagrus fulvidraco) [J]. Animal Nutrition, 2017, 29(11): 4189—4197
周艳玲, 孙育平, 曹俊明, 等. 饲料中添加谷胱甘肽对黄颡鱼幼鱼生长性能、体成分、血清生化指标和抗氨氮应激能力的影响. 动物营养学报, 2017, 29(11): 4189—4197[10] Chen Q M, Zhao H X, Huang Y H, et al. Effects of dietary arginine levels on growth performance, body composition, serum biochemical indices and resistance ability against ammonia-nitrogen stress in juvenile yellow catfish (Pelteobagrus fulvidraco) [J]. Animal Nutrition, 2016, 2(3): 204—210
[11] 李波, 樊启学, 张磊, 等. 不同溶氧水平下氨氮和亚硝酸盐对黄颡鱼的急性毒性研究. 淡水渔业, 2009, 39(3): 31—35 Li B, Fan Q X, Zhang L, et al. Research of ammonia and nitrite on acute toxicity of Pelteobagrus fulvidraco on different dissolved oxygen levels [J]. Freshwater Fisheries, 2009, 39(3): 31—35
李波, 樊启学, 张磊, 等. 不同溶氧水平下氨氮和亚硝酸盐对黄颡鱼的急性毒性研究. 淡水渔业, 2009, 39(3): 31—35[12] Goc Z, Szaroma W, Kapusta E, et al. Protective effects of melatonin on the activity of SOD, CAT, GSH-Px and GSH content in organs of mice after administration of SNP[J]. Chinese Journal of Physiology, 2017, 60(1): 1—10
[13] Pastore A, Federici G, Bertini E, et al. Analysis of glutathione: implication in redox and detoxification [J]. Clinica Chimica Acta, 2003, 333(1): 19—39
[14] Elskens M T, Jaspers C J, Penninckx M J. Glutathione as an endogenous sulphur source in the yeast Saccharomyces cerevisiae. [J]. Journal of General Microbiology, 1991, 137(3): 637
[15] Meister A, Anderson M E. Glutathione [M]. Annu Rev Biochem. 1983, 52(1): 711—760
[16] 卢永科, 陈新志. 肾脏谷胱甘肽代谢系统及其毒理学意义. 环境卫生学杂志, 2003, 30(5): 274—278 Lu Y K, Chen X Z. Glutathione metabolism system of kidney and its toxicological significance[J]. Journal of Environmental Hygiene, 2003, 30 (5): 274—278
卢永科, 陈新志. 肾脏谷胱甘肽代谢系统及其毒理学意义. 环境卫生学杂志, 2003, 30(5): 274—278[17] Kovaevi T B, Borkovi S S, Pavlovi S. Z, et al. Glutathione as a suitable biomarker in hepatopancreas, gills and muscle of three freshwater crayfish species[J]. Archives of Biological Sciences, 2008, 60(1): 59—66
[18] 王玮玮, 唐亮, 周文龙, 等. 谷胱甘肽生物合成及代谢相关酶的研究进展. 中国生物工程杂志, 2014, 34(7): 89—95 Wang W Wi, Tang L, Zhou W L, et al. Research progress of glutathione biosynthesis and metabolism related enzymes [J]. Chinese Journal of biological engineering, 2014, 34 (7): 89—95
王玮玮, 唐亮, 周文龙, 等. 谷胱甘肽生物合成及代谢相关酶的研究进展. 中国生物工程杂志, 2014, 34(7): 89—95[19] 王芳倩. 饲料中还原型谷胱甘肽、α-硫辛酸及二者分别与硒的交互作用对牙鲆(Paralichthys olivaceus)生长和抗氧化的影响. 硕士学位论文, 中国海洋大学, 青岛. 2010 Wang F Q. Effects of dietary glutathione, alpha lipoic acid and two respectively interactions with selenium on the growth and antioxidant activity of Paralichthys olivaceus [D]. Thesis for Master of Science, Ocean University of China, Qingdao. 2010
王芳倩. 饲料中还原型谷胱甘肽、α-硫辛酸及二者分别与硒的交互作用对牙鲆(Paralichthys olivaceus)生长和抗氧化的影响. 硕士学位论文, 中国海洋大学, 青岛. 2010[20] 周婷婷, 曹俊明, 黄燕华, 等. 饲料中添加谷胱甘肽对吉富罗非鱼生长、组织生化指标和非特异性免疫相关酶的影响. 水产学报, 2013, 37(5): 742—750 Zhou T T, Cao J M, Huang Y H, et al. Effects of dietary glutathione on growth, tissue biochemical parameters and non-specific immune related enzymes of Oreochromis niloticus [J]. Journal of Fisheries of China, 2013, 37 (5): 742—750
周婷婷, 曹俊明, 黄燕华, 等. 饲料中添加谷胱甘肽对吉富罗非鱼生长、组织生化指标和非特异性免疫相关酶的影响. 水产学报, 2013, 37(5): 742—750[21] 曹俊明, 刘晓华, 周萌, 等. 饲料中添加谷胱甘肽对凡纳滨对虾非特异性免疫因子和相关酶活性的影响. 华中农业大学学报, 2007, 26(4): 528—532 Cao J M, Liu X H, Zhou M, et al. Effects of dietary glutathione on non-specific immune factors and related enzyme activities in Litopenaeus vannamei [J]. Journal of Huazhong Agricultural University, 2007, 26 (4): 528—532
曹俊明, 刘晓华, 周萌, 等. 饲料中添加谷胱甘肽对凡纳滨对虾非特异性免疫因子和相关酶活性的影响. 华中农业大学学报, 2007, 26(4): 528—532[22] 刘雅娟, 李雪松, 李沁园, 等. 还原型谷胱甘肽治疗免疫相关疾病的研究进展. 实用临床医药杂志, 2016, 20(17): 205—208 Liu Y J, Li X S, Li Q Y, et al. Research progress of glutathione in the treatment of immune related disease [J]. Journal of Clinical Medicine in Practice, 2016, 20 (17): 205—208
刘雅娟, 李雪松, 李沁园, 等. 还原型谷胱甘肽治疗免疫相关疾病的研究进展. 实用临床医药杂志, 2016, 20(17): 205—208[23] 李继东, 姚成立, 宁海峰. 还原型谷胱甘肽干预高同型半胱氨酸血症致兔动脉粥样硬化的实验研究. 宁夏医科大学学报, 2010, 32(7): 773—776 Li J D, Yao C L, Ning H F. Effect of reduced glutathione on atherosclerosis induced by hyperhomocysteinemia in rabbits[J]. Journal of Ningxia Medical College, 2010, 32 (7): 773—776
李继东, 姚成立, 宁海峰. 还原型谷胱甘肽干预高同型半胱氨酸血症致兔动脉粥样硬化的实验研究. 宁夏医科大学学报, 2010, 32(7): 773—776[24] Louw R. Blood glutathione and subclinical atherosclerosis in African men: the SABPA Study. [J]. American Journal of Hypertension, 2009, 22(11): 1154—1159
[25] Martínez-Álvarez R M, Morales A E, Sanz A. Antioxidant Defenses in Fish: Biotic and Abiotic Factors[J]. Reviews in Fish Biology & Fisheries, 2005, 15(1-2): 75—88
[26] 周婷婷, 曹俊明, 黄燕华, 等. 饲料中添加谷胱甘肽对吉富罗非鱼抗氧化和抗亚硝基氮应激能力的影响. 淡水渔业, 2013, 43(1): 59—62 Zhou T T, Cao J M, Huang Y H, et al. Effects of dietary glutathione on antioxidant and anti nitrogen stress abilities of Oreochromis niloticus [J]. Freshwater Fisheries, 2013, 43 (1): 59—62
周婷婷, 曹俊明, 黄燕华, 等. 饲料中添加谷胱甘肽对吉富罗非鱼抗氧化和抗亚硝基氮应激能力的影响. 淡水渔业, 2013, 43(1): 59—62[27] Giulio R T D, Washburn P C, Wenning R J, et al. Biochemical responses in aquatic animals: A review of determinants of oxidative stress[J]. Environmental Toxicology & Chemistry, 2010, 8(12): 1103—1123
[28] Monks T J, Anders M W, Dekant W, et al. Glutathione conjugate mediated toxicities. [J]. Toxicology & Applied Pharmacology, 1990, 106(1): 1—19
[29] 高姝娟, 赵光程. 抗氧化剂抗脂质过氧化机制的ESR研究. 波谱学杂志, 1998(2): 139—143 Gao S J, Zhao G C. ESR study on the mechanism of anti lipid peroxidation of antioxidants[J]. Chinese Journal of Magnetic Resonance, 1998 (2): 139—143
高姝娟, 赵光程. 抗氧化剂抗脂质过氧化机制的ESR研究. 波谱学杂志, 1998(2): 139—143[30] Sah N K, Kumar S, Subramanian M, et al. Variation in the modulation of superoxide-induced single-strand breaks in plasmid pBR322 DNA by biological antioxidants[J]. Biochemistry & Molecular Biology International, 1995, 35(2): 291—296
[31] CHING B, CHEW S F, WONG W P, et al. Environmental ammonia exposure induces oxidative stress in gills and brain of Boleophthalmus boddarti (mudskipper)[J]. Aquatic Toxicology, 2009, 95(3): 203—212
[32] Lopes PA, Pinheiro T, Santos MC, et al. Response of antioxidant enzymes in freshwater fish populations (Leuciscus alburnoides, complex) to inorganic pollutants exposure[J]. Science of The Total Environment, 2001, 280(1-3): 153—163
[33] 胡毅, 黄云, 钟蕾, 等. 氨氮应激对青鱼幼鱼鳃丝Na-+/K-+-ATP酶、组织结构及血清部分生理生化指标的影响. 水产学报, 2012, 36(4): 538—545 Hu Y, Huang Y, Zhong L, et al. Effects of ammonia stress on Na-+/K-+-ATP, tissue structure of gill and serum physiological and biochemical indexes of mylopharyngodon piceus[J]. Journal of Fisheries of China, 2012, 36 (4): 538—545
胡毅, 黄云, 钟蕾, 等. 氨氮应激对青鱼幼鱼鳃丝Na-+/K-+-ATP酶、组织结构及血清部分生理生化指标的影响. 水产学报, 2012, 36(4): 538—545[34] Xu D D, Liu X H, Cao J M, et al. Dietary glutathione as an antioxidant improves resistance to ammonia exposure in Litopenaeus vannamei[J]. Aquaculture Research, 2012, 43(2): 311—316
-
期刊类型引用(16)
1. 李敏,殷述亭,迟晓丹. 谷胱甘肽生产及在水产养殖中的应用. 饲料工业. 2024(04): 51-55 .  百度学术
百度学术
2. 杨旻珉,屠海慧,邢钱钱,唐琼英,易少奎,夏正龙,蔡缪荧,陈国柱,蓝璇,钟镇霄,黄笑,高权新,杨国梁. 罗氏沼虾急性低温应激响应的转录组分析. 水生生物学报. 2023(04): 581-593 .  本站查看
本站查看
3. 王波,徐伟,关舒,郭凯,张付贤,罗凯,郜卫华,王卓铎. 酸化剂对黄颡鱼生长、抗氧化能力和非特异性免疫的影响. 动物营养学报. 2023(04): 2490-2502 .  百度学术
百度学术
4. 易建华,王辉,王钦,宋庆洋,戴晋军. 饲料中添加还原型谷胱甘肽对黄颡鱼幼鱼生长性能、血清生化、抗氧化和免疫指标的影响. 中国饲料. 2023(15): 167-171 .  百度学术
百度学术
5. 刘学伟,王秋杰,刘淑林,许国焕,邹记兴. 3种添加剂对黄颡鱼抗组胺效果的评价. 饲料工业. 2023(22): 8-16 .  百度学术
百度学术
6. 郑善坚,胡金春,叶霆,史文竞,于瑾. 一种复方中草药制剂对草鱼非特异性免疫机能的影响. 浙江农业科学. 2022(01): 151-153 .  百度学术
百度学术
7. 杨贺舒,孙俊霄,杨慧君,樊启学,袁勇超. 低蛋白饲料对杂交黄颡鱼幼鱼生长性能、体组成、转氨酶活性和抗氧化能力的影响. 水生生物学报. 2022(01): 79-87 .  本站查看
本站查看
8. 张力薇,李学飞,刘振环,李欣蕊,赵军利,顾鎏. 底栖螺酶活性对乐安河沉积物重金属含量生理响应研究. 江西科学. 2022(01): 28-35 .  百度学术
百度学术
9. 龚福来,林雪,王红权. 不同维生素C源对吉富罗非鱼生长性能、抗氧化能力和免疫力的影响. 动物营养学报. 2021(04): 2378-2389 .  百度学术
百度学术
10. 孙迪,张判,潘正坤,左至恒,王超,姚东林,孙卓琳,谢少林,邹记兴,周爱国. 投喂抗应激饲料对翘嘴鲌肠道结构的影响. 水产养殖. 2020(02): 32-36 .  百度学术
百度学术
11. 赵红霞,王国霞,孙育平,胡俊茹,陈冰,彭凯,黄燕华,曹俊明. 水产新型饲料添加剂的研发与应用. 广东农业科学. 2020(11): 135-143 .  百度学术
百度学术
12. 成艳波,李薇,韩木兰,许国焕,谢黎炜,印遇龙,梁建庆. 罗伊氏乳杆菌对组胺引起黄颡鱼肝肠损伤修复效果评价. 水生生物学报. 2019(01): 94-101 .  本站查看
本站查看
13. 林雪,段静娜,赵玉蓉,王红权. 不同组成酸化剂对罗非鱼生长性能和抗氧化及肝脏代谢酶活性的影响. 饲料工业. 2019(08): 51-55 .  百度学术
百度学术
14. 李国明,孙育平,王国霞,陈冰,黄燕华,王咏梅,曹俊明. 饲料中添加谷胱甘肽对花鲈幼鱼生长性能、血清生化指标和抗氧化能力的影响. 动物营养学报. 2019(07): 3207-3217 .  百度学术
百度学术
15. 王红波,王璐,孙宪迅,王晓明. 谷胱甘肽发酵生产及其在动物饲料工业中的应用. 江汉大学学报(自然科学版). 2019(04): 366-370 .  百度学术
百度学术
16. 赵红霞,陈启明,黄燕华,曹俊明,王国霞,陈冰,陈晓瑛. 饲料精氨酸水平对黄颡鱼幼鱼生长性能、消化吸收相关指标、免疫功能和抗氧化能力的影响. 动物营养学报. 2018(12): 5040-5051 .  百度学术
百度学术
其他类型引用(14)



 下载:
下载: